HIV-1流行株去糖基化修饰gp41突变体的构建及其表达和纯化①
2019-04-01邵继平
邵继平 符 健
(海南医学院海南省药物临床前药理毒理学研究重点实验室,海口 571199)
HIV-1病毒(Human immunodeficiency virus type 1,HIV-1)是艾滋病的致病媒介,目前在全球造成3 500万人感染。HIV-1能攻击人体免疫系统CD4+T淋巴细胞,使免疫功能丧失,引起各种机会感染,病死率高。HIV-1感染者要经过长达10年或更长的潜伏期后才发展成艾滋病,后期常常发生恶性肿瘤,以至全身衰竭而死。虽然抗病毒药物可以控制疾病的进程,延长患者的存活时间,但药物不能清除病毒。而且HIV病毒高度变异,患者要不断更换药物,这也增加了艾滋病的治疗难度。因此至今尚无根治艾滋病的特效药物,也无有效的预防疫苗[1-2]。
糖基化作为一种主要的翻译后修饰在病毒颗粒的包装、成熟、感染力和免疫逃避中起着重要作用。Doores研究了不同细胞来源的病毒粒子糖基化特点,他们的结果显示Env糖基化相当简单,几乎完全由高甘露糖型聚糖组成,与产生病毒的细胞来源无关[3,4]。以往的研究表明一半以上的HIV-1包膜糖蛋白(Envelope glycoprotein,Env)由聚糖组成,聚糖参与了Env的正确折叠,有助于糖蛋白功能的发挥,并通过多种机制维持病毒的生物学特性[5-6]。比如通过产生糖盾(Glycan shield)来逃避免疫系统的攻击[7,8];或掩盖潜在的蛋白抗原表位,使其免受机体免疫系统监视;或以无定形的块状物(Amorphous masses)来改变蛋白结构,使病毒蛋白表面免受抗体攻击;而且绝大部分Env是免疫沉默蛋白(Immunologically silent),为免疫逃避创造了条件[9]。糖基化有助于HIV病毒的感染,但Env 仅糖基化不足以形成天然的病毒粒子,其前提是聚糖要对号入座,不能错位。
病毒刺突(Spike)是中和抗体的唯一靶点,因此作为疫苗免疫原,Env是该领域的研究热点[10,11]。HIV-1 Env基因全长约2.6 kb,是变异性最强的基因。不同的HIV-1 Env含有20~30个不等的N糖基化位点。糖基化位点的数量与分布会影响HIV-1 Env的结构和感染力。N糖基化位点少的病毒感染力强,研究显示包膜蛋白V2区或V4区低糖基化与HIV-1的传播能力相关[12-15]。为了进一步证实糖基化位点的数量和分布与病毒感染及致病性的关系,本文利用基因定点突变的方法,将HIV-1 ⅢB、CRF-BC 和CRF-AE 流行株野生型gp41基因中特定的N611Q糖基化位点天冬酰胺Asn突变为谷氨酰胺Gln,使该位点去糖基化,构建了HIV-1 ⅢB、CRF-BC和CRF-AE 流行株野生型和突变型pcDNA3.1-gp41的表达载体。挑选测序正确的阳性克隆转染293 T 细胞,重组蛋白经Ni-NTA柱亲和层析纯化后采用SDS-PAGE电泳分析。本文为研究去糖基化修饰gp41蛋白与疾病发生发展的分子机制奠定了基础。
1 材料与方法
1.1材料
1.1.1实验材料 大肠杆菌DH5a感受态细胞、哺乳动物细胞表达载体pcDNA3.1和HEK 293T细胞由本实验室保存。限制性内切酶XhoⅠ和NheⅠ购自NEB有限公司;Ex Taq试剂盒、T4DNA连接酶等工具酶以及点突变试剂盒均购自TaKaRa公司;质粒小提试剂盒、DNA胶回收试剂盒及PCR产物纯化试剂盒均购自Promega公司;蛋白相对分子质量标准购自Ferments公司;RPMI1640、DMEM 培养基购自Gibco公司;胰酶、脂质体转染试剂盒Lipofecta-mine 2000购自Invitrogen公司;Ni-NTA Resins购自Novagen公司;辣根过氧化物酶标记羊抗鼠IgG(HRP-IgG)和辣根过氧化物酶标记羊抗兔IgG(HRP-IgG)二抗均购自美国Sigma-Aldrich公司。
1.1.2主要仪器和设备 PCT-2000型PCR基因扩增仪购自美国Bio-Rad公司;GeneGenius 全自动凝胶成像仪购自美国Syngene公司;NANO核酸定量仪购自美国Thermo公司;5430R型冷冻离心机购自德国Eppendorf公司;电子天平购自梅特勒-托利多仪器(上海)有限公司;摇床购自哈尔滨市东明医疗仪器厂;电热恒温水槽购自上海一恒科技有限公司。
1.2方法
1.2.1野生型gp41引物设计 根据GenBank数据库中已发表的HIV-1 gp41基因序列,利用Primer5.0 软件,设计并合成了PCR引物(见表1)。同时根据表达载体pcDNA3.1的序列,在gp41基因的N-端引入CD14信号肽,使外源基因以分泌形式表达于胞外,在C-端添加His标签序列、酶切位点和终止密码子。在上游引物5′端加上NheⅠ酶切位点,下游引物5′端加上XhoⅠ酶切位点。经引物软件分析,引物自身不互补或形成发夹结构。设计好的gp41基因长度约为700 bp。
1.2.2去糖基化gp41引物设计 运用定点突变的方法去除gp41 N-糖基化位点,将天冬酰胺突变为谷氨酰胺。破坏这些位点的糖基化修饰能力。设计并合成了一系列相应的DNA引物(表1),利用CO-PCR的方法进行目的基因的扩增。

表1 PCR 引物Tab.1 PCR primers
1.2.3野生型和去糖基化gp41表达载体的构建及鉴定 分别以表1所列的引物对作为上、下游引物,以env质粒为模板,扩增野生型和去糖基化gp41基因片段,再进行目的基因和载体双酶切,12 h后琼脂糖凝胶电泳鉴定、切胶回收酶切产物。PCR产物克隆到pcDNA3.1 的NheⅠ与XhoⅠ位点之间,连接产物转化大肠杆菌DH5α的感受态细胞,在氨苄青霉素选择压力下挑取单菌落至LB培养液中,37℃振荡培养过夜,用碱裂解法小量提取质粒后进行PCR和双酶切鉴定,挑选正确的阳性克隆送上海英骏公司测序,采用酶切和Sanger 测序的方法鉴定插入片段。并进行目的基因的序列比对。测序正确的重组质粒分别命名为pcDNA3.1/gp41-ⅢB、pcDNA-3.1/gp41-BC、pcDNA3.1/gp41-AE。
运用定点突变的方法去除野生型gp41 N-糖基化位点,破坏这些位点的糖基化修饰能力。应用PCR方法,以鉴定好的pcDNA3.1/gp41质粒为模板,以表1所列的引物对作为上、下游引物,按照TaKaRa 点突变试剂盒方法对N 611的糖基化位点进行突变,经测序验证突变正确后,将此突变型重组质粒命名为pcDNA3.1/Mgp41-ⅢB、pcDNA3.1/Mgp41-BC、pcDNA3.1/Mgp41-AE。
1.2.4序列比对分析 进入网页:http://www.ncbi.nlm.nih.gov/,打开Blast,点击“Nucleotide-nucleotide BLAST(blastn)”,将测序序列直接拷贝到方框里,点击“BLAST”,新页面完全出来以后,点击“Format”。将目的基因序列和测序序列进行比对。
1.2.5野生型和去糖基化gp41重组蛋白的表达 选择HIV-1 ⅢB 标准株、中国大陆地区主要流行株CRF-BC 和海南省流行株CRF-AE gp41序列构建了重组质粒。293T细胞用含10%FBS、100 U/ml青霉素、100 U/ml链霉素的DMEM培养基在37℃、5%CO2条件下常规培养。采用Lipofectamine 2000进行转染,具体操作按试剂盒说明书进行。转染前24 h 以2×105ml-1的密度将细胞接种于60 mm培养皿中,当贴壁细胞密度达到90%融合度时即可进行转染。将1 mg质粒与100 ml PBS混合,再将1 ml脂质体与10 ml PBS混合,将两者轻轻混匀后,室温静置15 min,滴加入培养皿中。以pcDNA3.1/gp41和pcDNA3.1/Mgp41重组质粒转染293T细胞,进行重组蛋白的真核表达。
1.2.6野生型和去糖基化gp41重组蛋白的纯化 转染36~48 h后收集培养上清液,4 000 r/min低速离心5 min,去除细胞碎片。取2 ml Ni-NTA树脂装柱,用pH7.0磷酸盐缓冲液洗柱,直至流出液pH为7.0。将收集的细胞上清液过Ni-NTA柱,进行gp41重组蛋白的纯化。将得到的重组蛋白洗脱液进行离心超滤,将蛋白滞留在超滤管上,以达到浓缩的效果。纯化的gp41融合蛋白能稳定存在于溶液中。
1.2.7免疫杂交(Westem blot)分析 取25 μg纯化后的蛋白,加适量2×SDS-PAGE 上样缓冲液混匀,100℃煮5 min,离心1 min。利用12%SDS-PACE胶电泳分离蛋白,再电转于硝酸纤维素膜上,80 V,进行2 h免疫杂交。5%的脱脂奶粉封闭2 h,加兔抗HIV-1 gp41多肽抗体为一抗(1∶1 000)进行孵育,洗膜后再加辣根过氧化物酶标记的羊抗兔IgG(1∶5 000)为二抗孵育,进行免疫杂交分析。最后加显色液,显影,定影。
2 结果
2.1野生型和突变型 HIV-1 gp41的结构 gp41跨膜糖蛋白相对分子质量为41 000,由345个氨基酸组成,在HIV-1病毒进入靶细胞中起重要作用。gp41主要由三部分构成:膜外区(aa512-683)、跨膜区(aa684-705)和胞质区(aa705-856)。膜外区又分为5个功能区:融合多肽(FP,aa512-527);polar区(PR,aa525-543);N端重复序列(NHR,aa546-581)和C端重复序列(CHR,aa628-661);抗原决定环(ID环,aa598-604)。NHR和CHR可形成六聚体(6-HB),是膜外区的核心结构。gp41结构如图1所示。
2.2野生型和突变型 HIV-1 gp41基因的扩增 运用PCR方法扩增野生型和突变型 HIV-1 gp41基因,DNA电泳结果出现了700 bp左右的目的条带,与预期的基因大小一致,如图2所示。
2.3野生型和突变型重组质粒的双酶切鉴定 根据pcDNA3.1载体的图谱特征,选用NheⅠ与XhoⅠ
图1 HIV-1 gp41 结构功能域Fig.1 Schematic diagram of HIV-1 gp41
双酶切重组质粒来鉴定其插入方向。图3结果显示双酶切后,电泳图上出现了大小约700 bp的基因片段和约4 500 bp的载体片段。我们初步证明所挑选的阳性克隆为正确的重组转化子。
2.4野生型和突变型DNA序列的同源比对 用测序引物对重组质粒进行测序,进一步确定其插入方向及阅读框的正确性。Chromas结果显示四种碱基的信号强,峰值高,表明测序的特异性好。所测得的DNA序列经Genetool软件比对发现插入片段寡核苷酸序列与设计的靶点序列完全吻合,gp41基因被正向插入于NheⅠ和XhoⅠ双酶切位点之间。阅读框分析结果证实了该重组质粒的正确性,且无任何突变,与预期一致(图4)。由鉴定结果可以看出:重组质粒构建成功。

图2 Gp41基因的PCR扩增Fig.2 PCR amplification for gp41 gene
图3 双酶切鉴定gp41 基因Fig.3 NheⅠand XhoⅠdouble digest for gp41 gene
2.5野生型和突变型重组蛋白的免疫印迹分析 取25 μg蛋白加入适量的2×SDS上样缓冲液,迅速混匀后100℃加热3~5 min按常规方法进行SDS-PAGE电泳分离总蛋白,并电转至硝酸纤维素膜上(BIO-RAD半干转膜,80 V,2 h)。以抗gp41抗体为一抗(1∶1 000),HRP标记的羊抗兔IgG为二抗(1∶5 000),进行Western blot分析。图5结果表明gp41融合蛋白在293T细胞得到大量表达,表达的融合蛋白可被抗gp41的特异性抗体所识别,在26 000 处出现了特异性反应条带,条带的大小与预测的目的蛋白大小一致,本研究采用真核表达系统成功表达了gp41融合蛋白。从图5中Lane 1到Lane 6融合蛋白的免疫杂交结果可见在26 kD处出现阳性条带。
2.6野生型和突变型重组蛋白的浓度检测 用Nano紫外分光光度计测定纯化的野生型和突变型重组蛋白,浓度和含量如表2所示。可见野生型和突变型gp41蛋白能在293T细胞中大量表达。

图4 gp41 基因的测序图谱Fig.4 Sequencing map for gp41 gene

图5 重组蛋白的免疫印迹分析Fig.5 Western blot for gp41 recombinant proteins
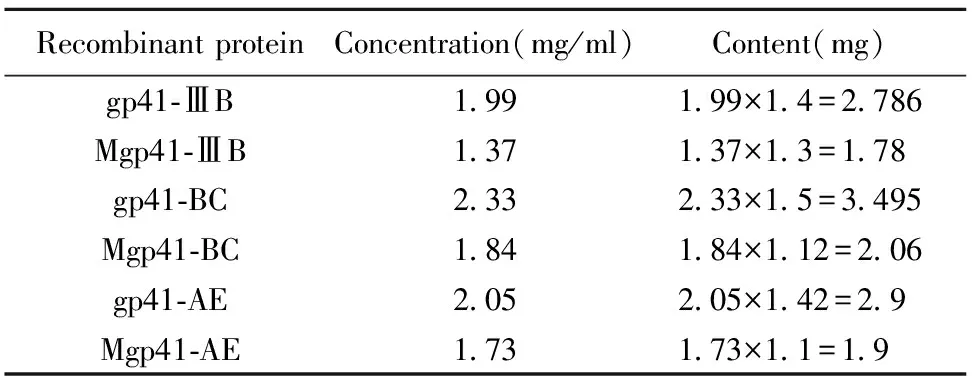
表2 gp41重组蛋白浓度Tab.2 Concentration of gp41 recombinant protein
3 讨论
艾滋病已成为威胁人类健康的重大传染病之一。中国是艾滋病感染人数众多的国家。自1995年后我国HIV的流行进入快速增长期,截至去年9月底,全国存活的艾滋病感染者为74.7万。目前艾滋病整体疫情处于低流行状态,但又呈增长趋势。
蛋白质糖基化的分子机制与疾病的发生发展密切相关,已成为生物学研究领域中的热点之一。HIV-1 Env是一种高度糖基化的糖蛋白,其糖基化程度对蛋白稳定性和功能方面具有重要的影响,与其生物学功能的发挥密切相关。病毒包膜蛋白在加工过程中需要进行N-糖基化,即N-X-S/T(X为除P之外的任意氨基酸)修饰。N-联糖基化是一种蛋白翻译后修饰,合成糖基侧链的过程,在很多方面影响蛋白的功能,比如蛋白正确折叠,维持蛋白构型、改变蛋白空间结构,增加蛋白的稳定性、调节蛋白的抗原性,影响病毒包膜蛋白与受体、辅助受体的结合、介导膜融合和病毒进入细胞,从而影响HIV病毒的传播等。包膜蛋白过度糖基化可能会掩盖其抗原表位,导致病毒逃逸免疫应答。
我国主要的HIV-1流行株是B′,CRF07-BC以及CRF01-AE亚型。因此,艾滋病研究要从我国的实际情况出发。本文利用基因定点突变的方法,将HIV-1 ⅢB、CRF-BC 和CRF-AE 流行株野生型gp41基因中特定的N611Q糖基化位点天冬酰胺Asn突变为谷氨酰胺Gln,使该位点去糖基化,成功构建了HIV-1 ⅢB、CRF-BC 和CRF-AE 流行株野生型和突变型pcDNA3.1-gp41的表达载体,分别命名为pcDNA3.1/gp41-ⅢB、pcDNA3.1/gp41-BC、pcDNA3.1/gp41-AE和pcDNA3.1/Mgp41-ⅢB、pcDNA3.1/Mgp41-BC、pcDNA3.1/Mgp41-AE。挑选测序正确的阳性重组质粒转染293 T细胞,收获的重组蛋白经Ni-NTA柱亲和层析纯化后采用SDS-PAGE电泳分析,蛋白条带单一,几乎无杂带,说明Ni-NTA柱纯化出来的蛋白纯度高,经Western blot验证其能特异性结合抗gp41抗体,而且gp41目的蛋白在真核体系的表达量分别高达2.786、1.78、3.495、2.06、2.9和1.9 mg。本文为研究去糖基化修饰gp41对病毒致病力的影响与疾病发生发展的分子机制奠定了基础。