SVF-gel促进糖尿病鼠创面愈合的初步实验研究
2019-04-01蒯权王宜梅李聪黄娜祝愿文辉才
蒯权 王宜梅 李聪 黄娜 祝愿 文辉才
慢性创面多发于糖尿病足、静脉性溃疡、褥疮及深度创伤等疾病[1],目前临床上仍缺乏有效的治疗方法,其修复难点在于新生血管较正常创面少、创面局部血液供应不足、炎症因素持续存在等[2]。血管基质组分(Stromal vascular fraction,SVF)是脂肪来源干细胞(Adipose-derived stem cells,ADSCs)与其他细胞成分相混杂的细胞群体。有研究表明,SVF/ADSCs不仅具有自我更新和分化为各系组织细胞的能力,还可旁分泌多种促进血管新生的生长因子,较其他成体干细胞更易获取,储量丰富,较少涉及伦理问题,被广泛地应用于缺血性疾病的治疗[3-5]。但是SVF和ADSCs的制备过程较为复杂,需要特定的设备装置;培养过程中添加的异种血清及血清中尚未明确的蛋白都可能造成污染。SVF-gel是将脂肪组织中的成熟脂肪细胞最大程度破坏而获取的富集有脂肪来源干细胞和细胞外基质(Extracellular matrix,ECM)的混合物[3-5]。研究证实,局部移植SVF-gel到大鼠缺血性皮瓣中,可上调组织中的VEGF和bFGF的表达,促进皮瓣血管的新生[6]。本实验拟研究SVF-gel对糖尿病鼠创面愈合的促进作用,为SVF-gel治疗慢性创面提供依据。
1 材料与方法
1.1 材料
8~9周龄SPF级SD大鼠,体质量200~220 g(南昌大学医学院动物中心)。
链尿佐菌素、Ⅰ型胶原酶、红细胞裂解液(S igma公司,美国),柠檬酸、柠檬酸钠(北京化工厂),水合氯醛(上海化工厂),CD34免疫组织化学试剂盒(中杉公司),PBS、胎牛血清、高糖DMEM培养基(Gibco公司,美国)。
离心机(中科中佳科学仪器有限公司),吸脂针Tonnard HarvesterTM(Tulip公司,美国),一次性螺旋口无菌注射器10 m L、无菌二通接头(BD公司,美国),200目筛网(CORNING公司,美国)。
1.2 方法
1.2.1 脂肪组织的获取
8周龄左右的SD雄性大鼠,腹腔注射麻醉,在超净工作台上,取大鼠双侧腹股沟处的脂肪组织,用含有双抗的PBS反复冲洗去除血液,剔除脂肪组织中的小血管和结缔组织并剪碎。
1.2.2 SVF-gel的制备
参照文献[7]的方法:将剪碎的脂肪组织以1 200 g离心3 min,弃下层液体部分,得到中间层的脂肪,同时收集上层的油脂备用。将脂肪置入2个内径为2.4 mm直二通管相连的10 mL螺旋口注射器中,以10 mL/sec的推注速度反复推注2 min,成乳糜状后过滤除去粗大的结缔组织,将0.5 mL的油脂加入乳糜化的脂肪组织中,推注3~5次,再以2 000 g离心3 min,弃去下层液体以及上层大量的油脂,得到中间层凝胶样的物质即为SVF-gel(图1)。

图1 制备的SVF-gel Fig.1 SVF-gel
1.2.3 SVF悬液的制备
收集大鼠腹股沟处的脂肪组织10 m L,加入等体积0.1%Ⅰ型胶原酶消化液混匀,在37℃恒温摇床中消化1 h后,用200目尼龙网过滤,1 500 g离心5 min,去上清,完全培养基重悬细胞沉淀,加入红细胞裂解液,室温下孵育5 min,1 200 g离心3 min后,将细胞沉淀加入生理盐水混悬并计数[8]。
1.2.4 建立糖尿病大鼠创面模型
将SD雄性大鼠适应性喂养1周后,禁食12 h,单次性腹腔内注射55 mg/K g剂量的STZ(溶于0.1 mmol/L柠檬酸缓冲液,pH 4.0),48 h后尾静脉取血,用血糖试纸测大鼠的非空腹血糖值≥13.8 mmol/L,并观察1周,稳定者为糖尿病大鼠模型[9]。将36只糖尿病鼠腹腔注射麻醉后,在背部两侧分别制作直径为1.2 cm的圆形皮肤全层创面。随机分为A组(SVF-gel)组、B组(SVF悬液)、C组(生理盐水),每组12只大鼠。B组创面周围注射1 mL的SVF细胞悬液(SVF细胞数约为1×105个),A组创面周围注射含有相同SVF细胞数的SVF-gel,C组创面周围注射1 mL生理盐水。观察治疗后0 d、3 d、7 d、10 d和14 d创面闭合情况,并于治疗后14 d每组取4只大鼠观察创面组织学变化。
1.3 观察指标
1.3.1 不同时间三组动物创面愈合大小
每组抽取4只大鼠观察拍照,每只大鼠2个创面,每组共8个创面用来记录各观察时间点创面愈合情况。拍照后以Image Proplus 6.0图像分析系统测量创面面积,计算创面愈合率。

1.3.2 组织学观察
治疗后14 d,每组4只大鼠,取创面及周围2 mm组织,4%多聚甲醛固定,梯度乙醇脱水,石蜡包埋、切片、HE染色,镜下观察创面组织内炎症细胞浸润情况、创面内新生血管的形成,以及肉芽组织生长和再上皮化情况。
1.3.3 免疫组织化学染色观察
同法取材、切片,按CD34免疫组织化学染色试剂盒说明书进行染色,光镜下观察血管形成情况,棕黄色即为阳性染色。
1.4 统计学处理
2 结果
2.1 构建糖尿病大鼠创面模型
STZ腹腔注射1周后,尾静脉取血,测得所有大鼠的血糖值均大于13.8 mmol/L,且有明显的多饮、多食、多尿、毛色变黄等症状,无大鼠因血糖过高死亡。大鼠背部创面形成后分笼饲养,常规观察,术后动物无死亡,全部存活。
2.2 大体观察结果
术后3 d拆去敷料后各组创面无血肿、感染及其他不良反应。注射治疗后7 d,各组创面表层都被淡红或暗红色的痂皮覆盖,揭去血痂后,A组创面肉芽组织生长良好,颜色鲜红,湿润,触之易出血;B组创面内也可见肉芽组织生成,未见液体渗出;C组创面肉芽组织生长缓慢,颜色略暗,部分表面尚有渗出。治疗10 d后,A组创面面积较另两组显著减小,再上皮化明显,C组创面愈合较缓慢,表面仍有部分血痂及少许渗出。治疗14 d后,A组创面几乎完全愈合,B组创面部分愈合,表面有薄层的上皮覆盖,C组创面愈合最差,创面面积明显大于另两组(图2)。
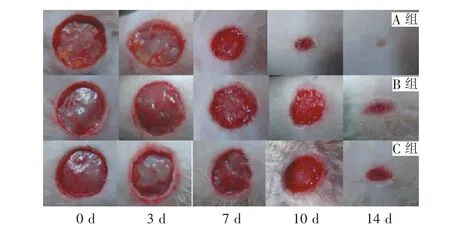
图2 各组创面在不同时间点愈合情况Fig.2 Wound healing at different time points in each group
2.3 创面愈合率比较
A、B组各时间点创面愈合率均优于C组(P<0.05),且A组各时间点创面愈合率均优于B组(P<0.05)(表1)。
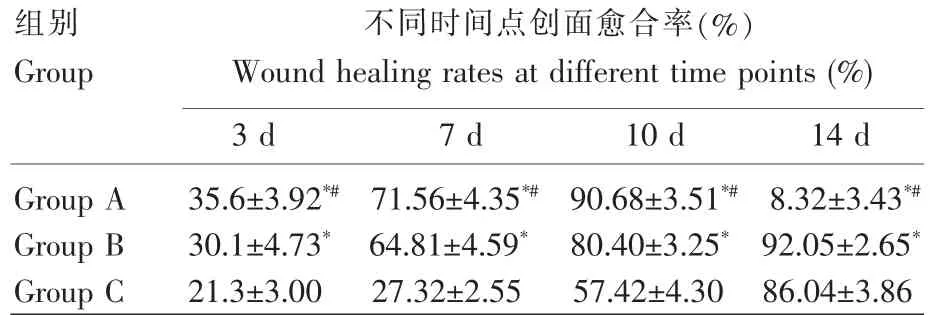
表1 各组不同时间点创面愈合率比较Table 1 Comparison of wound healing rates at different time points in each group
2.4 组织学观察
HE染色见C组创面内有大量炎症细胞浸润和成纤维细胞,细胞排列紊乱,新生血管少,肉芽组织结构疏松,再上皮化不完整。A组与C组相比,炎症细胞浸润减少,真皮毛细血管数量明显增多,再上皮化明显,肉芽组织结构致密。B组与C组相比,炎症细胞浸润减少,较多的胶原纤维及毛细血管,再上皮化较完整,但不及A组(图3)。
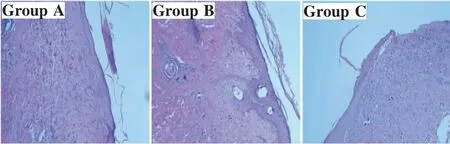
图3 治疗后14 d各组组织形态学观察(200×)Fig.3 Histological observation of each group by HE staining 14 days after treatment(200×)
2.5 免疫组织化学染色观察
各组创面肉芽组织内均有垂直于创面的新血管生成。A、B两组新生血管数量多于C组,C组部分新生血管尚无明显的管腔结构,血管断层仅有单个内皮细胞。A、B组创面内均可见较多具有成熟管腔的新生血管,尤以A组为多(图4)。
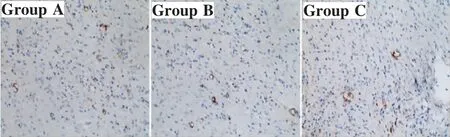
图4 治疗后14 d各组免疫组化观察血管形成情况(200×)Fig.4 The angiogenesis in each group detected by immunohistochemical staining 14 days after treatment(200×)
3 讨论
创面组织的愈合是通过一个及时有序的连续过程来恢复组织功能与解剖的完整性。当创面受到内外因素的影响,这种有序的过程会受到干扰,使创面停滞在病理炎症反应状态,导致创面迁延不愈[10]。血管再生是创面修复的重要环节,血管新生速度减慢或者功能降低都有可能导致局部血液循环不良,周围组织缺血缺氧。这样不仅会损害人体抵抗细菌的防御系统,使创面易感性增加,也会影响机体的新陈代谢能力,使创面内的胶原蛋白合成减少,血管内皮细胞、成纤维细胞、表皮细胞等的增殖迁移受到限制[11]。
治疗慢性创面的方法主要包括外科治疗(清创、植皮、皮瓣移植等)、高压氧治疗、外源性生长因子的应用、负压引流术和光子治疗等,疗效各异[12]。目前,干细胞疗法被认为是最具前景,最早应用于慢性创面治疗的是BMSC[13-15],但抽取骨髓是高度侵入性的,且数量稀少[16]。与此相比,ADSC获取容易,且含量远高于BMSC,更有研究证实ADSC增殖分化能力强于BMSC[17-18]。因此,ADSC可作为一种更加优质的细胞资源用于慢性创面的治疗。大量报道认为,新鲜分离的SVF细胞和培养后的ADSC用于治疗糖尿病或难愈性溃疡,其促愈合机制不仅是直接分化为像血管内皮细胞、成纤维细胞和表皮细胞等各种修复细胞,而且还可旁分泌出多种生物活性分子,如VEGF、HGF、FGF等来促进血管生成和创面再上皮化,减少炎症和细胞凋亡,参与创面的损伤修复,实现创面加速愈合过程[19-22]。
SVF-gel是将脂肪组织经简单的机械方法处理而获取的凝胶状物质,含有高度浓缩的具有生物活性的ECM和SVF。本实验中,我们局部注射SVFgel到糖尿病鼠创面中,发现治疗后大鼠创面愈合率在各个时间点都高于另两组,组织学结果也证实SVF-gel可明显减轻创面局部炎症反应,增加血管网的数量,促进肉芽组织生长,加速再上皮化的形成。与SVF悬液相比,虽然两者的SVF细胞数相同,但SVF-gel显示出更佳的治疗效果。这主要是SVFgel中的ECM发挥着天然细胞载体的作用。研究表明,如直接将ADSC注射到病变部位,微环境中缺血缺氧和炎症反应、注射过程中的机械性损伤,以及经过组织间隙的大量流失,均可导致其在靶区域存活率下降,使之发挥的作用有限[23-24]。而ECM包含了纤维蛋白、胶原蛋白、弹性蛋白和蛋白聚糖,可以为ADSC提供良好的微环境,调节细胞的行为,促进细胞的增殖和分化潜能,让ADSC能分泌更多的血管生长因子,保护其免遭巨噬细胞的吞噬,使之能在创面处充分地发挥促愈合的能力[25-26]。
SVF-gel治疗机制尚不清楚,还有待于进一步的研究。
