BK通道抑制剂对人脐带华通胶来源的间充质干细胞的增殖、凋亡及细胞因子的影响
2019-04-01宋阿会佟琰刘英莉
宋阿会 佟琰 刘英莉
间充质干细胞(MSC)是一类具有多向分化和自我更新能力的细胞,大量研究证明了间充质干细胞在各种疾病治疗中的作用,尤其是可以通过自分泌和旁分泌等作用参与免疫疾病的调控[1-2]。MSCs能够通过分泌细胞因子(如TGF-β、PGE2等)抑制T细胞增殖,促进Th1细胞向Th2细胞转化,影响B细胞成熟和抗体产生等,参与机体的固有免疫和适应性免疫,也能够促使髓样细胞分化,从而发挥抗炎和免疫负调控的作用[3]。最近研究表明,人脐带华通胶来源的间充质干细胞 (Human umbilical cord Wharton's jelly derived mesenchymal stem cells,WJMSC)与BMSC具有类似的形态和细胞表型[4],但WJ-MSC表达的HLA-ABC分子较少,免疫原性更低,且来源于丢弃的脐带,不受伦理限制,更有希望应用于各种疾病的治疗[5]。
大电导钙依赖性钾(BK通道)分布于神经元、各脉管系统、肾小球、肾小管等细胞膜上[6-8],参与血压调控,神经递质释放,维持钾离子平衡等生理活动[9]。BK通道是由α亚基单独或联合不同类型的β亚基组成的G蛋白偶联的跨膜蛋白,包含感应膜电位的电压敏感性跨膜域(Voltage sensing domain,VSD),结合钙离子的胞质内域(Cytosolic domain),以及负责钾离子内流的门孔通道功能域(Pore gate domain,PGD)[8]。研究发现,BK通道也参与各种炎症的调节作用,如哮喘疾病中BK通道激活剂能够减轻气道反应[10];同样,BK同道还参与IL-1b诱导的单核细胞和内皮细胞的黏附[11],有望成为炎症治疗的靶点。此外,有研究已经在BMSC上发现了BK通道的表达和活性,且发现BK通道活性能够影响BMSC的增殖和分化能力[12]。但是,目前尚无研究证实BK通道活性对WJ-MSC的细胞活性和凋亡的影响,以及是否影响WJ-MSC分泌细胞因子。本研究尝试探索BK通道抑制剂预处理WJ-MSC后对其细胞活性和凋亡的影响,并通过检测预处理后其炎症因子(IL6,IL10)的表达,探究BK通道抑制剂是否影响WJMSC的旁分泌作用,明确BK通道抑制剂对WJMSC的免疫特性的影响。
1 材料和方法
1.1 主要试剂和耗材
αMEM培养基(Hyclone,美国),胎牛血清(Bioind,以色列),青霉素和链霉素(Gibco,美国),0.25%胰蛋白酶(Gibco,美国),CCK-8检测试剂盒(Rainbio,上海睿安生物科技有限公司),Annexin-V-FITC/PI试剂盒(BD,美国),Elisa检测试剂盒(Bioligand,美国),PBS溶液(Hyclone,美国),Hanks溶液(Gibco,美国),Paxilline(Alomone,美国),电转液、电泳液(生工生物工程有限公司,中国),BKα抗体(Alomone,美国),GAPDH抗体(Proteintech,美国),RIPA(碧云天,中国),蛋白磷酸酶抑制剂混合物(索莱宝,中国)。
超净工作台、细胞培养箱(Thermo,美国);多功能酶标仪(BioTek,美国),流式细胞分析仪(Beckman,美国),电泳仪(Bio-Rad公司,美国);超敏化学发光成像系统(GE公司,美国)。
1.2 细胞培养和预处理
1.2.1 原代细胞的分离培养
经孕产妇知情同意,取其剖宫产分娩时舍弃的新鲜脐带组织(标本来源于上海市第一妇婴保健院),装入事先预冷的含有1%青霉素和链霉素的PBS溶液中。将脐带组织以PBS洗涤数次,去除血液后移至Hank's溶液中,去除两条脐静脉和一条脐动脉,剥离外皮,暴露中间的胶冻样的华通胶,剪成小段。将剪成段的华通胶移入空培养皿中,晾干,将其剪至1 mm3大小,用勺子将其铺至T75培养瓶底部,反转培养瓶,在组织块对侧加入10 mL含有10%胎牛血清和1%双抗的αMEM培养基,于37℃培养箱中过夜。8~16 h后,将培养瓶反转使培养基漫过组织块,继续培养约2周。至组织块周围有细胞爬出时,去除组织块,用0.25%胰蛋白酶消化约30~60 sec,中止消化后1 000 r/min离心5 min,重悬后接种至新培养皿中,每3天换一次液。取第3~7代细胞用于后续实验。
1.2.2 WJ-MSC预处理
取第3~7代WJ-MSC细胞,以106个/孔接种至6孔板,待其生长至80%融合时加入不同浓度的Paxilline(0μM、0.1μM、1μM、10μM)孵育24 h,取上清或细胞用于后续检测。
1.3 Western-b lot检测BK通道的表达
取第3~7代WJ-MSC细胞,以106个/孔接种至6孔板,待其生长至80%融合时去除上清,加入RIPA和蛋白酶磷酸酶抑制剂混合物配置的裂解液,裂解细胞,用BCA法定量各组蛋白浓度后,加入适量5×loading buffer,100℃煮10 min。配置8%的SDSPAGE胶,将3个不同来源的脐带华通胶间充质干细胞所提取的蛋白样品在上样前100℃煮5 min,以80 V恒压电泳至染料达胶底部,220 mA恒流转膜2 h,膜在5%脱脂牛奶中室温封闭2 h,加入一抗,4℃过夜孵育8~16 h,TBST洗3次,二抗室温孵育1 h,TBST洗3次后显色。Image J软件分析灰度值。
1.4 琼脂糖凝胶电泳检测编码BK通道的KCNMA1基因表达
采用TRIzol法提取第3~7代细胞总RNA,利用Prime Script RT Master Mix (Takara036A)将RNA逆转录为cDNA,采用PCR法扩增KCNMA1基因,所得产物在1.5%的琼脂糖胶中进行电泳。KCNMA1基因正向引物序列为:5’-GGCAGCAGTCTTAGAATGAGTAG-3’;反向引物序列为:5’-AAAGCCCACCACATGCGTT-3’。
1.5 CCK-8法检测细胞活性
细胞预处理后,各孔加入10μL CCK-8,37℃孵育4 h后,用微孔酶标仪检测各孔在450 nm处的吸光度值。
1.6 Annexin-V-FITC/PI检测细胞凋亡
细胞预处理后,用0.25%胰蛋白酶消化各孔细胞,取一组空白组作为空白对照,其余各孔细胞消化后1 000 r/min离心5 min,弃上清,用100μL Annexin Buffer重悬后加入4μL AnnexinV,避光孵育10 min,加入4μL PI后立即上机检测。
1.7 Elisa法检测细胞因子
取细胞预处理后的上清,按照Elisa试剂盒步骤依次检测各组IL6、IL10浓度。
1.8 数据处理及统计学分析
所有实验均用GraphPad软件统计分析3次独立实验结果,计算各组间均值和标准差,多组间差异比较用ANOVA one-way检验,P<0.05表示差异有统计学意义。
2 结果
2.1 原代WJ-MSC上BK通道的表达
光镜观察发现,原代WJ-MSC为梭状,似成纤维细胞,与间充质干细胞描述一致(图1)。Westernb lot检测显示,3个不同来源脐带组织的原代WJMSC提取的蛋白质,均可检测到BK通道抗体表达(图2)。同时,以琼脂糖凝胶电泳在这3个不同标本来源的间充质干细胞上鉴定到了编码BK通道的KCNMA1基因的表达(图3),即不同来源的脐带华通胶分离的间充质干细胞均有BK通道的表达。
图1 光镜下原代WJ-MSC形态Fig 1 The morphology of primary WJ-MSC cells under optical microscope

图2 不同标本来源WJ-MSC中BK通道的表达Fig.2 The protein expression of BK channel in different WJ-MSC was detected
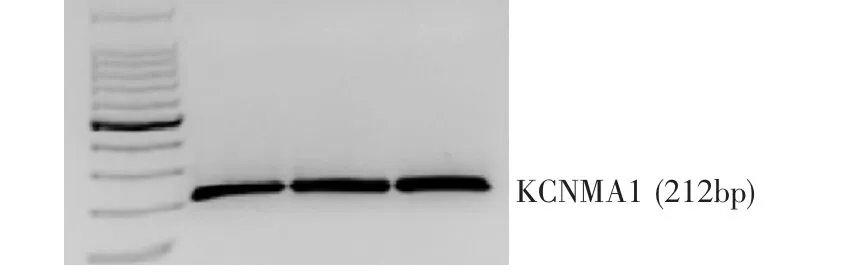
图3 不同标本来源WJ-MSC中编码BK通道的KCNMA1Fig.3 The gene KCNMA1 encoding BK channel in WJ-MSC
2.2 不同浓度Paxilline对WJ-MSC活性的影响
不同浓度Paxilline(0μM、0.1μM、1μM、10μM)处理WJ-MSC 24 h后,用CCK-8试剂盒检测各组在450 nm处的吸光度值。结果显示,低浓度的BK通道抑制剂Paxilline对细胞活性没有明显影响,而高浓度Paxilline(1μM、10μM)可显著降低细胞活性(P<0.01)(图4)。
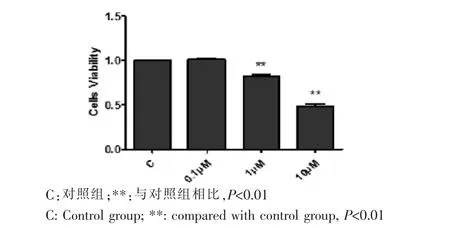
图4 CCK-8法检测不同浓度BK通道抑制剂对WJ-MSC活性的影响Fig.4 The cell viability of WJ-MSC was detected by CCK-8 after treated with different
2.3 不同浓度Paxilline对WJ-MSC凋亡的影响
不同浓度Paxilline(0μM、0.1μM、1μM、10μM)处理WJ-MSC 24 h后,收集细胞上清及细胞,通过Annexin-V-FITC/PI试剂盒检测细胞凋亡情况。结果显示,高浓度Paxilline(10μM)可明显增加Annexin-V单阳细胞的比例,促进WJ-MSC细胞的凋亡(P<0.01),而低浓度Paxilline对WJ-MSC细胞的凋亡无明显影响(图5)。
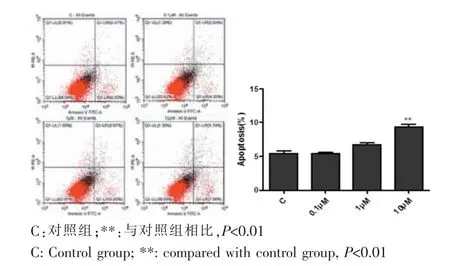
图5 流式细胞分析仪检测不同浓度BK通道抑制剂处理WJ-MSC后凋亡细胞比例Fig.5 The cell apoptosis ratio of WJ-MSC was detected by flow cytometry after treated with different concentration of BK channel inhibitors
2.4 不同浓度Paxilline对WJ-MSC分泌IL6、IL10的影响
不同浓度Paxilline(0μM、0.1μM、1μM、10μM)处理WJ-MSC 24 h后,用Elisa检测试剂盒检测各组上清中IL6和IL10的浓度。结果显示,各浓度Paxilline均能够促进WJ-MSC分泌IL6(P<0.01),但并不增加IL10的分泌(图6)。
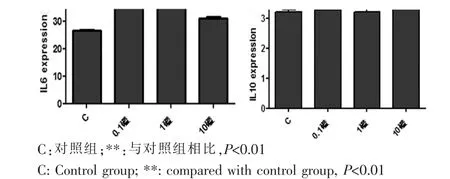
图6 Elisa法检测不同浓度BK通道抑制剂对WJ-MSC分泌的IL6和IL10的表达Fig.6 The expression of IL6 and IL10 secreted by WJMSC was detected by Elisa after treated with different concentration of BK channel inhibitors
3 讨论
大量的研究均肯定了间充质干细胞在各种疾病中存在的治疗作用,亦可通过分泌细胞因子、生长因子、胞外囊泡等发挥抗炎、免疫调控等作用[2,13-14]。由于表面分子表达的差异,不同来源的间充质干细胞具备的免疫特性有所差异[15]。其中,WJ-MSC来源更原始,免疫原性更低。同时,研究还发现,通过一些干预方法预处理间充质干细胞能够改变其免疫调节能力[16],如使用低浓度LPS预处理MSC后,能够增强MSC对高浓度LPS介导的凋亡的耐受作用[17]。本研究利用组织贴壁法成功从人脐带组织中分离培养出WJ-MSC,利用Western-b lot检测了WJ-MSC上BK通道的表达,与BMSC研究结果一致,BK通道也存在于WJ-MSC上[12]。Paxilline可选择性抑制BK通道,在不同浓度(0μM、0.1μM、1μM、10μM)预处理下,高浓度Paxilline能够抑制WJ-MSC的细胞活性,促进其凋亡。表明抑制BK通道活性能够降低WJ-MSC的细胞活性,促进其凋亡。
研究表明,BK通道参与各种炎症过程的调节,如BK通道抑制剂能够减少LPS刺激下巨噬细胞分泌的炎症因子(TNFα),能够减轻胰腺炎小鼠模型中巨噬细胞炎症反应等,但目前尚无研究探究BK通道抑制剂对WJ-MSC分泌的炎症因子的影响。细胞因子IL6可由多种类型细胞分泌产生[18],发挥不同的效应:①可诱导肝脏细胞合成急性时相蛋白(如C反应蛋白、血清淀粉样蛋白A)等,启动急性炎症反应[19];②作用于骨髓,可促进血小板释放[20];③与TGF-β共同促进CD4+的T细胞向Th17细胞分化,上调Th17/Treg细胞的比例,促进自身免疫性疾病以及慢性炎症的发展[21]。细胞因子IL10则主要由受刺激的髓样细胞和淋巴细胞产生[22],能够抑制促炎因子的分泌,增强B淋巴细胞分化及抗体的产生[23]。这两种细胞因子的平衡有助于调节多种疾病的炎症反应过程[18]。本研究发现,抑制BK通道后可明显增加WJ-MSC分泌IL6的水平,但不影响其IL10的分泌。表明BK通道的活性能够影响WJ-MSC细胞因子的分泌,进而影响其在免疫反应中发挥调节作用。
本研究存在一定的局限性。首先,还需通过细胞电生理实验,以进一步验证WJ-MSC上BK通道的活性;其次,针对BK通道的抑制只使用了抑制剂,或可利用shRNA敲减WJ-MSC上的BK通道后进行验证,同时由于一直没有探索出原代干细胞的过表达质粒构建条件,尚缺乏过表达BK通道以进一步检验上述结论。此外,虽然BK通道抑制剂能够促进WJ-MSC分泌的IL6水平,但抑制BK通道后对WJ-MSC的免疫负调控作用的影响尚需进一步研究明确。
