miR-20a-3p靶向STAT3调控大鼠脊髓损伤轴突修复
2019-03-30张衍军王志杰王天仪陈学明崔利宾许崧杰袁鑫刘亚东赵鹏吴启超
张衍军,王志杰,王天仪,陈学明,崔利宾,许崧杰,袁鑫,刘亚东,赵鹏,吴启超
1.首都医科大学附属北京潞河医院骨科,北京市101149;2.承德医学院附属医院儿内科,河北承德市067000;3.解放军266医院骨一科,河北承德市067000
脊髓损伤是具有高发病率、高致残率、高花费、低龄化特点的中枢神经系统创伤性疾病[1-2]。近年来随着经济发展和社会建设,脊髓损伤发病率逐年升高[3]。脊髓损伤不但严重影响患者的生命健康和生活质量,其治疗所需的高花费也给家庭、社会带来极大负担。因此,行之有效的脊髓损伤治疗方案是整个社会亟待寻求的目标。
微RNA(microRNA,miRNA)是一类长19~25个核苷酸的非编码RNA,通过靶向靶基因3 "非编码区,从而在翻译水平抑制靶基因的表达[4-5]。miRNA参与生物体生长、发育和疾病的发生、发展等过程[6-7],也参与神经细胞的分化、成熟,神经介质的释放等复杂的分子生物学过程[8]。信号传导子和转录激活子(signal transducer and activator of transcription,STAT)3是STAT家族中的一员,作为转录因子,对基因表达具有重要的调控作用[9-10]。STAT3作为上游转录因子,能够促进生长相关蛋白(growth-associated protein 43,GAP43)在神经元中的表达,从而促进神经元轴突的再生[3,11-12]。
脊髓损伤发生后,脊髓中上行感觉传导和下行运动传导纤维束遭到破坏,轴突与其神经元胞体分离并导致瓦勒式变性(Wallerian degeneration)[13]。为了重建神经网络恢复功能,神经元自身所拥有的较弱的修复本能会使其轴突通过再生、塑形、出芽等方式在有限范围内生长[14-16]。本研究通过监测脊髓损伤后发生显著表达变化的miRNA,运用生物信息学方法找到具有生物学意义的miRNA并通过分子生物学方法进行验证,为脊髓损伤的治疗找到关键的治疗靶点。
1 材料与方法
1.1 动物实验分组
雌性Wistar大鼠15只,体质量(220±10)g,由中国军事医学科学院实验动物中心提供,随机分组为对照组(n=3)和脊髓损伤组(n=12)。脊髓损伤组在脊髓损伤后4 h、3 d、7 d、14 d(T1~T4)取材。每个时间点3只。
本研究方案通过首都医科大学附属北京潞河医院伦理委员会审批。
1.2 方法
1.2.1 造模
10%水合氯醛0.33 ml/100 g腹腔麻醉成功后,备皮、消毒,以T10节段棘突为标志点,切开皮肤,长约2 cm,钝性分离皮下筋膜、椎旁肌,显露T9~T11胸椎椎板,咬骨钳完整咬除T10椎板,充分暴露T10节段脊髓组织,以微型眼科剪剪取脊髓组织2 mm,充分止血后关闭伤口。腹腔注射头孢唑林预防感染,每天0.5 ml,共 3 d[17]。
1.2.2 取材
10%水合氯醛0.33 ml/100 g腹腔麻醉后,用冷PBS灌注。手术暴露脊髓组织,取以T10损伤处为中心的脊髓标本,共2 cm。
1.3 总RNA抽提
使用mirⅤanaTM RNA提取工具盒提取总RNA。使用杜恩斯匀浆器手动研磨脊髓组织,研磨在10倍于脊髓标本体积的Lysis/Binding Buffer中进行,充分研磨后将匀浆液放入Lysis/Binding Buffer快速混匀后转移到新的离心管中。在匀浆液中添加1/10体积的miRNA匀浆添加剂,充分匀浆后0℃孵育10 min。随后加入等体积的三氯甲烷后震荡30~60 s后离心,10 000 r/min,共5 min;取上清加入1.25倍体积的无水乙醇震荡混匀,反复过纯化柱后离心,10 000 r/min,共 15 s。700 μl wash 1 清洗纯化柱后,500 μl wash 2/3清洗纯化柱2次。将离心柱放在新的收集管中,加入100 μl预热的Elution Solution(95℃),室温下离心,10 000 r/min,共30 s。收集管中液体即为总RNA,置于-80℃冰箱保存。
1.4 数据分析
本实验应用Affymetrix miRNA 3.0芯片。利用NanoDrop ND-2100(Thermo Scientific)定量总RNA,并用Agilent 2100(Agilent Technologies)检测RNA完整性。质检确定样品可用性后,按照基因芯片标准方案进行试验,对样本标记、芯片杂交并洗脱。采用Affymetrix Scanner 3000(美国AFFYMETRⅠX公司)扫描得到原始图像。使用Expression Console(version 1.3.1,美国AFFYMETRⅠX公司)数据分析软件对所得的扫描原始图像进行分析,将所得原始数据转化为RMA标准化算法信号值,应用分层聚类分析的方法对不同分组中差异表达的miRNA进行分析。
1.5 逆转录实时定量聚合酶链反应(reverse transcription real-time quantitative polymerase chain reaction,RT-qPCR)
采用RT-qPCR检测miR-20a-3p表达。采用miS-criptⅠⅠReverse Transcription Kit(德国 QⅠAGEN 公司)和PrimerScript RT reagent Kit(日本TaKaRa公司)分别进行miRNA和mRNA的检测。应用U6作为miRNA表达的内参,应用GAPDH mRNA作为mRNA表达的内参。
1.6 Western blotting
采用Western blotting技术检测STAT3表达量。RⅠ-PA裂解液(加入蛋白酶抑制剂)加入到取材的脊髓样品中,提取不同分组样本中的总蛋白。样品中蛋白经过SDS-PAGE电泳分离,转膜到PⅤDF膜上,随后放入缓冲液中37℃封闭2 h,加入一抗,4℃孵育过夜,二抗后,ECL化学发光试剂检测[18]。
1.7 细胞培养及转染
为了验证体内筛选出的miRNA是否具有调控神经元轴突生长的作用,在体外培养神经元中调控miR-20a-3p。取新生1~2 d的Wistar大鼠大脑皮层,严格无菌操作,将皮层剪碎后放入高糖DMEM培养基中,放入培养板,待4 h神经元贴壁后,更换为Neurobasal添加维生素B27的完全神经元培养基,培养3 d后进行下一步实验。实验分为control组(无任何处理的空白对照组)、scramble组(加入无意义的寡聚核苷酸序列对照组)和miR-20a-3p inhibitor组(加入抑制细胞内miR-20a-3p抑制剂的实验组)。按照说明书将scramble、miR-20a-3p inhibitor序列(中国 GENEPHARMA公司)进行转染(中国YⅠJUN公司)。转染24 h后更换培养基后继续培养3 d,随后进行细胞免疫荧光染色检测轴突长度。
1.8 细胞免疫荧光染色
将4%多聚甲醛1 ml液放置6孔板上,室温固定15 min;PBST液分别清洗各个标本3次,每次2 min;用0.5%Triton X-100液孵育10 min;PBST液分别清洗标本各3次,每次2 min;封闭血清,孵育30 min;吸弃封闭液后PBST清洗3次,每次5 min,加入一抗,4℃孵育过夜;PBST液分别清洗各标本3次,每次5 min;用Cy3标记的荧光二抗在37℃孵育30 min;PBST液清洗3次,每次5 min;细胞核染色使用DAPⅠ,室温孵育30 min,双蒸水冲洗10 min;甘油封片,荧光显微镜照相。
本研究用Ⅰmage-Pro Plus 6.0软件对实验图像进行分析,每个指标随机抽取5张图片,每张图片随机取5个不同视野,手动计数神经元的轴突长度[4]。
1.9 统计学分析
采用SPSS 17.0软件对本研究中所得的数据进行分析。计量资料以(xˉ±s)表示。组间比较采用单因素方差分析(ANOⅤA)和SNK检验。两样本比较采用Student t检验。显著性水平α=0.05。
2 结果
2.1 脊髓损伤大鼠的MicroRNA表达谱分析
基因芯片所得数据显示,脊髓损伤组与对照相比在脊髓损伤后各时间点,共有658个miRNA发生表达变化。见图1。其中miR-20a-3p在脊髓损伤后表达明显上调,miR-20a-3p在7 d和14 d时间点上调倍数排名分别为第7。RT-qPCR检测miR-20a-3p表达结果与基因芯片结果一致。见图2。上述结果使得miR-20a-3p纳入研究者视线。
2.2 miR-20a-3p靶基因预测
使用TargetScan数据库对miR-20a-3p可能靶向的基因进行预测,预测结果显示miR-20a-3p的靶基因可为STAT3。见表1。
2.3 STAT3蛋白变化趋势
Western blotting结果显示,脊髓损伤后,STAT3蛋白表达相对于对照组7 d和14 d时均下调,与miR-20a-3p的表达趋势相反。见图3、图4。
2.4 miR-20a-3p通过STAT3影响神经元轴突生长
实验结果显示,与control组相比,miR-20a-3p抑制组的神经元生长状态相对较好,轴突明显延长。见图5、图6。Western blotting结果显示,与对照组相比,miR-20a-3p inhibitor组STAT3蛋白表达上调。见图7、图8。
3 讨论
脊髓损伤后基因芯片结果显示miR-20a-3p明显上调,提示miR-20a-3p可能参与脊髓损伤后的病理生理过程。经过数据库预测发现其靶基因可能为STAT3,体外实验证实调控皮层神经元中miR-20a-3p可以调控STAT3的表达,并且二者具有相反的表达趋势,证实miR-20a-3p可以调控STAT3表达。进一步研究证实,miR-20a-3p参与调节皮层神经元轴突生长过程。
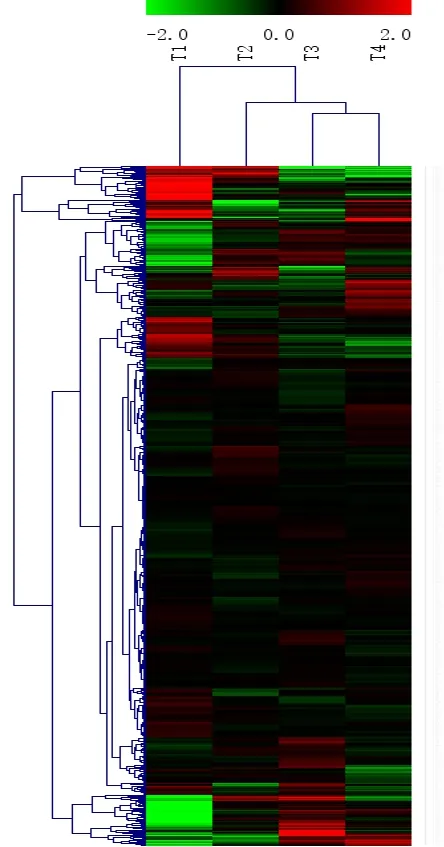
图1 脊髓损伤大鼠的MicroRNA表达谱分析
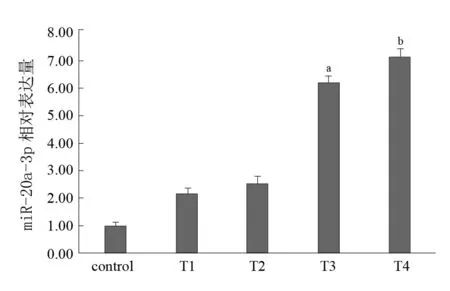
图2 各组miR-20a-3p表达(RT-qPCR)

表1 TargetScan数据库查询预测miR-20a-3p的靶基因为STAT3
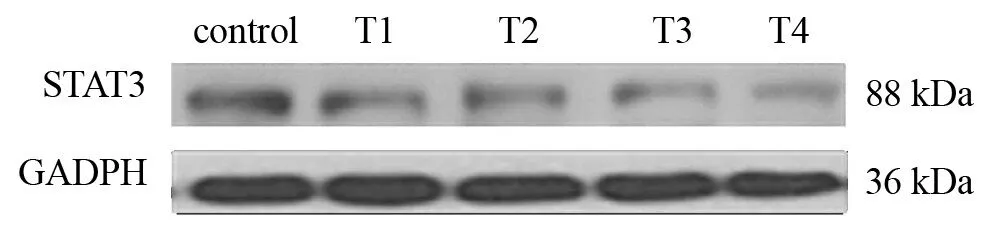
图3 五组STAT3蛋白表达比较(Western blotting)
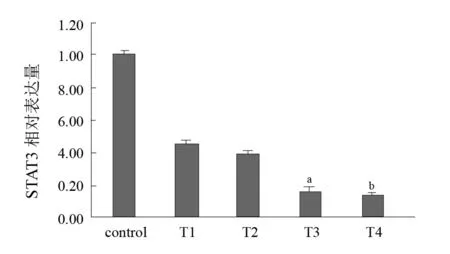
图4 五组STAT3蛋白表达比较
本研究证实,miR-20a-3p可以靶向STAT3基因,从而靶向调节皮层神经元轴突的生长。
脊髓中含有起源于大脑皮层运动神经元的运动神经纤维和起源于背根神经节(dorsal root ganglion,DRG)神经元的感觉神经纤维。脊髓损伤后功能的恢复依赖于感觉纤维和运动纤维的再生。脊髓损伤不同于外周神经损伤,大量研究证实,外周神经损伤后轴突可以再生,而中枢神经系统轴突损伤后却难以再生[19-20]。因此促进神经元轴突的再生对于恢复脊髓损伤后的功能具有至关重要的作用。
随着生物体生长发育,中枢神经系统神经再生能力逐渐下降,因其神经生长相关基因表达下降,导致神经元内在生长能力下降[20-21]。miRNA作为调控细胞生物学过程的关键分子,通过调节神经元内部信号通路,在神经系统中发挥重要的调控作用。近年来,miRNA可以作为诊断靶点和治疗靶点在临床及基础研究中被大量报道[22-24]。
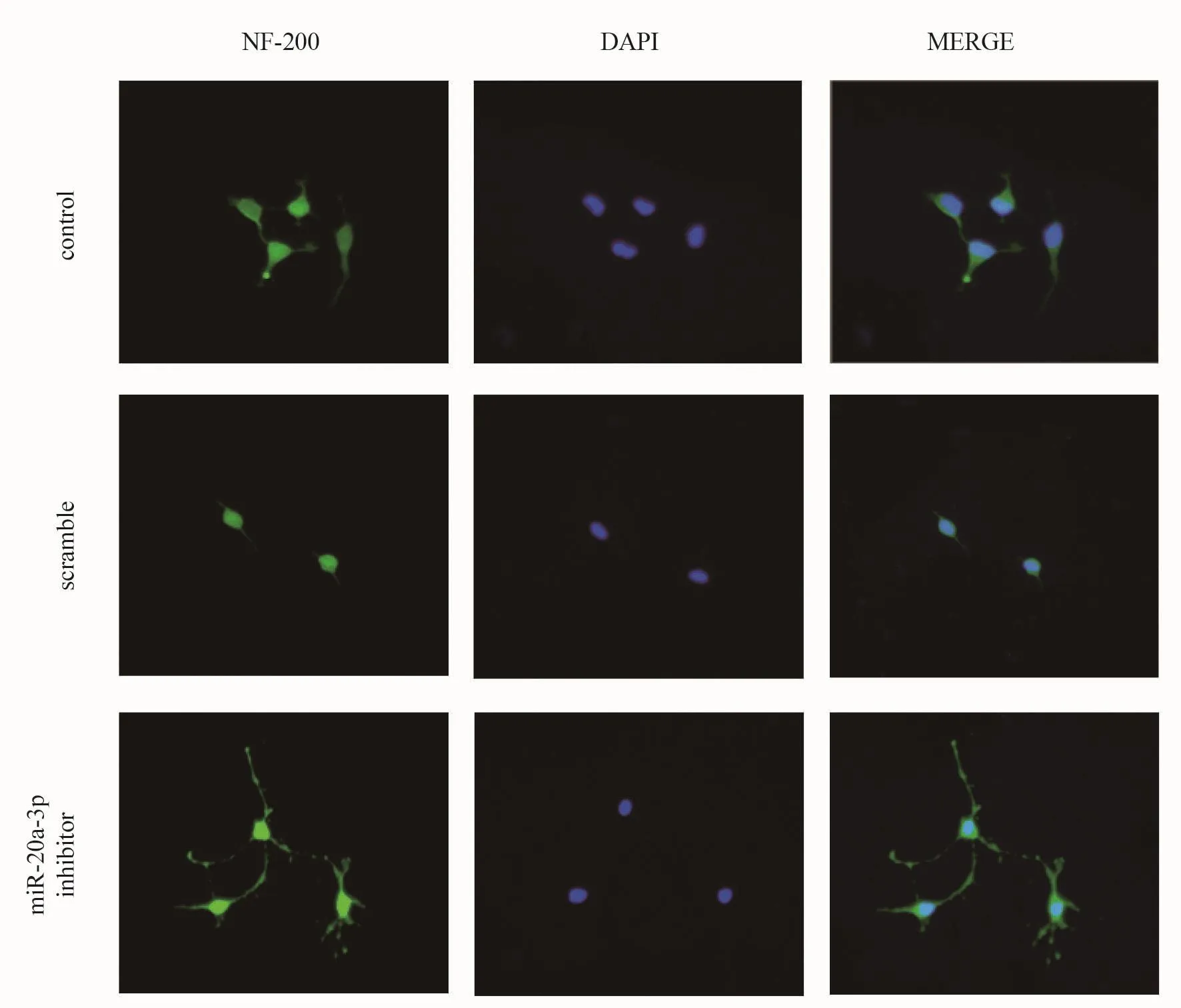
图5 三组神经元细胞免疫荧光染色(×200)
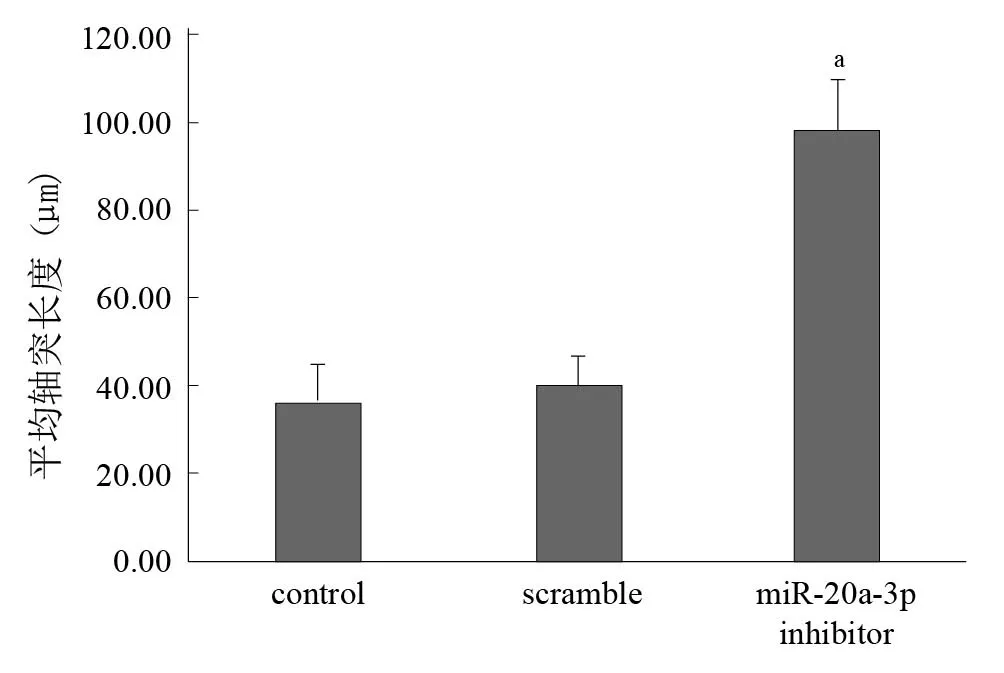
图6 三组轴突长度比较
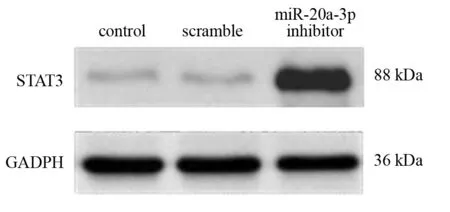
图7 三组STAT3蛋白表达比较(Western blotting)
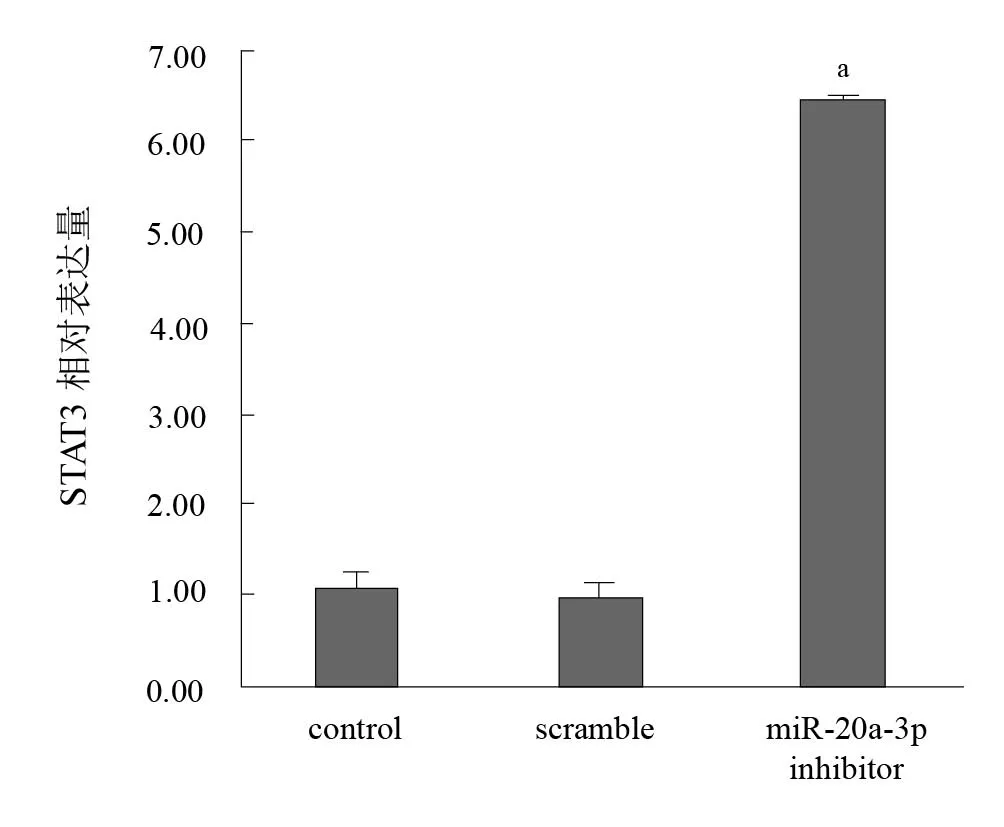
图8 三组STAT3蛋白表达比较
Janssen等[25]报道,miRNA可以作为治疗丙型病毒性肝炎的靶点,并且已经进入二期临床试验;提示探究miRNA可以作为靶点参与坐骨神经预损伤促进脊髓后索损伤修复的过程,针对关键miRNA的调控为找到替代坐骨神经预损伤的治疗策略带来新的希望。STAT3是细胞内部的重要转录调节分子,在调节神经元轴突再生中发挥重要作用,本研究发现miR-20a-3p可以靶向STAT3蛋白,从而调节皮层神经元轴突内在生长能力,发挥潜在的调控脊髓损伤后神经元轴突再生的作用。
本研究从miRNA组学角度筛选出可能具有调控作用的miR-20a-3p,探讨其调节脊髓损伤修复的机制。脊髓损伤后至少在任一时间窗发生改变的miRNA有658个,miR-20a-3p-STAT3通路可能只是其发挥作用的重要通路之一。期待后续实验能够发现更多的关键靶点与通路来进一步促进脊髓损伤修复。
