大曲曲皮厚度对大曲质量的影响研究
2019-03-30张振科杨方玉樊建辉李建民吴卫光
张振科,杨方玉,樊建辉,李建民,吴卫光
(河南仰韶酒业有限公司,河南渑池472400)
大曲是由小麦、大麦、豌豆按照一定的比例,自然接种、人工控温培育,含有丰富的微生物与多种酶类的块状制剂[1]。目前一般根据大曲培养工艺不同,将大曲分为高温大曲、中高温大曲以及中温大曲[2]。大曲在白酒酿造中主要提供发酵力、糖化力、液化力以及酿造微生物,并提供决定酒体风格的呈香呈味的前驱物质[3]。在白酒行业中,一直流传着“曲是酒之骨”“有好曲就有好酒”这两句话,由此可知大曲的质量对白酒生产的重要性,为了提高大曲质量,许多白酒科研工作者对大曲进行了大量研究工作。申孟林等[4]对大曲中微生物的分类以及作用进行了详细的研究;朱文优等[5]采用高通量测序技术和多元统计法对不同季节的高温大曲真菌群落结构以及演变进行了系统的研究;杨丹丹等[6]利用紫外诱变技术获得一株高产糖化力的黑曲霉;熊翔等[7]对大曲工艺研究发现,当小麦粉碎度57%、鲜曲含水量39%时,大曲质量最优。
目前,有关大曲质量提升的研究,主要是在菌种选育和大曲培育工艺两大方向[8-10]。大曲曲皮厚度直接影响着大曲的质量,赵迎路等[13]对不同季节和不同原料两个方面对大曲的曲皮质量问题做了科学的研究;霍永建[14]对汾酒大曲曲皮的各种质量问题做了详细的总结概述;明红梅等[15]对泸型大曲研究发现,曲皮的理化指标直接影响着大曲的整体质量;而有关曲皮厚度对大曲质量的影响还没有相关研究报道。本次通过研究曲皮厚度对大曲质量的影响,来进一步提升大曲质量,以便为大曲生产提供理论参考。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 样品及试剂
样品:未经培育的大曲(仰韶酒厂提供)。
试剂:磷酸二氢钾、硫酸镁、蔗糖、磷酸铵、无水乙酸钠、冰乙酸、可溶性淀粉、重铬酸钾、葡萄糖、氢氧化钠、亚铁氰化钾、碘化钾、碘、次甲基蓝、甲基蓝、酒石酸甲钠、硫酸铜、胰蛋白胨、牛肉膏、氯化钠、纳他霉素、琼脂粉、蛋白胨、酵母粉、氨苄青霉素、维生素B1,购于上海生工,均为AR级。
1.1.2 仪器设备
电热干燥箱、蒸发皿、分析天平、容量瓶、滴定管、移液管、锥形瓶、烧杯、恒温水浴锅、玻璃棒、容量瓶、测量尺、灭菌锅。
1.1.3 培养基
细菌培养基:葡萄糖15 g/L,胰蛋白胨5 g/L,牛肉膏5 g/L,NaCl 5 g/L,纳他霉素1 g/L,琼脂粉12 g/L,pH 7.0。
酵母培养基:酵母粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,豆芽200 g/L,氨苄青霉素1 g/L,琼脂粉12 g/L,pH 6.0。
霉菌培养基:去皮马铃薯200 g/L,葡萄糖20 g/L,蛋白胨 0.5 g/L,KH2PO45 g/L,MgSO4·7H2O 3 g/L,维生素B10.1 g/L,琼脂粉12 g/L,氨苄青霉素1 g/L,自然pH值。
发酵培养基:蔗糖80 g/L,磷酸铵1.25 g/L,磷酸二氢钾1.25 g/L,自然pH值。
1.1.4 其他溶液
次甲基蓝指示剂(10 g/L):称取1.0 g次甲基蓝,加水溶解并定容至100 mL。
氢氧化钠溶液(200 g/L):称取20.0 g氢氧化钠,加适量水溶解,待冷却后定容至100 mL。
斐林试剂甲液:称取15.6 g硫酸铜(CuSO4·5H2O)及0.05 g次甲基蓝溶于蒸馏水中,并定容至1000 mL。
斐林试剂乙液:称取50 g酒石酸钾钠及54 g氢氧化钠溶于蒸馏水中,再加入4 g亚铁氰化钾,完全溶解后,用蒸馏水定容至1000 mL。
葡萄糖标准溶液(2.5 g/L):称取经103~105℃烘干至恒重的无水葡萄糖2.5 g(精确至0.0001 g),用水溶解,并定容至1000 mL。此溶液现用现配。
碘液:称取11.0 g碘、22.0 g碘化钾,置于研钵中,加少量水研磨至碘完全溶解,用水稀释定容至500 mL,为原碘液,贮存于棕色瓶中。使用时,吸取2.0 mL,加20.0 g碘化钾,用水溶解定容至500 mL,为稀碘液,贮存于棕色瓶中。
pH4.6乙酸-乙酸钠缓冲液:2 mol/L冰乙酸:取118 mL冰乙酸用水稀释至1000 mL;2 mol/L乙酸钠:称取272 g乙酸钠(CH3COONa·3H2O)溶于水,稀释至1000 mL。将两溶液等体积混合,即为醋酸-醋酸钠缓冲液,缓冲溶液的pH值应以酸度计校正。
20 g/L可溶性淀粉溶液:用分析天平准确称取100~105℃干燥2 h的可溶性淀粉2 g(精确到0.001 g),于50 mL烧杯中用少量水调匀后,倒入盛有70 mL沸水的150 mL烧杯中,并用20 mL水洗净50 mL小烧杯,洗液合并其中,用微火煮沸至透明,冷却后用水定容至100 mL。
1.2 实验方法
1.2.1 大曲实验室培养
取车间制作好的大曲,每次实验平行3次,置于生化培养箱中。培养箱设置条件:起始温度28℃,以2℃/d的条件保持升温7 d,升温到42℃,保持5 d,再以2℃/d的条件保持升温7 d,升温到顶火56℃,顶温保持5 d,以3℃/d的条件保持降温7 d,降到温度35℃,保持5 d;发酵周期为36 d,确保大曲在实验室培养箱中发酵条件和周期与生产车间保持一致。为确保达到不同厚度的曲皮(≤0.5 cm、0.5~0.8 cm、0.8~1.2 cm、1.2~1.5 cm、≥1.5 cm),以及大曲质量,培养过程注意事项:前期培养箱湿度控制在95%左右,培养时间3~8 d,即可达到不同曲皮厚度的范围(0.2~1.4 cm),培养8~14 d时,培养箱湿度控制在80%左右,培养14 d后,培养箱湿度控制在40%~70%之间,每天都打开培养箱排水分与空气交换5 min。
1.2.2 大曲固体浸出液制备
根据测得大曲试样的水分,称取相当于绝干试样量5 g,精确至0.001 g,放入250 mL烧杯中,加10 mL乙酸-乙酸钠缓冲溶液,再加水,用玻璃棒搅拌均匀,定容至100 mL。将上述烧杯置于35℃恒温水浴中保温浸渍1 h,保温期间每间隔15 min搅拌1次。使用脱脂棉过滤,收集滤液,备用。
1.2.3 大曲理化指标的测定方法[11]
1.2.3.1 糖化力测定
(1)吸取25 mL 20 g/L淀粉溶液于50 mL容量瓶中,加pH4.6的缓冲溶液5 mL,将容量瓶于35℃水浴中保温10 min,加5.00 mL固体曲浸出液,立即混匀计时,35℃水浴中保温60 min,迅速加入15 mL 0.1 moL/L的NaOH溶液,终止酶解反应。冷却至室温后,用水定容至50 mL,摇匀,得到糖化液。(2)同时作一空白试验:吸取25 mL 20 g/L淀粉溶液,置于50 mL容量瓶中,加pH4.6缓冲溶液5 mL。先加入15 mL 0.1 moL/L的NaOH溶液,再准确加入5.00 mL曲浸出液,用水定容至50 mL,摇匀。(3)吸取斐林试剂甲液、乙液各5 mL于150 mL三角瓶中,加入5 mL制备好的糖化液,用滴定管加入一定量1.0 g/L葡萄糖标准溶液(使随后滴定时其用量不超过1 mL),置电炉上加热煮沸2 min,在沸腾状态下继续滴加葡萄糖标准溶液至蓝色消失而呈淡黄色,记录葡萄糖标准溶液的总用量。后面的滴定操作应在1 min内完成。同时作一空白试验。(4)空白试验取斐林试剂甲液、乙液各5 mL于三角瓶中,加入5 mL制备好的空白液,以下操作同试样操作。
固体曲糖化力的定义为:在35℃,pH4.6时,1 g绝干曲1 h内酶解可溶性淀粉为葡萄糖的质量。其计算公式为:
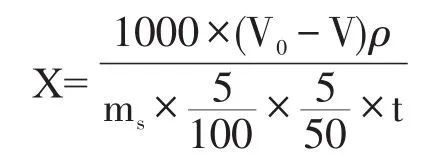
式中:X为糖化力,mg葡萄糖/g曲·h;V0为空白试验葡萄糖标准溶用量,mL;V为试样测定葡萄糖标准溶液用量,mL;ρ为葡萄糖标准溶液浓度,g/mL;ms为以绝干曲计的试样称取量,5.00 g;t为酶解时间,h;结果保留整数。
1.2.3.2 液化力测定
吸取25.0 mL 20.0 g/L可溶性淀粉和5 mL的pH4.6缓冲溶液于100 mL试管中,于35℃水浴中保温10 min后,加入5.0 mL试样浸出液,充分摇匀,立即计时。继续于35℃保温,定时取出1滴反应液于加有碘液的白磁点滴板空穴内,观察变色情况。当碘液颜色不再改变时即为反应终点,立即记录液化时间。
固体曲液化力的定义为:在35℃,pH4.6时,1 g绝干曲液化可溶性淀粉的质量。其计算公式为:
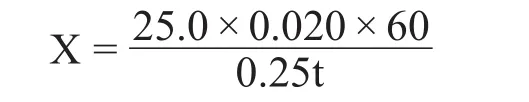
式中:X为液化力,g淀粉/g曲·h;25.0为可溶性淀粉溶液用量,mL;0.020为可溶性淀粉溶液浓度,g/mL;0.25为5 mL浸出液相当于绝干曲计的试样量,g;t为液化时间,min;结果保留小数点后2位。
1.2.3.3 发酵力测定
用移液管吸取发酵培养液50 mL于150 mL三角瓶中,塞上棉塞,外包油纸,在0.1 MPa压力下蒸汽灭菌30 min。然后,在无菌条件下,向三角瓶内接入相当于1.0 g绝干曲的曲粉,称量并记录发酵培养前三角瓶和内容物的总质量。之后将三角瓶置于培养箱中30℃培养72 h。其中每8 h称量1次。每次称量前轻轻摇动使二氧化碳逸出。如此反复称量直至衡量为止,即发酵完毕。
发酵力指1 g绝干曲在上述规定条件下,发酵糖化液产生二氧化碳的质量。其计算公式为:
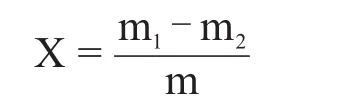
式中:X为发酵力,g CO2/g曲;m1为发酵之前发酵瓶和内容物总质量,g;m2为发酵完毕发酵瓶和内容物总质量,g;m为绝干曲的接入试样质量,g;结果保留到小数点后2位。
1.2.4 大曲微生物菌落的培养
称取适量的大曲,将其彻底粉碎,溶于无菌水中,采用梯度稀释法,将预培养样品分别稀释至10-1、10-2、10-3、10-4、10-5、10-6、10-7,吸取每一梯度样品1 mL分别涂布于酵母培养基、细菌培养基以及霉菌培养基,选择合适稀释倍数的稀释液,每个稀释度做3个平行。细菌分离培养基置于37℃恒温培养3 d,酵母和霉菌分离培养基置于28℃恒温培养3~5 d,分别统计记录菌落总数[12]。
1.2.5 验曲小组对不同厚度曲皮大曲感官评比
将实验室培养不同厚度曲皮的大曲分类,在不参考不同厚度大曲理化指标前提下,由酒厂验曲小组5名成员对大曲整体感官打分评比,评分满分50分,评分越高大曲感官质量越好。
2 结果与分析
2.1 曲皮厚度对液化力的影响
将实验室培养的同一曲皮厚度范围内大曲粉碎,制备出大曲固体浸出液,按照液化力测定方法测定不同曲皮厚度的液化力,结果见图1。曲皮厚度在1.2~1.5 cm之间时,大曲液化力达到最大值,为2.2 g淀粉/g曲·h;当大曲曲皮厚度小于0.5 cm时,液化力的平均值只有0.8 g淀粉/g曲·h;曲皮厚度大于1.5 cm时,液化力平均值为2.1 g淀粉/g曲·h。随着曲皮厚度的增加,大曲液化力也随着变强,但是大曲曲皮变厚的同时大曲的火圈也会加重,所以曲皮大于1.5 cm后,大曲的液化力没有再增强,反而有一定的变弱。
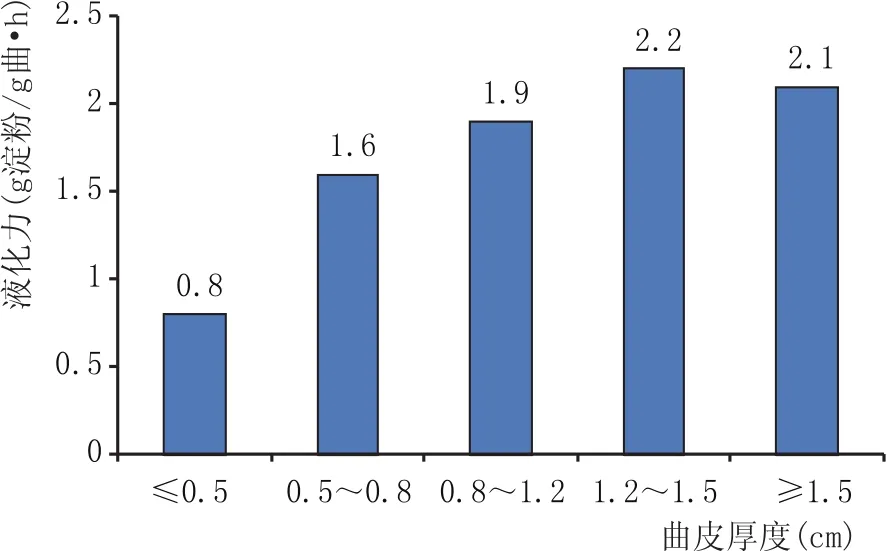
图1 曲皮厚度与液化力关系
2.2 曲皮厚度对糖化力的影响
将实验室培养的同一曲皮厚度范围内大曲粉碎,制备出大曲固体浸出液,按照糖化力测定方法测定不同曲皮厚度的糖化力,结果见图2。曲皮厚度在1.2~1.5 cm之间时,大曲糖化力达到最大值,为1170 mg葡萄糖/g曲·h;当大曲曲皮厚度小于0.5 cm时,糖化力的平均值只有550 mg葡萄糖/g曲·h;曲皮厚度在0.5~0.8 cm时,糖化力平均值为820 mg葡萄糖/g曲·h;曲皮厚度在0.8~1.2 cm时,糖化力平均值为980 mg葡萄糖/g曲·h;曲皮厚度大于1.5 cm时,糖化力平均值为1010 mg葡萄糖/g曲·h。随着曲皮厚度的增加,大曲糖化力也随着变强,但是大曲曲皮变厚的同时大曲的火圈也会加重,霉菌再往大曲内部生长变得困难,所以曲皮厚度大于1.5 cm以后,大曲的糖化力没有再增强,反而有一定的变弱。
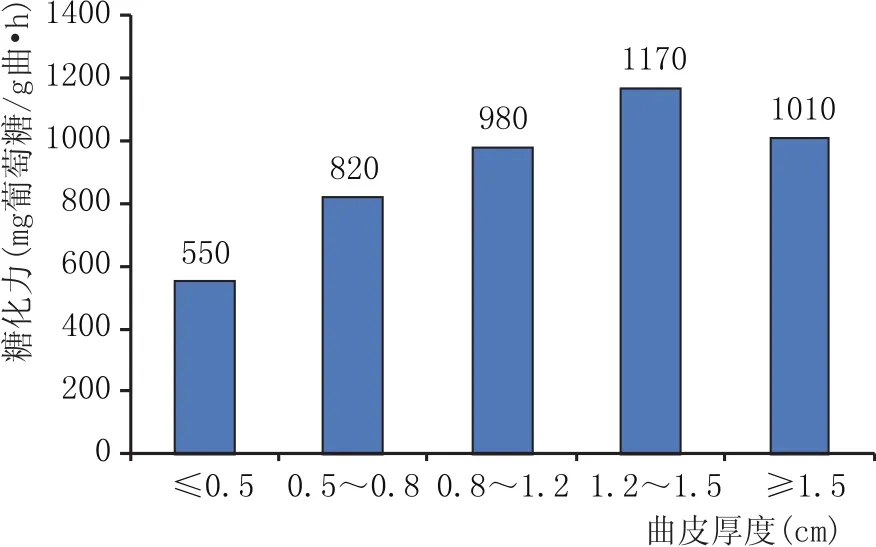
图2 曲皮厚度与糖化力关系
2.3 曲皮厚度对发酵力的影响
将实验室培养的同一曲皮厚度范围内大曲粉碎,制备出大曲固体浸出液,按照发酵力测定方法测定不同曲皮厚度的发酵力,结果见图3。当大曲曲皮厚度小于0.5 cm时,发酵力的平均值为1.4 g CO2/g曲;曲皮厚度在0.5~0.8 cm时,发酵力平均值为1.5 g CO2/g曲;曲皮厚度在0.8~1.2 cm时,发酵力平均值为1.6 g CO2/g曲;曲皮厚度在1.2~1.5 cm之间,大曲发酵力为1.5 g CO2/g曲;曲皮厚度大于1.5 cm时,发酵力平均值为1.6 g CO2/g曲。随着曲皮厚度的增加,大曲发酵力并没有变化,可能与酵母菌的生长繁殖习性有关,因为酵母菌主要繁殖方式是芽殖和裂殖,在大曲培养过程中酵母菌很难往大曲内部生长,主要分布在大曲的曲皮最外边,所以大曲发酵力大小受曲皮厚度的影响不大。
2.4 曲皮厚度对微生物的影响
2.4.1 曲皮厚度对霉菌的影响
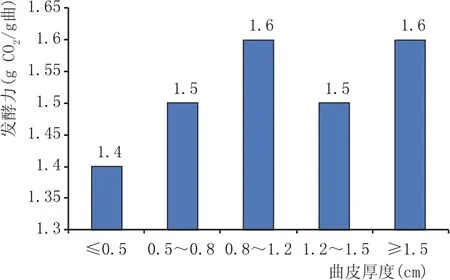
图3 曲皮厚度与发酵力关系
将实验室培养的同一曲皮厚度范围内大曲粉碎,按照微生物菌落培养方法,结果见图4。由图4可知:当曲皮厚度在1.2~1.5 cm时,霉菌菌落数达到最大值,为8.6×104cfu/g;曲皮厚度小于0.5 cm时,霉菌菌落数为4.2×104cfu/g;曲皮厚度在0.5~0.8 cm时,霉菌菌落数为5.9×104cfu/g;曲皮厚度在0.8~1.2 cm时,霉菌菌落数为7.1×104cfu/g;曲皮厚度大于1.5 cm时,霉菌菌落数为8.3×104cfu/g。随着曲皮厚度的增加,大曲霉菌菌落数呈先增加再减少的过程,这个过程与大曲的液化力、糖化力变化一致。
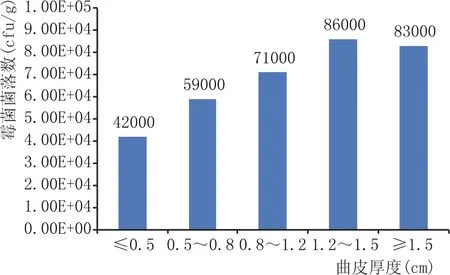
图4 曲皮厚度与霉菌菌落关系
2.4.2 曲皮厚度对酵母菌的影响
将实验室培养的同一曲皮厚度范围内大曲粉碎,按照微生物菌落培养方法,结果见图5。
在大曲培养过程中,曲皮厚度变化对酵母菌菌落数没有影响,这与酵母菌的繁殖方式有关,大曲内部酵母菌很少,主要是分布在曲皮表面。曲皮厚度小于0.5 cm时,酵母菌菌落数为4.3×105cfu/g;曲皮厚度在0.5~0.8 cm时,酵母菌菌落数为4.62×105cfu/g;曲皮厚度在0.8~1.2 cm时,酵母菌菌落数为5.6×105cfu/g;曲皮厚度在1.2~1.5 cm之间时,大曲酵母菌菌落数为5.3×105cfu/g;曲皮厚度大于1.5 cm时,酵母菌菌落数为5.8×105cfu/g。
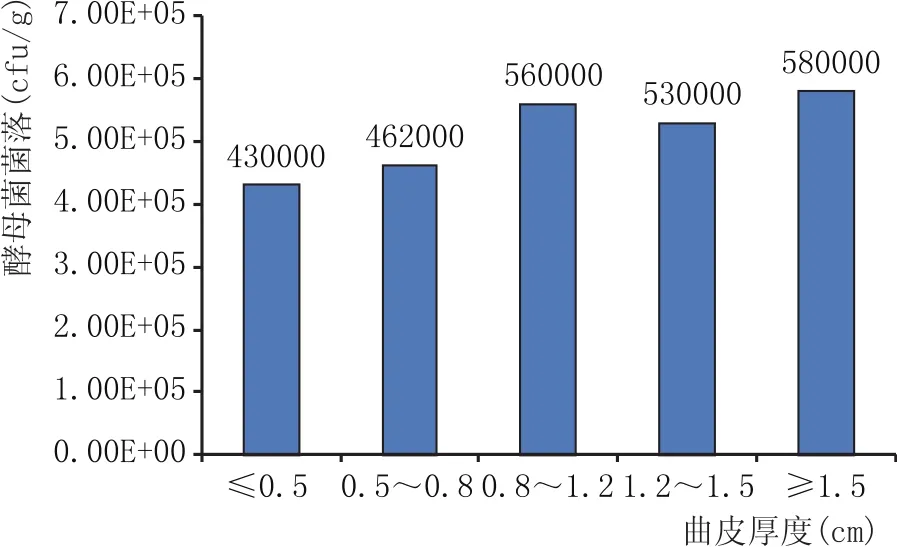
图5 曲皮厚度与酵母菌菌落关系
2.4.3 曲皮厚度对细菌的影响
将实验室培养的同一曲皮厚度范围内大曲粉碎,按照微生物菌落培养方法,结果见图6。当大曲曲皮厚度小于0.5 cm时,细菌菌落数为2.34×106cfu/g;曲皮厚度在0.5~0.8cm时,细菌菌落数为2.36×106cfu/g;曲皮厚度在0.8~1.2cm时,细菌菌落数为2.3×106cfu/g;曲皮厚度在1.2~1.5 cm之间时,大曲细菌菌落数为2.7×106cfu/g;曲皮厚度大于1.5 cm时,细菌菌落数为2.4×106cfu/g。
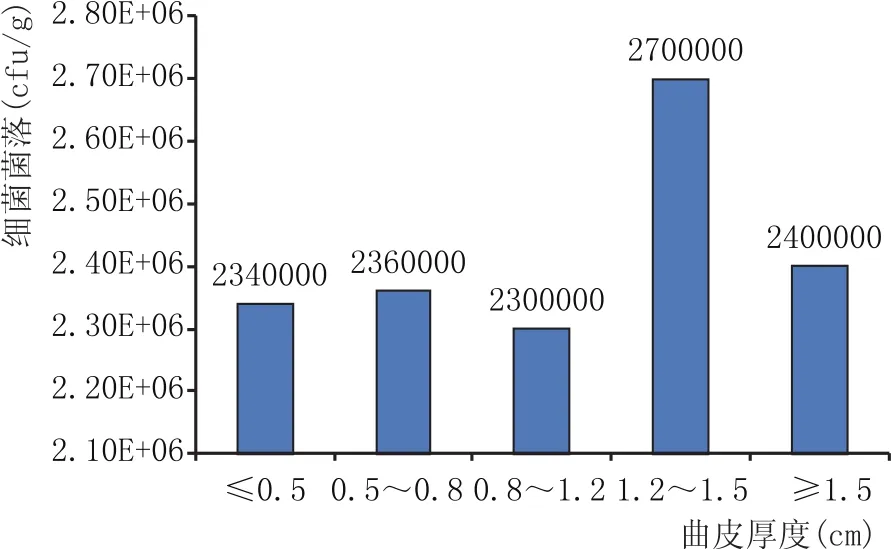
图6 曲皮厚度与细菌菌落关系
2.5 大曲感官验证评比结果
不同厚度曲皮感官评比结果见表1,由表1可知,大曲厚度在0.5~0.8 cm时,大曲评比得分最高。
3 结论
大曲曲皮厚度≤0.5 cm时,大曲液化力为0.8 g淀粉/g曲·h,糖化力为550 mg葡萄糖/g曲·h,发酵力为1.4 g CO2/g曲,霉菌菌落数为4.2×104cfu/g,酵母菌落数为4.3×105cfu/g,细菌菌落数为2.34×106cfu/g,大曲感官评分46.6分。
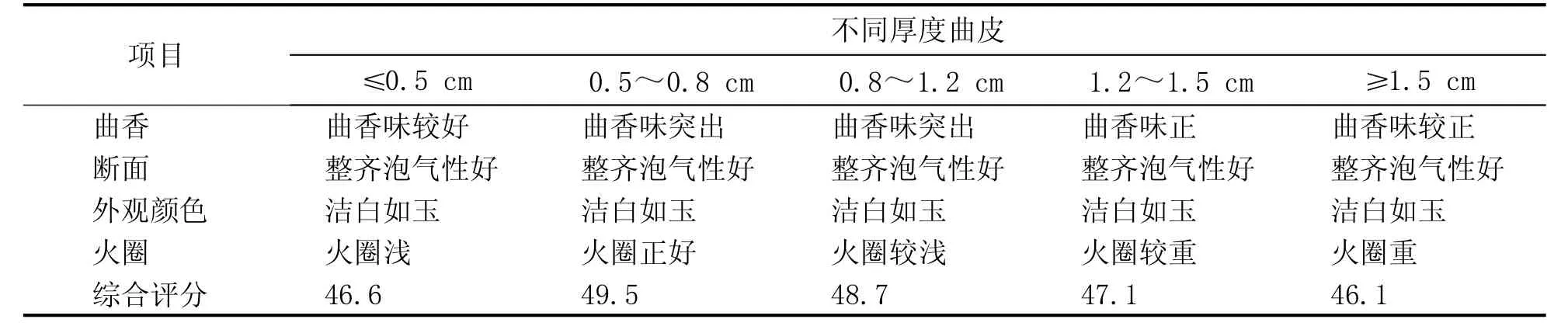
表1 大曲感官验证评比结果
大曲曲皮厚度为0.5~0.8cm时,大曲液化力为1.6 g淀粉/g曲·h,糖化力为820 mg葡萄糖/g曲·h,发酵力为1.5 g CO2/g曲,霉菌菌落数为5.9×104cfu/g,酵母菌落数为4.62×105cfu/g,细菌菌落数为2.36×106cfu/g,大曲感官评分49.5分。
大曲曲皮厚度为0.8~1.2 cm时,大曲液化力为1.9 g淀粉/g曲·h,糖化力为980 mg葡萄糖/g曲·h,发酵力为1.6 g CO2/g曲,霉菌菌落数为7.1×104cfu/g,酵母菌落数为5.6×105cfu/g,细菌菌落数为2.3×106cfu/g,大曲感官评分48.7分。
大曲曲皮厚度为1.2~1.5 cm时,大曲液化力为2.2 g淀粉/g曲·h,糖化力为1170 mg葡萄糖/g曲·h,发酵力为1.5 g CO2/g曲,霉菌菌落数为8.6×104cfu/g,酵母菌落数为5.3×105cfu/g,细菌菌落数为2.7×106cfu/g,大曲感官评分47.1分。
大曲曲皮厚度≥1.5 cm时,大曲液化力为2.1 g淀粉/g曲·h,糖化力为1010 mg葡萄糖/g曲·h,发酵力为1.6 g CO2/g曲,霉菌菌落数为8.3×104cfu/g,酵母菌落数为5.8×105cfu/g,细菌菌落数为2.4×106cfu/g,大曲感官评分46.1分。
综合本单位优质大曲理化指标要求(液化力大于1.5 g淀粉/g曲·h,糖化力大于700 mg葡萄糖/g曲·h,发酵力大于1.2 g CO2/g曲,大曲感官评分高于45分)和生产车间实际管理成效,大曲曲皮厚度应该控制在0.5~0.8 cm之间。
