不同接种方式及温度对活性干酵母发酵的影响
2019-03-30叶冬青张怡飞刘延琳
孙 悦,叶冬青,褚 越,张怡飞,刘延琳
(1.宁夏大学葡萄酒学院,宁夏银川750021;2.西北农林科技大学葡萄酒学院,陕西杨凌712100)
葡萄酒的酿造是一个复杂的微生物学过程,其中由酿酒酵母主导的酒精发酵是葡萄酒生产中的重要阶段之一。酿酒酵母菌株的生物多样性及群体组成对葡萄酒的感官质量具有重要影响。酵母菌的分类学方法,从最初的常规分类学即以形态,生理和生化等特征分类,发展到新的分类技术,尤其是分子生物学技术,近年来不断地被应用于酵母菌的分类学研究中。通过菌株区分技术可以揭示酿酒酵母种内遗传多样性,常规的遗传和生理生化手段难以达到菌株水平的区分,必须借助于DNA分子标记方法来完成。目前,应用于酿酒酵母菌株区分中最广泛、最有应用前景的技术有:随机扩增多态性DNA标记法(RAPD)、线粒体DNA限制性片段长度多态性分析(mtDNA-RFLP)、微卫星DNA标记法、Interdelta指纹图谱法以及COX1基因指纹图谱法等[1]。Interdelta序列之间差异非常丰富,同时Interdelta序列的数目和位置在种内具有一定的差异性,所以被作为基因标记用于区分酿酒酵母菌株的首选方法。Goodwin等[2]在研究中发现Interdelta序列在酿酒酵母基因组中数量最多,分布最广,且方法简单,操作容易,适用于酿酒酵母菌株的区分。
在葡萄酒的工业生产中,将商业活性干酵母先复水活化再接入葡萄汁是最普遍的做法,但由于生产上的便利,部分酒庄也会采用将活性干酵母直投的方法接种。然而,直投到葡萄醪中的干酵母将面临高糖、低酸等严峻的生长环境。此外,近年来由于冷浸渍工艺对葡萄酒颜色和香气品质具有良好的提升作用,在一些葡萄酒产区受到越来越多的关注和应用[3]。冷浸渍的时间一般持续4~7 d,为了确保该阶段葡萄醪的微生物稳定,部分生产者尝试在冷浸渍前进行接种,然而较低的温度会对微生物的存活以及生长造成重大的影响。因此,接入的活性干酵母在不同的工艺条件下能否在发酵的各阶段占据主导地位仍需验证。为了更好的探究接种方式和温度对发酵的影响,本研究利用WL营养琼脂培养基和Interdelta对北冰红葡萄汁4种不同接种方式发酵过程中酵母菌群体组成和菌株数量的变化规律进行了比较研究,确定了所接种的商业酵母CEC01在发酵过程中的主导地位,为工业生产中活性干酵母的使用提供了一定建议。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 菌株与试剂
酿酒酵母:CEC01(安琪酵母股份有限公司生产);葡萄汁:北冰红葡萄汁(陕西泾阳),葡萄汁的初始理化指标为糖134.8 g/L,总酸5.6 g/L。发酵前将葡萄汁糖含量调整为230 g/L,添加SO230 mg/L。
其他试剂:3,5-二硝基水杨酸,丙三醇,氢氧化钠,SDS,TritonX-100,EDTA,Tris-HCl。
1.1.2 培养基
YEPD培养基(Yeast Extract Peptone Dextrose Medium):葡萄糖2%,蛋白胨2%,酵母浸粉1%,自然pH值,121℃灭菌20 min,配制固体培养基时加入2%的琼脂。
WL营养琼脂培养基(Wallerstein Laboratory Nutrient Agar Medium):酵母菌株的初步形态分类用WL营养培养基[4]。
1.1.3 仪器设备
磁力搅拌器,常州市国华电器有限公司;灭菌锅,上海市申安医疗器械厂;pH计,北京赛多利斯仪器系统有限公司;高速离心机,湖南湘仪公司;台式干燥箱,上海精宏实验设备有限公司;微量紫外分光光度计,Nano Drop;PCR仪,Bio RAD;电泳仪,北京六一仪器厂;凝胶成像系统,SYNGENE。
1.2 试验方法
1.2.1 葡萄汁发酵
本试验设置了4种处理方式:①低温(5℃)干酵母直投浸渍3 d后发酵;②低温(5℃)活化接种浸渍3 d后发酵;③低温(5℃)浸渍3 d后回温(20℃)干酵母直投发酵;④低温(5℃)浸渍3 d后回温(20℃)活化接种发酵。每个处理设置一组发酵。酵母的活化方式如下:取少量葡萄汁于离心管中,水浴加热至38℃,倒入称取的酵母活化20 min,待温度降至与葡萄汁温差在10℃以内,即可将其接种于葡萄汁中。发酵温度为20℃,采用DNS法测量葡萄汁中的糖含量,监控发酵进程[5],发酵至残糖连续2 d不变时视为发酵结束。待发酵结束后,分析原酒的基本理化指标。
1.2.2 菌株的分离
商业活性干酵母接入后的24 h、启酵(含糖量开始下降时)、发酵中期(50%糖消耗)和发酵末期(糖含量不变时)4个时期进行取样,采用梯度稀释法涂布于WLN平板上,28℃倒置培养5~7 d。待菌体长出后,观察记录平板上菌落的颜色及形态,并对不同培养类型的菌落进行计数。每种处理的每个时期挑取约20个酿酒酵母菌落(共640个),酿酒酵母的分子鉴定采用5.8S-ITS-RFLP法[6]。所有的酿酒酵母菌株于YEPD液体培养基中活化24 h,再与等量的40%甘油混合后于-70℃保藏。
1.2.3 理化指标分析
发酵结束后的残糖、总酸、挥发酸、酒度和SO2等指标参照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》。
1.2.4 酵母菌DNA的提取
取YEPD液体培养基活化后的菌液1 mL于1.5 mL离心管中,12000 r/min离心1 min后弃清液,收集菌体。加入DNA裂解液200 μL,漩涡振荡2 min后加入DNA提取液(酚-氯仿-异戊醇)200 μL,继续漩涡振荡2 min;再加入TE缓冲液200 μL,轻微摇匀后于12000 r/min离心7 min。将上清液300 μL转移至新的1.5 mL离心管中,加入无水乙醇900 μL,置于-20℃的冰箱中冷冻10 min;冷冻后的样品以12000 r/min离心2 min,弃上清液,加入70%的乙醇500 μL清洗DNA沉淀。然后,以12000 r/min离心1 min,弃上清液,待离心管完全干燥后加入ddH2O约20 μL,于-20℃的冰箱保存备用。
1.2.5 Interdelta指纹图谱分析
Interdelta分型法进行酿酒酵母分析的PCR体系、电泳条件及数据处理参照参考文献[7]。
2 结果与分析
2.1 不同接种方式的发酵曲线
本研究采取DNS法测定了葡萄汁中每天的还原糖含量变化,不同接种发酵处理的发酵曲线如图1所示。从发酵曲线可以看出,回温接种发酵在第2天启酵,低温接种发酵在第3天或第4天时启酵,各组发酵均在14 d时发酵完全结束。从接种方式上看,复水活化接种在启酵和发酵速度上快于直投接种发酵。但从葡萄汁入料到发酵结束的整体进程来看,直投发酵的发酵曲线较为平滑,发酵过程更加平稳。
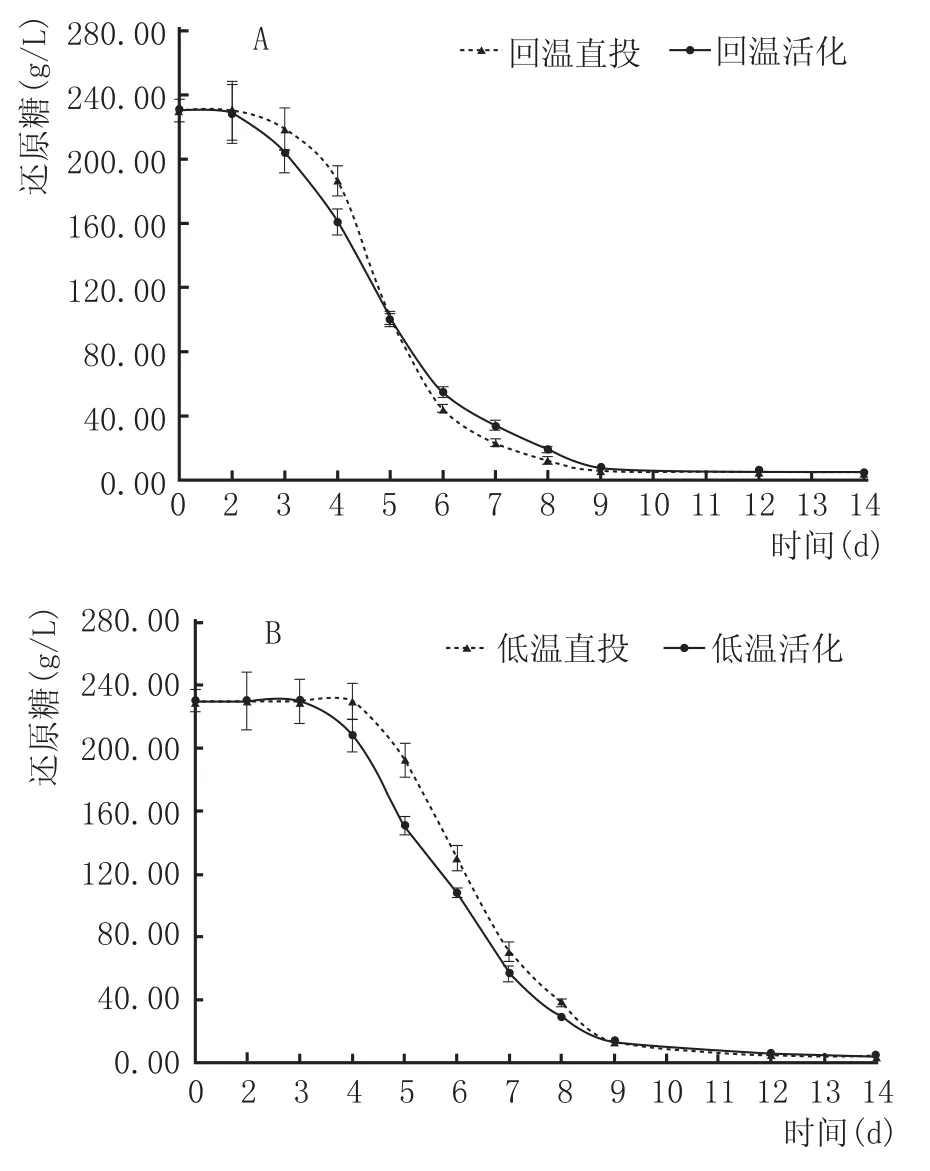
图1 不同处理方式的发酵曲线
2.2 发酵结束后的理化指标
为研究不同接种方式对葡萄酒理化指标的影响,本研究对发酵结束酒样的后残糖、总酸、挥发酸和酒度等理化指标进行了测定与比较(表1)。结果表明,两种接种方式和两种温度组合下的发酵均能发酵完全,且各理化指标均符合国家标准。不同接种方式发酵后的酒样中残糖、酒度、总酸和挥发酸均不存在显著差异。
2.3 非酵母属种类及数量变化
本研究中,除酿酒酵母(类型一)外共发现了3种非酵母属酵母,即类型二、类型三和类型四,根据WLN培养类型可分别鉴定为葡萄汁有孢汗逊酵母、发酵毕赤酵母和未提及[4],其在WLN培养上的菌落颜色形态见图2。
相关酵母在WLN培养基上呈现出的菌落形态和颜色描述见表2。由表2还可以看出,酿酒酵母的比例最高,为99.09%;发酵毕赤酵母(类型三)的比例最低,为0.14%。

表1 酒精发酵结束时的理化指标
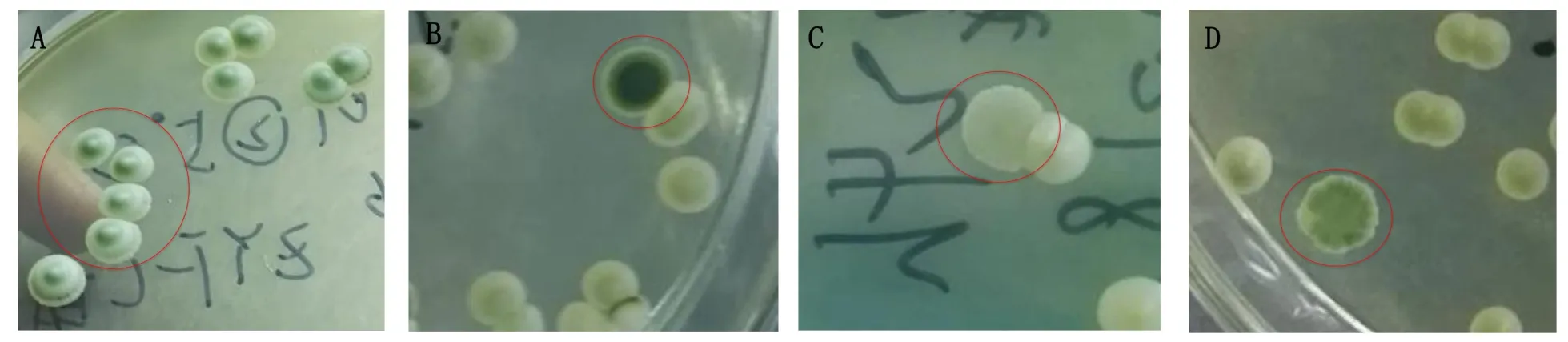
图2 酵母菌在WLN培养基上的颜色及形态

表2 酵母菌的WLN形态描述及鉴定结果
在4种发酵方式处理下,非酵母属可以在接种的24 h、启酵以及50%糖消耗时检测到,酿酒酵母的数量远远高于非酵母属酵母的数量(图3)。与回温接种相比,低温接种处理中非酵母属酵母所占的比例更大。低温干酵母直投发酵中非酵母属酵母的数量最多,在商业酵母CEC01接种24 h后占比为30%且存活时间最长,在启酵时仍有20%的非酵母属酵母存在,直到发酵末期,非酵母属酵母才基本消失。而在其他处理方式中,非酵母属酵母所占比例最大为10%,至50%糖消耗时基本消失。
2.4 发酵过程中CEC01的定殖能力分析
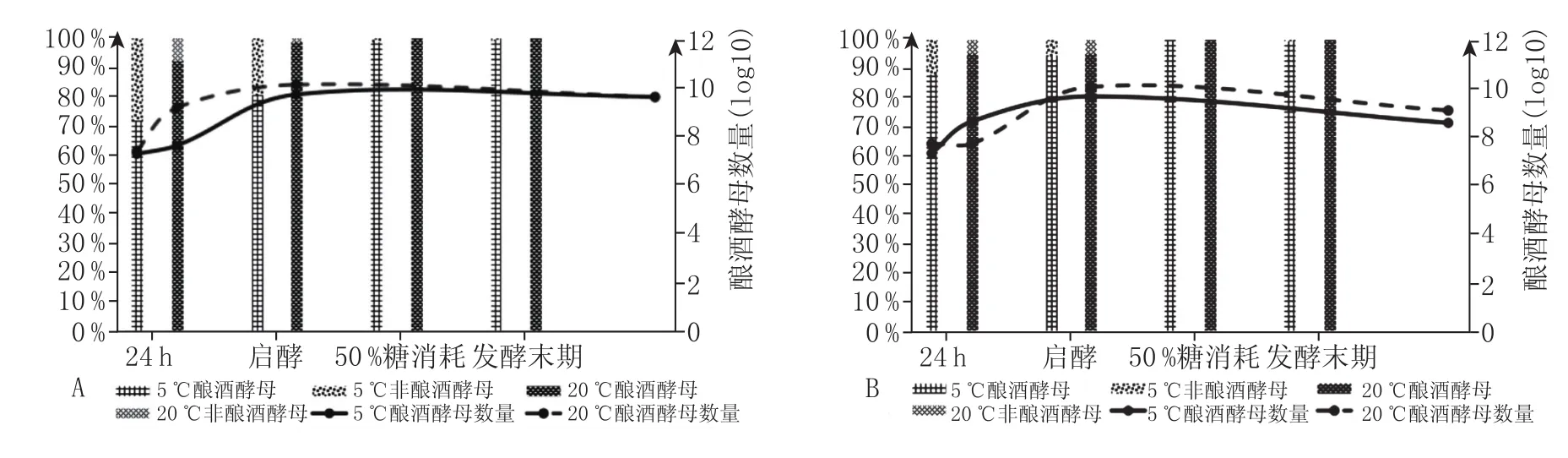
图3 不同处理中酿酒酵母与非酵母属数量和比例
Interdelta指纹图谱法操作方便,且扩增条带的电泳图谱相对比较稳定,因此已经逐渐取代了传统的检测方法,被越来越多的应用于酿酒酵母菌株的鉴定中。使用Interdelta指纹图谱法,不仅可以在亚种水平上快速对酿酒酵母进行区分,而且结果比较准确[8]。
2.4.1 Interdelta分析酿酒酵母基因型
本实验对不同接种条件下、不同发酵时期的酿酒酵母进行随机保存与Interdelta指纹图谱即不同基因型进行分析。如图4所示,本研究中共鉴定出两种Interdelta指纹图谱即两种基因型。除5泳道、6泳道外,其余泳道(泳道2—4,7—9)的条带数量及大小与CEC01(泳道1和10)的一致,可以判断是同源DNA,即为本试验所接种的酿酒酵母CEC01;而5泳道、6泳道明显与CEC01不同,即为野生型酿酒酵母。

图4 Interdelta指纹图谱
2.4.2 Interdelta分析酿酒酵母菌株比例
通过对每个处理的4个时期挑取的20个酿酒酵母单菌落进行Interdelta分型,计算商业酵母CEC01在各个时期的比例来确定其定殖能力,其在发酵过程中的比例如表3所示。整体而言,不同接种方式和不同温度处理下,CEC01在酒精发酵过程中的菌株比例均占90%以上。对于低温直投接种发酵而言,接种24 h及启酵时存在其他野生酵母,表明在此处理方式下CEC01的定殖能力稍弱。结合2.3部分的结果,低温直投接种处理方式中非酵母属酵母的存活能力较强,该处理方式中可能存在不利于商业酿酒酵母CEC01定殖的因素。随着发酵的进行,从50%糖消耗直至发酵末期,CEC01占据绝对的主导地位(100%)。在低温活化接种、回温直投接种和回温活化接种处理中,CEC01的基因型在所有的取样点均达到了100%的比例。

表3 目标基因型所占比例 (%)
3 结论
本实验通过研究4种不同接种条件对CEC01发酵特征的影响及发酵过程4个关键时期所接种酿酒酵母的定殖能力,说明CEC01具有极强的发酵性能,能主导酒精发酵的完成。主要结论如下:
(1)复水活化接种发酵在启酵和发酵速度上快于直投接种发酵,但是,直投接种发酵的发酵过程更加平稳。
(2)在低温直投接种的处理方式中,非酵母属酵母的数量最多,且存活时间较长,可能会影响葡萄酒的风味。
(3)通过Interdelta指纹图谱分析,发酵过程中,目标基因型占总酿酒酵母基因型的90%以上,说明CEC01具有极强的定殖能力,在发酵中占据主导地位。
(4)利用CEC01活性干酵母进行的4种发酵所得到的酒样均符合国家标准,这4种接种方式均可应用于葡萄酒的生产,生产者可根据需要选择在冷浸渍时期低温接种或者干酵母直投的方式进行接种来生产葡萄酒。
