青枯菌铜抗性基因copA的功能
2019-03-29王晓宁梁欢王帅方文生许景升冯洁徐进曹坳程
王晓宁,梁欢,王帅,方文生,许景升,冯洁,徐进,曹坳程
青枯菌铜抗性基因的功能
王晓宁,梁欢,王帅,方文生,许景升,冯洁,徐进,曹坳程
(中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193)
【目的】植物细菌性青枯病(bacterial wilt of plants)是由茄科雷尔氏菌()引起的一种世界性重大土传病害。作为防治青枯病等细菌性病害的重要杀菌剂,铜制剂的广泛使用造成多种植物病原细菌群体中出现了铜抗性菌株。青枯菌Po82菌株大质粒上携带了丁香假单胞菌中的铜抗性编码基因的同源物,论文旨在探明青枯菌Po82菌株在铜抗性、致病性等方面的生物学功能。【方法】以青枯菌Po82菌株为研究对象,利用MEGA6.0软件包,基于邻接法构建的系统发育树,探究铜抗性基因在青枯菌和其他植物病原细菌中的系统进化关系。通过反向遗传学的研究手段,采用基因同源重组双交换和电击转化法,构建基因缺失菌株及相应互补菌株。通过最小抑制浓度(minimal inhibition concentration,MIC)测定、RT-qPCR、Biolog代谢芯片以及致病力等基础生物学测定研究手段,解析与青枯菌铜胁迫应答、代谢活性、致病性和运动性等表型生物学特征之间的关系。【结果】同源性比对分析结果显示,广泛存在于青枯菌群体中,青枯菌在亲缘关系上与耐金属贪铜菌最为紧密, 与稻黄单胞菌、丁香假单胞菌和大肠杆菌的亲缘关系较远。RT-qPCR结果显示的表达受到铜离子的诱导,的表达量随着CuSO4浓度的增加而增加。CuSO4浓度为1.0 mmol·L-1时,基因表达量最高。铜MIC测定结果显示基因缺失菌株对铜离子的敏感性增加,基因缺失菌株的MIC值为0.8 mmol·L-1,较野生型菌株的1.2 mmol·L-1下降了33.3%,互补菌株恢复了铜抗性能力,表明在青枯菌的铜胁迫应答过程中发挥着重要作用。与野生型菌株相比,基因缺失菌株在普通NA培养基及含0.6 mmol·L-1CuSO4的NA培养基中的对数生长期的生长速率降低,表明与青枯菌的生长速率相关。基因缺失菌株于发病前期病情指数较野生型菌株下降,接种第10天,基因缺失菌株的病情指数较Po82野生型菌株下降了11.7%。的缺失导致青枯菌对-D-葡萄糖和D-海藻糖等碳源,L-丙氨酸和葡萄糖醛酰胺等氮源的代谢利用速率降低,使青枯病发病病程延长。与野生型菌株Po82相比,基因缺失菌株中III型分泌系统的转录激活因子编码基因和,III型效应子RipX编码基因的表达量显著下调。【结论】铜抗性基因在青枯菌铜胁迫应答、致病性等方面发挥一定的作用,研究结果可为进一步解析青枯菌的铜抗性分子机制以及铜抗性菌株的防治提供理论依据。
青枯菌;铜抗性;; 致病性
0 引言
【研究意义】由茄科雷尔氏菌()引起的植物细菌性青枯病(bacterial wilt of plants)是一种世界性重大病害[1-2]。由于广阔的地理分布和广泛的生态与寄主适应性,青枯菌可侵染54科450余种植物[3],造成产量损失15%—95%,是农业生产上的重要限制因子[4-5]。铜是生物有机体必备的微量元素,在电子传递链中可以作为电子供体和受体。同时在微生物体内,铜是许多酶和蛋白的重要组分,在许多重要的氧化和还原过程中发挥作用[6-7]。然而,铜的过量积累会促进羟基自由基的产生,从而造成严重的细胞损伤[8]。因此铜制剂作为抗菌剂在防治细菌性病害中起着重要作用。含铜杀菌剂广泛使用造成的持续选择压力,致使包括肠杆菌属(Enterobacter、Hormaeche和Edwards)、假单胞菌属(Pseudomonas)和黄单胞菌属(Xanthomonas)等多个种的细菌群体中出现了铜抗性或耐受性菌株[8-10]。因此,解析青枯菌铜抗性的分子机制有助于青枯菌铜抗性菌株的防治。【前人研究进展】在植物病原细菌中,第一个阐述较为清晰的铜抗性编码系统是丁香假单胞菌(pv.)中的基因簇,是双组分调控系统,调控下游结构基因的表达。丁香假单胞菌采用累积隔离的策略来应对铜胁迫,周质蛋白CopA可结合10.9±1.2铜原子,周质蛋白CopC可结合0.6±0.1铜原子,CopB为外膜蛋白,CopD为内膜转运蛋白[6,9,11]。大肠杆菌()采用外排的作用方式达到抗铜的目的。大肠杆菌存在两套铜抗性系统,其中位于染色体上的-和基因赋予大肠杆菌在好氧条件下中等铜浓度的铜耐受性和厌氧条件下的高铜浓度下铜耐受性,位于质粒上的基因系统负责提供高铜浓度的铜耐受性[12-13]。大肠杆菌CopA蛋白属于P-型ATP酶,负责将过量的铜从细胞质中输出到周质空间。而CusCFBA编码蛋白属于抗性结节化家族成员,负责将铜从细胞质周围排出体外[13]。其中CusA、CusB和CusC参与组装成质子动力外排泵,将过多的铜泵出细胞质外。是基因簇的核心蛋白,编码多铜氧化酶家族蛋白[14]。青枯菌中与的起始密码子重叠,采用CD-search对青枯菌Po82菌株进行蛋白质序列分析,结果表明CopA蛋白属于CopA铜抗性蛋白家族,具有铜结合位点和典型的TaT信号序列(双精氨酸转运途径),表明青枯菌铜抗性的机制为铜转运机制。【本研究切入点】在前期研究中,发现青枯菌Po82菌株的大质粒上携带了与丁香假单胞菌铜抗性编码系统、大肠杆菌抗性编码系统同源的基因簇[15]。该菌株于含亚抑制铜浓度水平(0.8 mmol·L-1CuSO4)的NA上生长48 h后,形成了典型的黑色菌落,推测该菌株可能采用了与丁香假单胞菌相同的应对铜胁迫策略,将铜“隔离/累积”于周质空间。【拟解决的关键问题】为了进一步深入解析是否参与Po82菌株的铜抗性,采用反向遗传学的研究手段,探明与青枯菌铜抗性、致病性等表型生物学特征之间的关系,为进一步研究青枯菌寄主及环境适应性进化的分子机理打下基础,为青枯病的防治提供理论依据。
1 材料与方法
试验于2017年11月至2018年8月在中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室完成。
1.1 菌株、试剂与仪器
供试菌株:青枯菌2号小种Po82菌株,由笔者实验室收集保存;TIANamp Bacteria DNA Kit由天根生化科技有限公司提供,Ex Taq酶由宝日医生物技术有限公司提供,Assembly试剂盒由北京中美泰和生物技术有限公司提供。荧光定量PCR仪为美国AB公司产品,紫外分光光度计为德国AJ公司产品。
1.2 菌株培养条件
供试菌株材料详见表1。青枯菌及其基因缺失菌株在NA(nutrient agar)培养基(葡萄糖10 g·L-1,酵母浸粉0.5 g·L-1,蛋白胨5 g·L-1,牛肉膏3 g·L-1,蔗糖10 g·L-1,琼脂18 g·L-1)28℃培养。大肠杆菌在LB培养基(氯化钠10 g·L-1,胰蛋白胨10 g·L-1,酵母提取物5 g·L-1,琼脂16 g·L-1)37℃培养。所用抗生素浓度:庆大霉素50 μg·mL-1,卡纳霉素50 μg·mL-1,氨苄青霉素50 μg·mL-1。

表1 本试验所用菌株及质粒
1.3 序列分析与系统进化树的构建
从GenBank数据库中获得23个与Po82菌株铜抗性基因同源的基因序列,利用MAGA6构建系统进化树,并以的为外组,采用邻接法(neighbor-joining,NJ)构建系统进化树,自检重复值设置为1 000[16]。
1.4 基因缺失及互补载体构建
NA培养基上培养Po82菌株48—72 h,经PCR验证(759f/760r)后,挑取单菌落于NB培养基中,28℃,180 r/min培养至OD600=0.8—1.0,提取基因组DNA(TIANamp Bacteria DNA Kit)。根据NCBI数据库中发表的Po82全基因组序列(https://www.ncbi. nlm.nih.gov/nuccore/CP002820),分别选取上下游各1 000—1 100 bp左右的序列为靶标,用Blast和Primer 5.0软件设计引物copAupf/r和copAdownf/r,利用高保真酶(TakaRa Ex Taq®)扩增,使用USER酶将扩增的copA上下游片段与经PacI酶切的pKMS1-gm质粒连接,连接顺序为Up-gm-Down[17]。敲除载体构建后经酶切和测序验证。
Po82基因组为模板,设计引物copA Hf/r扩增copA的整个开放阅读框。设计引物PBBRf/r,通过PCR扩增线性化质粒pBBR1mcs-4。根据同源重组双交换的原理,利用Assembly试剂盒将copA扩增基因连接在载体质粒上。互补载体构建后,经引物copATestf/r扩增验证和测序验证。
1.5 基因缺失及互补菌株构建
采用同源重组双交换的原理构建的缺失菌株[18]。通过自然转化法将构建好的敲除载体转化到青枯菌Po82野生型菌株中,筛选出庆大霉素与蔗糖抗性,卡那霉素敏感菌株,分别用759f/760r、copAf/copAr和copAupf/copAdownr进行PCR验证后,测序验证。采用电转的方法构建互补菌株[19]。互补载体转化到缺失菌株中,筛选出具有氨苄青霉素和庆大霉素抗性的菌株,经759f/760r和copAf/r引物PCR验证后,测序验证。
1.6 铜抗性最小抑制浓度(minimal inhibition concentration,MIC)测定
Po82野生型、基因缺失菌株及互补菌株置于NB培养基中,28℃培养至对数生长期(OD600=0.6—0.8),以比浊法稀释至105cfu/mL,取5mL菌液分别涂在含不同浓度CuSO4的NA培养平板上(0.4、0.6、0.8、1.0、1.2 mmol·L-1)。28℃培养48—72 h,以菌落能正常生长的最大CuSO4浓度作为MIC值,每个处理设置3次重复[15]。
1.7 基因表达量测定
挑取NA固体培养基上的青枯菌单菌落于NB培养基中振荡培养(28℃,180 r/min),当菌生长到OD600为0.3—0.4时,分别吸取1 mL菌液至NB培养基和含不同浓度CuSO4的NB培养基中振荡培养,尽量使两份菌液的生长条件一致。摇菌到OD600为0.8时,离心收集菌体用于RNA的提取。RNA的提取采用总TRIzol法(Invitrogen,USA)[20]。cDNA的反转录采用PrimerScript RT reagent Kit with gDNA Eraser(Takara)试剂盒。RT-qPCR采用SYBR Premix Ex TaxⅡ(Takara)试剂盒。荧光定量的仪器为ABI 7500 Real-time Detection System(Applied Biosystems,USA)。PCR反应程序:95℃30 s;95℃5 s,60℃34 s,设置40个循环。用标准曲线评价引物的扩增效率,用熔解曲线评价引物的特异性。用内参基因对RNA样品进行均一化(表2)。相对表达量的计算采用公式为2−ΔΔCt[21]。每个菌株设置3个重复,每个试验重复3次。
1.8 生长曲线测定
将Po82野生型、基因缺失菌株及其相应互补菌株在NB培养基中培养至OD600=0.6—0.8,稀释到OD600=0.3,按1﹕100的体积比接种到不同浓度的CuSO4培养基中(0、0.6 mmol·L-1)。培养于28℃,180 r/min,每3 h测定细胞OD600值,每组重复3次。
1.9 致病性测定
采用伤根接种法测定基因缺失对青枯菌致病力的影响[22]。用NA培养基培养野生型菌株及缺失株48—72 h,灭菌水洗脱菌株,用比浊法稀释到107cfu/mL。番茄感病品种“中杂9号”生长至7—8叶龄期时,在离植株1 cm处的土壤中切下3 cm深的裂口,每棵植株浇注30 mL浓度为107cfu/mL菌液。培养条件为光周期L﹕D=16 h﹕8 h,温度为32/30℃。每个菌株接种20株,每个试验重复3次。病情指数分为5级:0级=无症状;1级=1片叶萎蔫;2级=2—3片叶萎蔫;3级=4片及以上叶片萎蔫;4级=整株叶片萎蔫[23]。
1.10 代谢活性测定
利用Biolog代谢芯片技术评价青枯菌的代谢能力。将纯培养的野生型Po82菌株、基因缺失菌株和互补菌株接种至NA固体培养基上28℃培养48 h备用。将菌落释放到IFA接种液中,调节浊度85%—95%,采用GENⅢ 96孔微孔板28℃培养(图1),测定培养48、72、96、120、144 h后各个菌株的代谢情况[24]。每个处理设置3个重复,试验重复3次。
1.11 运动性测定
在含0.5%琼脂(g·L-1)的SMM半固体培养基上测定野生型和基因缺失菌株的运动性[25]。青枯菌在NB培养基中培养,生长至对数期OD600=0.6—0.8时,离心收集细胞,用灭菌水洗涤两次,稀释至OD600=0.3。取5 μl菌液垂直加在SMM培养基,28℃培养3—5 d,不倒置。青枯菌形成白色晕圈,通过测定平板菌落直径分析菌株的运动性,每个菌株4个重复。
2 结果
2.1 copA系统进化分析
为深入探究青枯菌铜抗性编码基因簇中的系统进化关系,以耐金属贪铜菌()、稻黄单胞菌()、大肠杆菌和假单胞菌中携带的该基因为参照,构建了系统进化树(图2)。结果显示,在青枯菌群体中广泛存在,在亲缘关系上与耐金属贪铜菌最为紧密,与稻黄单胞菌、丁香假单胞菌和大肠杆菌的亲缘关系较远。

表2 本试验所用引物序列
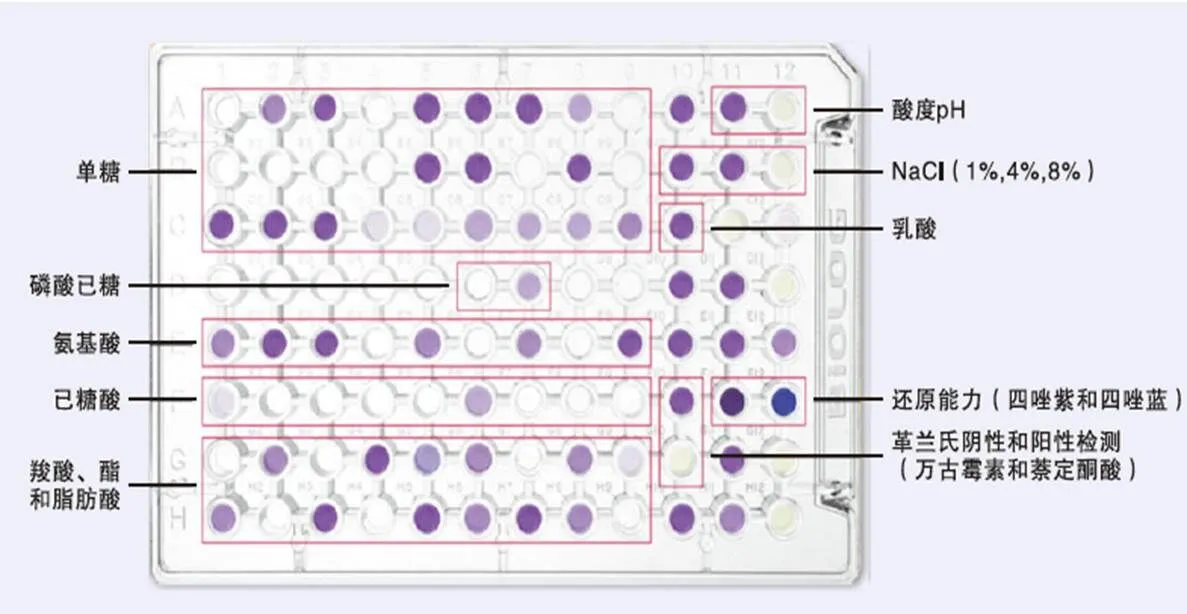
单糖:monosaccharide;磷酸己糖:phosphohexose;氨基酸:amino acid;己糖酸:hexonic acid;羧酸、酯和脂肪酸:carboxylic acid, ester and fatty acid;酸度:acidity;乳酸:lactic acid;还原能力(四唑紫和四唑蓝):Reducing power (tetrazolium violet and tetrazolium blue);革兰氏阴性和阳性检测(万古霉素和萘啶酮酸):Gram-negative and positive detection (vancomycin and nalidixic acid)
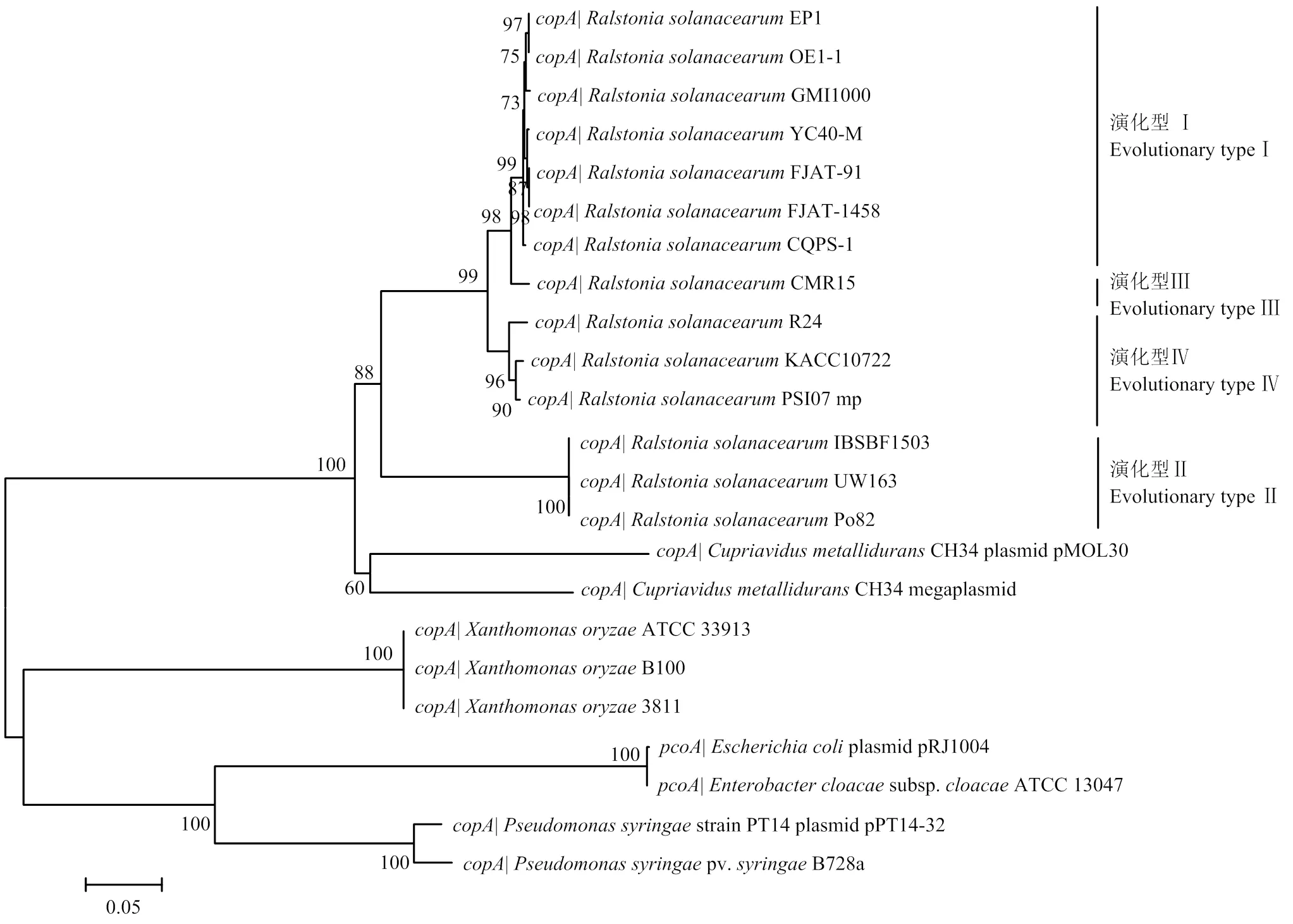
图2 基于copA 构建的系统进化树
2.2 copA基因缺失菌株和互补菌株的构建
将构建好的敲除载体pKMS1--gm扩增后提取质粒,使用限制性内切酶I和HI进行双酶切验证,的左右臂长度分别约为1 000和1 010 bp,加上中间的gm共2 986 bp,pKMS1-copA-gm载体片段总长度为9.2 kb,酶切后剩余部分片段约为6.4 kb,双酶切图谱如图3-A。酶切结果与测序比对得到copA基因缺失载体。将copA基因缺失载体转化到野生型菌株,筛选出庆大霉素抗性和蔗糖抗性的菌株,PCR验证(图3-C、3-D)和测序验证后,最终获得基因缺失菌株。
的扩增片段与互补载体连接后,PCR(图3-B)与测序验证。将重组互补载体pBBR-copA转化入基因缺失菌株后,构建互补菌株,PCR(图3-C、3-D)和测序验证最终获得互补菌株。
2.3 copA缺失对青枯菌铜离子耐受能力的影响
为评价在青枯菌铜抗性中的作用,构建了基因缺失菌株及其相应互补菌株,采用MIC法测定青枯菌的铜抗性水平。Po82野生型菌株的MIC值为1.2 mmol·L-1,基因缺失菌株的MIC值降至0.8 mmol·L-1,铜抗性水平下降了33.3%,互补菌株恢复了与野生型菌株相当的抗铜能力。
2.4 copA的诱导表达分析
Po82菌株在常规(非铜胁迫)培养条件下,其携带的在不同生长阶段均以本底水平表达;在不同CuSO4浓度的胁迫下,与对照组相比,表达量随CuSO4诱导浓度的增加而增加,差异显著。其中基因表达量最高的CuSO4浓度为1.0 mmol·L-1,是对照组基因表达量的85.6倍(图4)。
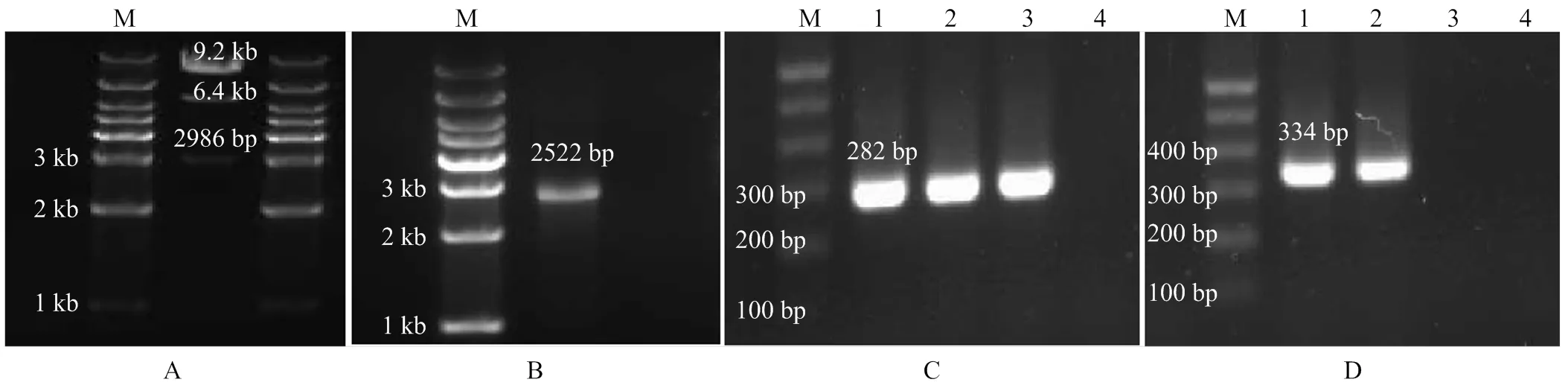
A:缺失载体酶切验证图The enzyme cutting verification diagram of deletion plasmid;B:互补载体验证图(copA Testf/r)The verification diagram of complementary carrier (copA Testf/r);C:敲除及互补菌株引物检测(759f/760r;1—4:Po82野生型菌株、copA缺失菌株、copA互补菌株、空白对照)The detection of deletion and complementary strains(759f/760r; 1-4: Po82 wild-type strain, copA gene deletion strain, copA complementary strain and the control);D:敲除及互补菌株引物检测(copAf/r;1—4:Po82野生型菌株、copA互补菌株、copA缺失菌株、空白对照)The detection of deletion and complementary strains (copAf/r; 1-4: Po82 wild-type strain, copAcomplementary strain, copA gene deletion strain and the control)
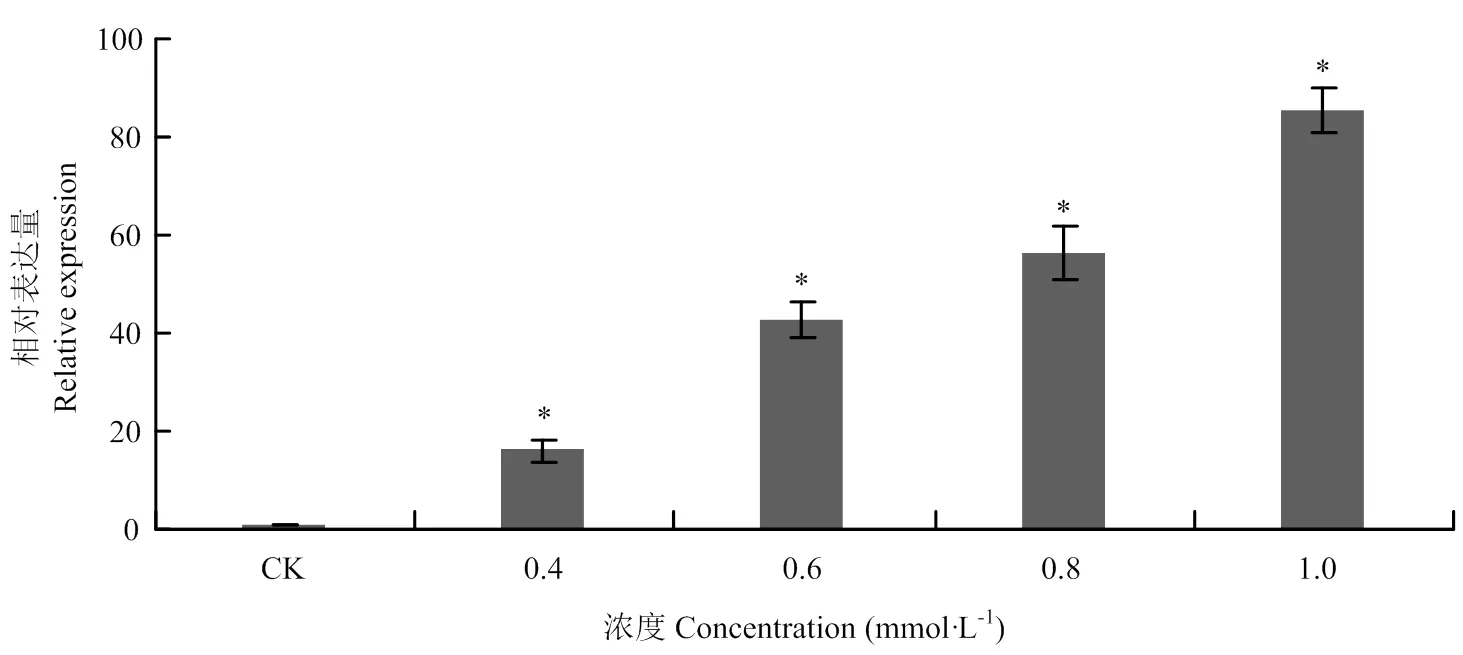
柱上星号表示不同诱导浓度下,基因表达量差异显著(P<0.05)
2.5 copA对青枯菌在铜逆境条件下生长的影响
在NA培养基中,与野生型菌株Po82相比,基因缺失菌株ΔPo82copA在对数生长期的生长速率显著下降,基因缺失菌株与互补菌株之间无显著差异。随着培养时间的增加,基因缺失菌株及互补菌株的生长速率较野生型菌株之间无显著差异(图5-A)。在添加了0.6 mmol·L-1CuSO4的NA培养基中,与野生型菌株相比,基因缺失菌株在迟缓期已达显著差异,对数期生长速率显著下降(图5-B)。互补菌株的生长速率较低,互补菌株的构建是将的开放阅读框连接在互补质粒pBBR1mcs-4载体的,RT-qPCR结果显示持续表达(结果未显示),因此推测可能是因为互补菌株中的过量表达导致生长速率下降。
2.6 copA的缺失对青枯菌致病性的影响
采用伤根法接种番茄植株探究对青枯菌致病性的影响。结果显示,接种第6天开始,野生型菌株与基因缺失菌株开始出现发病萎蔫现象,二者无显著差异。接种第7—10天,基因缺失菌株与野生型菌株之间差异显著。接种第10天,基因缺失菌株的病情指数为45.3,病情指数较野生型Po82菌株下降了11.7%。接种13 d后恢复与野生型菌株相当的致病力(图6)。互补菌株恢复了其部分的致病力。
采用RT-qPCR测定基因缺失菌株中与致病相关基因的表达情况,结果显示与野生型菌株相比,、的表达量显著下调(图7)。

A:NA培养基NA medium;B:添加0.6 mmol·L-1 CuSO4的NA培养基 NA medium added 0.6 mmol·L-1 CuSO4
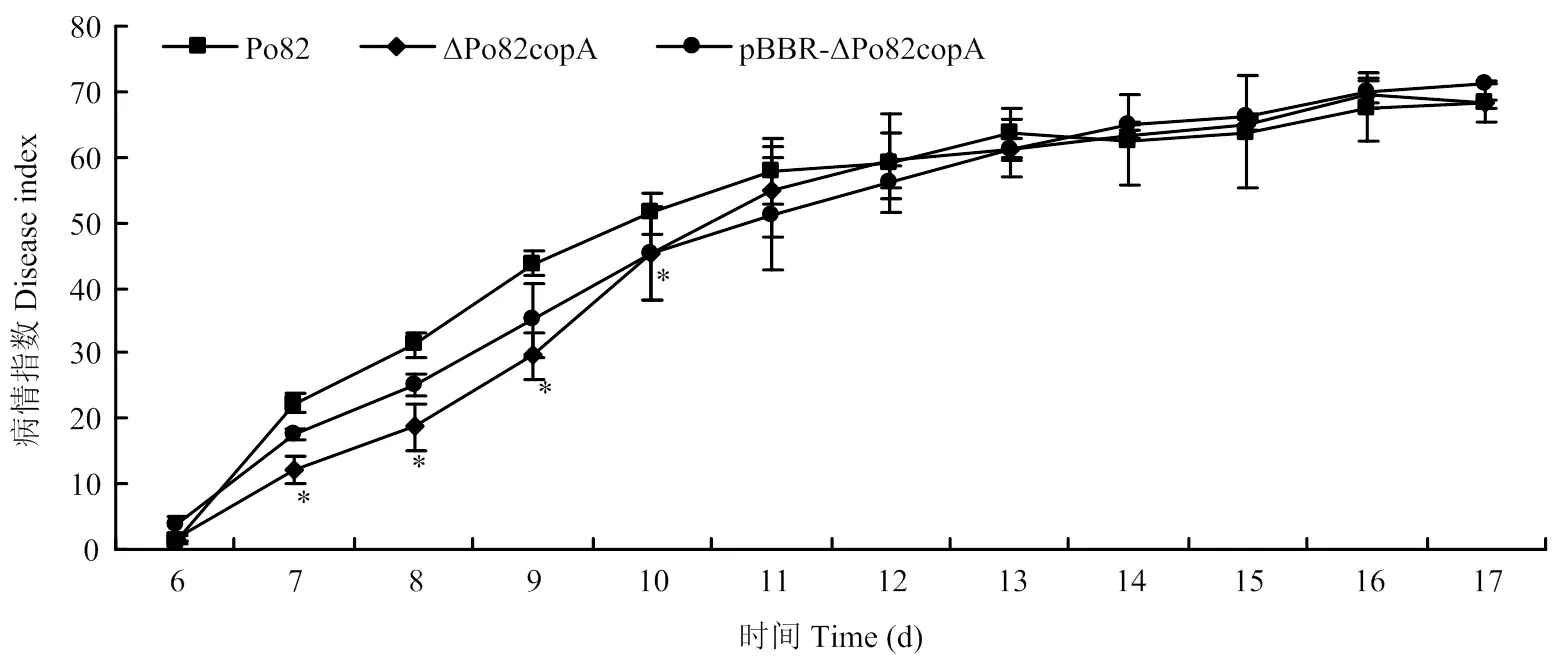
图6 青枯菌野生型菌株、copA基因缺失和互补菌株接种番茄后致病力测定
2.7 copA基因缺失对青枯菌代谢活性的影响
为了探究对青枯菌代谢通路的影响,采用Biolog代谢芯片技术测定了野生型菌株和基因缺失、互补菌株对96种底物(包括糖类、氨基酸、脂肪酸、羧酸)的代谢利用情况。结果表明,基因缺失菌株对-D-葡萄糖(微孔板C1)、D-海藻糖(微孔板A4)等碳源和L-丙氨酸(微孔板E3)、葡萄糖醛酰胺(微孔板F6)等氮源在代谢上有明显差距(图8)。
2.8 copA基因缺失对青枯菌运动性的影响
运动性在细菌致病过程中发挥着重要作用。将野 生型菌株、基因缺失和互补菌株接种至5%SMM半固体培养基上,用十字交叉法测定运动性(图9),并进行统计学分析[26]。与野生型菌株相比,缺失和互补菌株运动能力变化差异不显著。
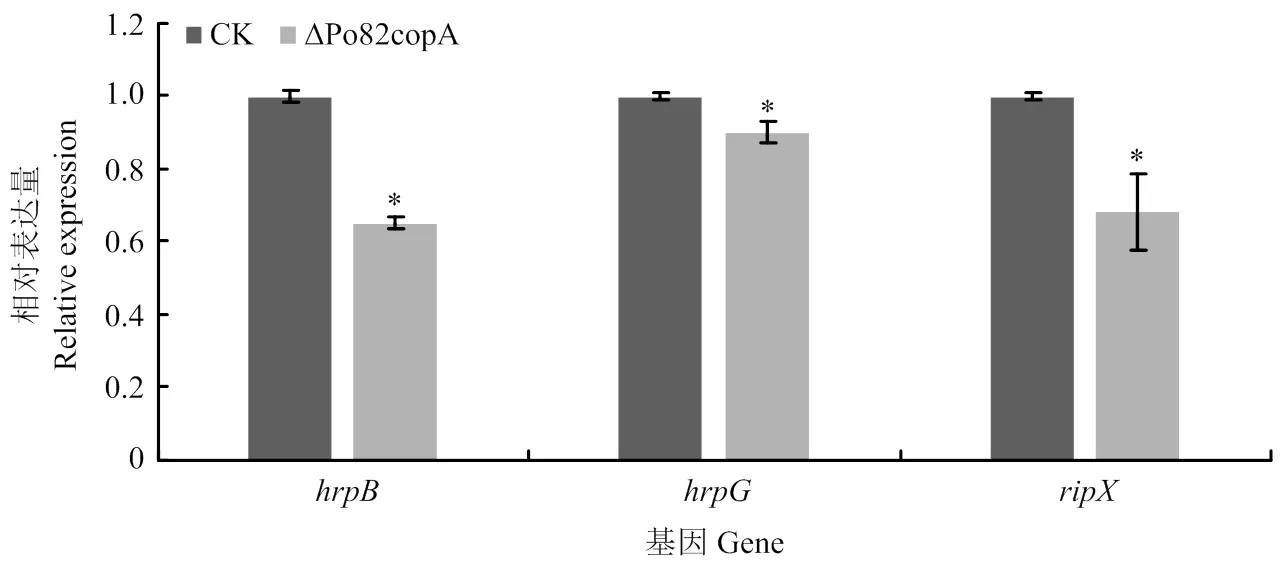
图7 青枯菌野生型菌株、copA基因缺失菌株致病相关基因表达分析
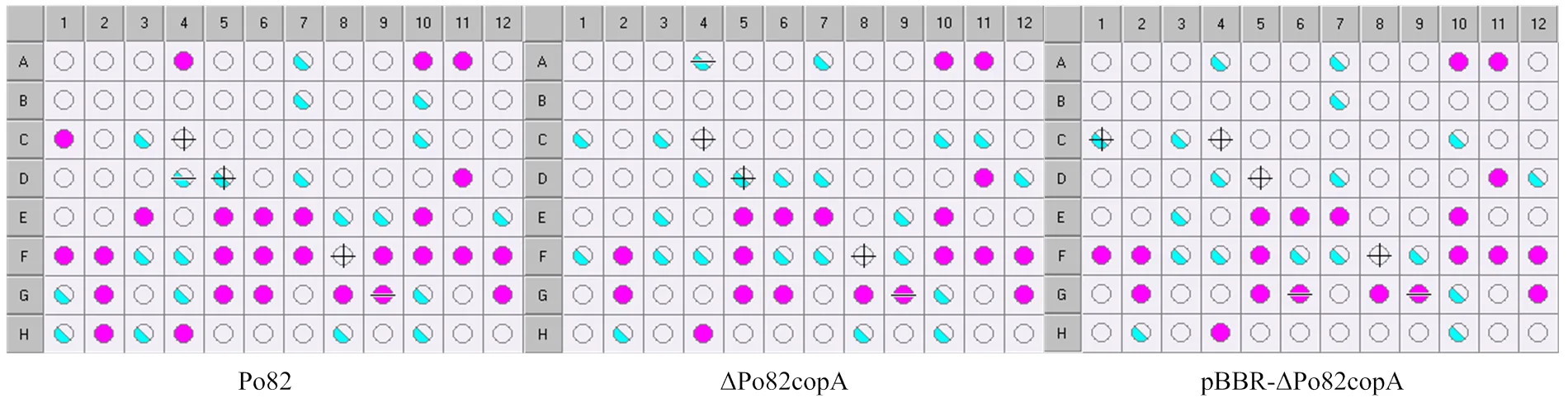
紫色孔定义为阳性,浅于紫色的孔定义为边界值。该图分别表示野生型菌株、基因缺失菌株ΔPo82copA和互补菌株pBBR-ΔPo82copA在培养96 h后的代谢结果。α-D-葡萄糖(微孔板C1)在3种菌株的OD590分别为0.632、0.521、0.372;D-海藻糖(微孔板A4)在3种菌株的OD590分别为0.620、0.480、0.383;L-丙氨酸(微孔板E3)在3种菌株的OD590分别为0.786、0.370、0.436;葡萄糖醛酰胺(微孔板F6)在3种菌株的OD590分别为0.566、0.388、0.380
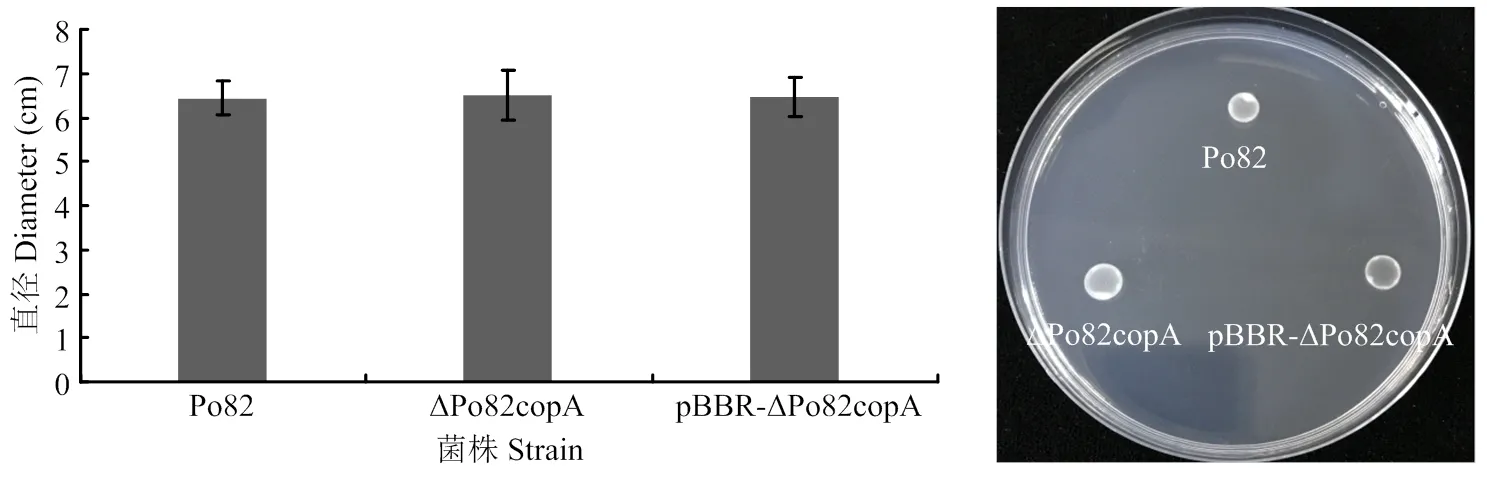
图9 青枯菌野生型菌株、copA基因缺失和互补菌株的运动性
3 讨论
生境中铜胁迫水平的变化可诱导细菌中铜抗性编码系统的转录表达,进而通过外排、隔离/累积以及介导细胞膜结构改变等机制,抵御过量铜对自身正常生理过程的干扰。细菌携带的铜抗性编码系统大都存在于接合质粒等可移动遗传因子上(mobile genetic elements,MGEs),如之于丁香假单胞菌的pP14-32质粒,之于大肠杆菌的pRJ1004质粒。相关研究表明,铜抗性编码基因簇可通过质粒接合等水平基因转移事件赋予相同生态位中敏感菌株以铜抗性。Altimira等[27]基于土壤宏基因组的研究结果显示,3份不同地理来源的铜污染农田土中均可检测到;反之,无污染农田土中则检测不到该基因。耐金属贪铜菌携带了两套铜抗性编码系统,一套位于大质粒(等同于第二染色体),另一套位于小质粒pMOL30。青枯菌Po82菌株中单一拷贝的基因簇同样位于大质粒上,基于系统进化分析的结果显示,青枯菌在系统进化关系上与耐金属贪铜菌同源性最高。PRior等[28]基于、和等青枯菌持家基因的系统进化关系,将青枯菌进一步划分为与地理起源密切相关的4个演化型:演化型I对应亚洲分支菌株;演化型Ⅱ对应美洲分支菌株;演化型Ⅲ对应非洲分支菌株;演化型Ⅳ对应印尼分支菌株。本研究基于构建的系统进化树与基于上述持家基因构建的进化树具有相同的分支结构[5],表明该基因可能是青枯菌核心基因组成员,随青枯菌祖先基因共同进化。
RT-qPCR结果显示的表达受胞外铜离子信号的诱导,其表达量在亚抑制浓度范围内(≤1.0 mmol·L-1)随铜离子浓度的增加而上调,证实是青枯菌Po82菌株铜抗性所必需的。基因反向遗传学研究手段进一步探明了该基因缺失后,Po82菌株的铜耐受水平显著降低;pBBR-ΔPo82copA恢复部分铜抗性水平。本研究中的编码产物为可能的周质蛋白,其缺失导致Po82菌株的铜耐受性下降,但MIC值仍高于不携带基因簇的铜敏感青枯菌株Po40的0.4 mmol·L-1,推测原因可能为:(1)基因簇中的、和编码产物参与了宿主菌Po82应对铜胁迫的应答反应;(2)Po82菌株中携带的Cus(RND)和P-ATPase等铜代谢基因(簇)[29]与cop铜抗性基因簇相互协同以应对外界铜逆境的胁迫。但采用何种方式相互作用,尚需进一步深入研究。
Zhang等[30]报道微生物铜抗性基因与致病性具有一定联系,荧光假单胞菌()基因缺失菌株在甜菜和豌豆植株根部竞争性定殖的能力降低。在本研究中,基因缺失菌株对番茄的致病力与野生型菌株相比显著下降;RT-qPCR结果同时显示基因缺失菌株Ⅲ型分泌系统相关调控基因与效应子编码基因、和的表达量显著下降,表明铜抗性编码基因部分参与了青枯菌的致病过程。Ⅲ型分泌系统在青枯菌成功完成侵染过程中发挥着至关重要的作用,相关研究也已证实青枯菌通过外膜受体蛋白PrhA(plant regulator of)感知寄主信号,并通过级联依次将信号传递并激活、、和等转录调控相关基因的表达。基因编码产物通过与Ⅲ型分泌系统装置蛋白及效应蛋白编码基因上游的顺式作用元件结合,启动Ⅲ型分泌系统的组装形成及Ⅲ型效应子的泌出[31-33]。铜抗性编码基因如何与Ⅲ型分泌系统调控基因与相互作用,并参与青枯菌的致病过程,值得进一步深入研究。Biolog代谢分析表明,基因缺失菌株ΔPo82copA对-D-葡萄糖、D-海藻糖等碳源的代谢利用效率显著降低,以上碳源存在于植株维管束和胞间液流中,青枯菌通过自身分泌的胞外酶分解代谢利用这些碳源,有助于在寄主维管束中侵染。因此,青枯菌对这些碳源的代谢利用程度关系到青枯菌对寄主的侵染过程。这一结果也佐证了基因缺失菌株ΔPo82copA的致病力较野生型降低。
4 结论
对青枯菌铜抗性编码基因进行了功能分析,该基因在青枯菌铜胁迫应答、致病性等生物学功能上发挥着重要作用,研究结果有助于进一步深入解析青枯菌铜抗性的分子调控机制,并可为铜抗性菌株的有效治理提供理论依据。
[1] 徐进, 冯洁. 植物青枯菌遗传多样性及致病基因组学研究进展. 中国农业科学, 2013, 46(14): 2902-2909.
XU J, FENG J. Advances in research of genetic diversity and pathogenome ofspecies complex., 2013, 46(14): 2902-2909. (in Chinese)
[2] Mukaihara T, Hatanaka T, Nakano M, ODA K.type III effectoris a glutathione-degrading enzyme that is activated by plant cytosolic thioredoxins and suppresses plant immunity., 2016, 7(2): e00359-16.
[3] 张争, 徐进, 许景升, 何礼远, 冯洁. 植物青枯菌基因克隆及猝灭群体感应信号功能的研究. 中国农业科学, 2008, 41(9): 2651-2656.
ZHANG Z, XU J, XU J S, HE L Y, FENG J. Cloning ofgene ofand function research on quenching quorum-sensing signal., 2008, 41(9): 2651-2656. (in Chinese)
[4] WICKER E, GRASSART L, CORANSON-BEAUDU R, MIAN D, GUILBAUD C, FEGAN M, PRIO P.strains from Martinique (French West Indies) exhibiting a new pathogenic potential., 2007, 73(21): 6790-6801.
[5] XU J, PAN Z C, PRIOR P, XU J S, ZHANG Z, ZHANG H, ZHANG L Q, HE L Y, FENG J. Genetic diversity ofstrains from China., 2009, 125(4): 641-653.
[6] CHA J S, COOKSEY D A. Copper resistance inmediated by periplasmic and outer membrane proteins., 1991, 88(20): 8915-8919.
[7] RADEMACHER C, MASEPOHL B. Copper-responsive gene regulation in bacteria., 2012, 158(10): 2451-2464.
[8] ANTSOTEGI-USKOLA M, MARKINA-Iñarrairaegui A, UGALDE U. Copper resistance inrelies on the P1-type ATPase CrpA, regulated by the transcription factor AceA., 2017, 8: Article 912.
[9] MELLANO M A, COOKSEY D A. Nucleotide sequence and organization of copper resistance genes frompv.., 1988, 170(6): 2879-2883.
[10] HOEGLER K J, HECHT M H. Aprotein confers copper resistance in., 2016, 25(7): 1249-1259.
[11] BONDARCZUK K, PIOTROWSKA-SEGET Z. Molecular basis of active copper resistance mechanisms in Gram-negative bacteria., 2013, 29(6): 397-405.
[12] GRASS G, RENSING C. Genes involved in copper homeostasis in., 2001, 183(6): 2145-2147.
[13] Wayne Outten F, Huffman D L, Hale J A, O’Halloran T V. The Independentandsystems confer copper tolerance during aerobic and anaerobic growth in., 2001, 276(33): 30670-30677.
[14] RENSING C, GRASS G.mechanisms of copper homeostasis in a changing environment., 2003, 27(2/3): 197-213.
[15] 胡小梅. 青枯菌抗铜基因簇的功能研究[D]. 北京: 中国农业科学院, 2016.
HU X M. Research on function of putative copper resistance gene clusterof[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016. (in Chinese)
[16] 李芳菲, 马文瑶, 金亮亮, 杨英军. 基于PG蛋白的蔷薇科植物分子进化树的构建与分析. 分子植物育种, 2018, 16(19): 6332-6340.
LI F F, MA W Y, JIN L L, YANG Y J. Construction and analysis of molecular phylogenetic tree of rosaceae plant based on polygalacturonase protein., 2018, 16(19): 6332-6340. (in Chinese)
[17] FRANDSEN R J, ANDERSSON J A, KRISTENSEN M B, GIESE H. Efficient four fragment cloning for the construction of vectors for targeted gene replacement in filamentous fungi.,2008, 9: 70.
[18] BOUCHER C A, BARBERIS P A, TRIGALET a p, DEMERY D A. Transposon mutagenesis of: Isolation of Tn5-induced avirulent mutants., 1985, 131(9): 2449-2457.
[19] LAVIE M, SHILLINGTON E, EGUILUZ C, GRIMSLEY N, BOUCHER C. PopP1, a new member of the YopJ/AvrRxv family of type III effector proteins, acts as a host-specificity factor and modulates aggressiveness of., 2002, 15(10): 1058-1068.
[20] 张丽勍. 植物青枯菌GMI1000菌株Ⅵ型分泌系统基因功能的研究[D]. 北京: 中国农业科学院, 2013.
ZHANG L Q. Research on the function of genes in type VI secretionsystem ofGMI1000 strain[D]. Beijing: Chinese Academy of Agricultural Sciences, 2013. (in Chinese)
[21] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod., 2001, 25(4): 402-408.
[22] HE L Y, SEQUEIRA L, KLEMAN A. Characteristics of strains offrom China., 1983, 67(12): 1357-1361.
[23] MENG F, YAO J, ALLEN C. A MotN mutant ofis hypermotile and has reduced virulence., 2011, 193(10): 2477-2486.
[24] 王帅. 植物青枯菌VBNC状态及相关基因生物学功能的研究[D]. 北京: 中国农业科学院, 2018.
WANG S. Research on VBNC state and function analysis of the related genein[D]. Beijing: Chinese Academy of Agricultural Sciences, 2018. (in Chinese)
[25] Tans-Kersten J, BROWN D, ALLEN C. Swimming motility, a virulence trait of, is regulated by FlhDC and the plant host environment., 2004, 17(6): 686-695.
[26] YAO J, ALLEN C. Chemotaxis is required for virulence and competitive fitness of the bacterial wilt pathogen., 2006, 188(10): 3697-3708.
[27] Altimira F, Yáñez C, Bravo G, González M, Rojas L A, SeegeR M. Characterization of copper-resistant bacteria and bacterial communities from copper-polluted agricultural soils of central Chile., 2012, 12: 193.
[28] Prior P, Fegan M. Recent development in the phylogeny and classification of., 2005, 695: 127-136.
[29] OUTTEN F W, HUFFMAN D L, HALE J A, O’Halloran T V. The independentandsystems confer copper tolerance during aerobic and anaerobic growth in., 2001, 276(33): 30670-30677.
[30] ZHANG X X, RAINEY P B. The role of a P1-type ATPase fromSBW25 in copper homeostasis and plant colonization., 2007, 20(5): 581-588.
[31] VASSE J, GENIN S, FREY P, Boucher C, Brito B. Theandregulatory genes ofare required for different stages of the tomato root infection process., 2000, 13(3): 259-267.
[32] ASOLKAR T, RAMESH R. Development of T3SS mutants (-and-) of, evaluation of virulence attenuation in brinjal and tomato—a pre-requisite to validate T3Es of., 2018, 58(3): 372-380.
[33] VAN GIJSEGEM F, VASSE J, CAMUS J C, MARENDA M, Boucher C.produces hrp-dependent pili that are required for PopA secretion but not for attachment of bacteria to plant cells., 2000, 36(2): 249-260.
Function of Copper-resistant Geneof
WANG XiaoNing, LIANG Huan, WANG Shuai, FANG WenSheng, XU JingSheng, FENG Jie, XU Jin, CAO AoCheng
(State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193)
【Objective】 Bacterial wilt of plants, caused by, is a major soil-borne disease around the world. As an important bactericide to control bacterial diseases such as bacterial wilt, the widespread use of copper-based bactericides has led to the emergence of copper-resistant strains in a variety of plant pathogenic bacterial population. The copper-resistant coding gene, homologous with, was carried on the megaplasmid ofPo82 strain. The objective of this study is to investigate the biological function ofin copper resistance and pathogenicity of Po82 strain.【Method】The phylogenetic relationship of the copper-resistant genein different strains ofand other phytobacterial strains was analyzed based on neighbor-joining method using MEGA6.0 for constructing the phylogenetic tree of. By means of reverse genetics strategy, using the methods of gene homologous recombination and electroporation,gene deletion and complementary strains of Po82 were constructed. Copper minimal inhibition concentration (MIC) test, RT-qPCR, Biolog chip analysis, pathogenicity test and other basic biological methods were employed to clarify the relationship betweenand biological characteristics such as response to copper stress, metabolic activity, pathogenicity, and motility of【Result】The results of homology analysis showed that theexisted widely in the bacterial population, and theofwas most closely related to, but far genetic relationship with,and. RT-qPCR analysis showed that the expression ofwas induced by copper. The expression ofincreased with the increase of CuSO4concentration. Theexpression level ofwas the highest when the CuSO4concentration was 1.0 mmol·L-1. By MIC analysis, the result showed that the sensitivity of thedeletion strain to copper was significantly increased. The MIC value ofdeletion strain was 0.8 mmol·L-1, which decreased by 33.3% compared with that of wild-type strain (1.2 mmol·L-1). The complementary strain restored copper resistance. The results indicated thatplayed an important role in copper resistance of. Compared with wild-type strain, the logarithmic growth rate ofgene deletion strain decreased in both NA medium and NA medium containing 0.6 mmol·L-1CuSO4, indicating thatwas related to the growth rate of.The absence ofresulted in a decrease in the pathogenicity of. On the 10th day of inoculation, the disease index of thegene deletion strain decreased by 11.7% compared with that of the wild-type strain Po82. The absence ofresulted in a reduction of metabolic utilization rate of carbon sources such as-D-glucose, D-trehalose and nitrogen sources such as L-alanine and glucuronide. Compared with wild-type strain Po82, the expression level of,andgenes, which are important components of the type Ⅲ secretion system, was also significantly down-regulated ingene deletion strain. 【Conclusion】 The copper-resistant geneplays an important role in copper stress response and pathogenicity of. The results provide a theoretical basis for further analysis of copper resistance mechanism and the control of copper-resistant strains.
; copper-resistant;; pathogenicity
10.3864/j.issn.0578-1752.2019.05.006
2018-10-30;
2018-11-29
国家重点研发计划(2017YFD0201600,2018YFD0200802)、国家科技支撑计划(2015BAD08B03)、国家自然科学基金(31571975)、中国农业科学院创新工程(CAAS-XTCX2016012)
王晓宁,E-mail:18811012063@163.com。通信作者徐进,E-mail:jinxu@ippcaas.cn。通信作者曹坳程,E-mail:caoac@vip.sina.com
(责任编辑 岳梅)
