低聚果糖对仿刺参生长及生长免疫因子的影响
2019-03-29赵丽丽包焕玲姜永新刘圣臣刘佳亮曹学彬
赵丽丽,包焕玲,姜永新,刘圣臣,刘佳亮,曹学彬
( 山东东方海洋科技股份有限公司,山东 烟台 264003 )
低聚果糖又称蔗果低聚糖或果寡糖,是由1~3个果糖基通过β(2-1)糖苷键与蔗糖中的果糖基结合生成的蔗果三糖、蔗果四糖和蔗果五糖等的混合物。作为一种天然活性物质,低聚果糖质量稳定,不易被内源酶消化,能够促进肠道双歧杆菌(Bifidobacterium)的增殖,促进钙吸收,增强机体免疫力[1-4],目前已被广泛应用于化妆品、食品、保健品以及动物饲料中,被誉为抗生素时代后最具潜力的新一代添加剂—促生物质。研究表明,饲料中添加低聚果糖,可显著提高大菱鲆(Scophthalmusmaximus)[5]、奥尼罗非鱼(Oreochromisniloticus×O.aureus)[6]的生长性能,提升银鲫(Carassiusauratusgibelio)[7]、草鱼(Ctenopharyngodonidellus)[8]的非特异性免疫能力。
仿刺参(Apostichopusjaponicus),属棘皮动物门、海参纲,具有较高的食用与药用价值,是我国名贵的海珍品之一[9]。近年来,随着仿刺参需求量的增大,其增养殖业发展迅速。然而,由于对仿刺参的抗逆性研究不足,在遭遇病害或自然灾害时,往往会造成大面积减产甚至绝产。仿刺参无特异性免疫系统,机体关键防御机制受细胞免疫应答和非细胞的体液应答调节[10]。已有研究表明,饲料中添加壳寡糖和低聚木糖等寡糖类物质可显著提高仿刺参的生长性能和免疫能力[11-13]。低聚果糖是目前已经形成产业化的寡糖类物质,而其在仿刺参配合饲料中应用尚未见报道。笔者以仿刺参为研究对象,通过在基础饲料中添加不同含量的低聚果糖,研究其对仿刺参生长、体成分及机体生长免疫因子的影响,旨在为仿刺参的健康养殖提供科学依据。
1 材料与方法
1.1 试验饲料配方及制作
以藻粉和发酵豆粕为主要原料,设计粗蛋白含量约40%的基础饲料。在基础饲料中分别添加0.20%、0.40%、0.60%、0.80%、1.00%的菊芋低聚果糖(≥95%,凡秘能特种糖业有限公司),并设对照组(不添加低聚果糖),制作6组等氮、等能的试验饲料,饲料配方及基本成分见表1。
各固体原料超微粉碎过200目标准筛,按配比称量质量,逐级混匀。将饲料和海泥(3∶7)充分混匀,加入适量蒸馏水后,用小型饲料挤压机挤压成条形饲料,稍微晾晒后,置于冰箱中4 ℃保存备用。
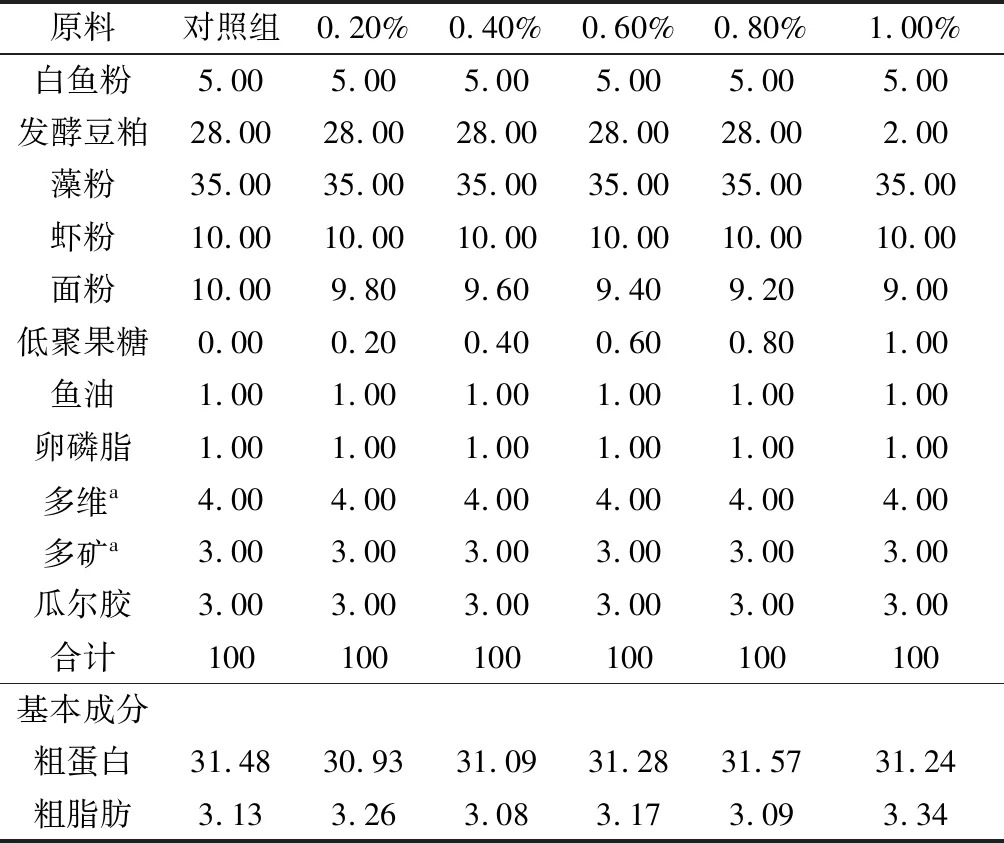
表1 试验饲料配方及基本组成(干基) %
注:a.多维、多矿参见文献[13].
1.2 试验设计与养殖管理
试验开始前,试验用仿刺参于圆柱形养殖水槽中驯养2周,期间投喂基础饲料。正式试验开始之前,禁食24 h,挑选体质健壮,规格整齐,初始质量约20 g的仿刺参720头,随机分布到18个蓝色圆柱形水槽中(高80 cm,直径80 cm)。试验分为6个处理,每个处理3个重复,每个重复放养30头仿刺参,每种饲料随机投喂3个水槽。
日投喂1次(17:00),投喂量为仿刺参初始体质量的10%,观察仿刺参摄食情况,调整次日投喂量。采用气石进行微充气,每日采用虹吸法将残饵、粪便吸出后,换水约50%。养殖试验持续14周。试验期间水温15.2~18.4 ℃,盐度26~29,溶解氧>5 mg/L。试验在弱光环境中进行。
1.3 样品采集与分析
试验结束后,禁食48 h,记录每桶仿刺参的数量并称量质量,计算存活率、质量增加率和特定生长率;每桶随机取10头仿刺参,解剖分离体壁和肠道,分别置于-20 ℃保存待测。剩余仿刺参继续投喂2周后,每桶随机取5头,用无菌注射器自背部刺入体腔,吸取体腔液,3000 r/min离心10 min后,吸取上清液,保存于-80 ℃待测。
成活率/%=n/30×100%
质量增加率/%=(m2-m1)/m1×100%
特定生长率/%·d-1=(lnm2-lnm1)/t×100%
式中,n为试验末仿刺参数量(头),m1为试验初仿刺参均质量(g),m2为试验末仿刺参均质量(g),t为试验时间(d)。
饲料及仿刺参样品中水分用105 ℃烘干至恒定质量法测定(GB/T 6435—2006),粗蛋白用凯氏定氮法测定(GB/T 6432—2006),粗脂肪用索氏抽提法测定(GB/T 6433—2006),粗灰分用550 ℃损失质量法测定(GB/T 6438—2007),氨基酸参照GB/T 14924.10—2008,采用全自动氨基酸测定仪(Hitachi L-8900,日本)测定,总糖依据文献[14]测定。
肠道4 ℃解冻后,按1∶9(m∶V)加入预冷的蒸馏水后,冰浴匀浆5 min后,3000 r/min离心10 min,吸取上清液待测。
体腔液中生长激素、补体C3、补体C4、一氧化氮合酶及肠道匀浆液中丙酮酸激酶、己糖激酶含量采用ELISA试剂盒(上海纪宁实业有限公司)测定,测定方法及活力单位设定见说明书。
1.4 数据统计分析
试验所得数据采用Excel 2007和SPSS 17.0软件进行单因素方差分析,差异显著时(P<0.05)采用Duncan氏检验进行多重比较分析。统计结果以平均值±标准差的形式表示。
2 结 果
2.1 低聚果糖对仿刺参生长性能的影响
低聚果糖对仿刺参生长性能的影响见表2。由表2可知,饲料中添加低聚果糖对试验仿刺参的成活率无显著影响(P>0.05)。试验仿刺参的质量增加率和特定生长率随低聚果糖含量的增加呈先升后降的趋势,均在0.80%试验组达到最高值(P<0.05)。
以质量增加率为评价指标,经一元二次回归分析,体质量约20 g的仿刺参配合饲料中低聚果糖的适宜添加量为0.55%(图1)。

表2 低聚果糖对仿刺参生长性能的影响
注:同行上标英文字母不同表示差异显著(P<0.05),下同.
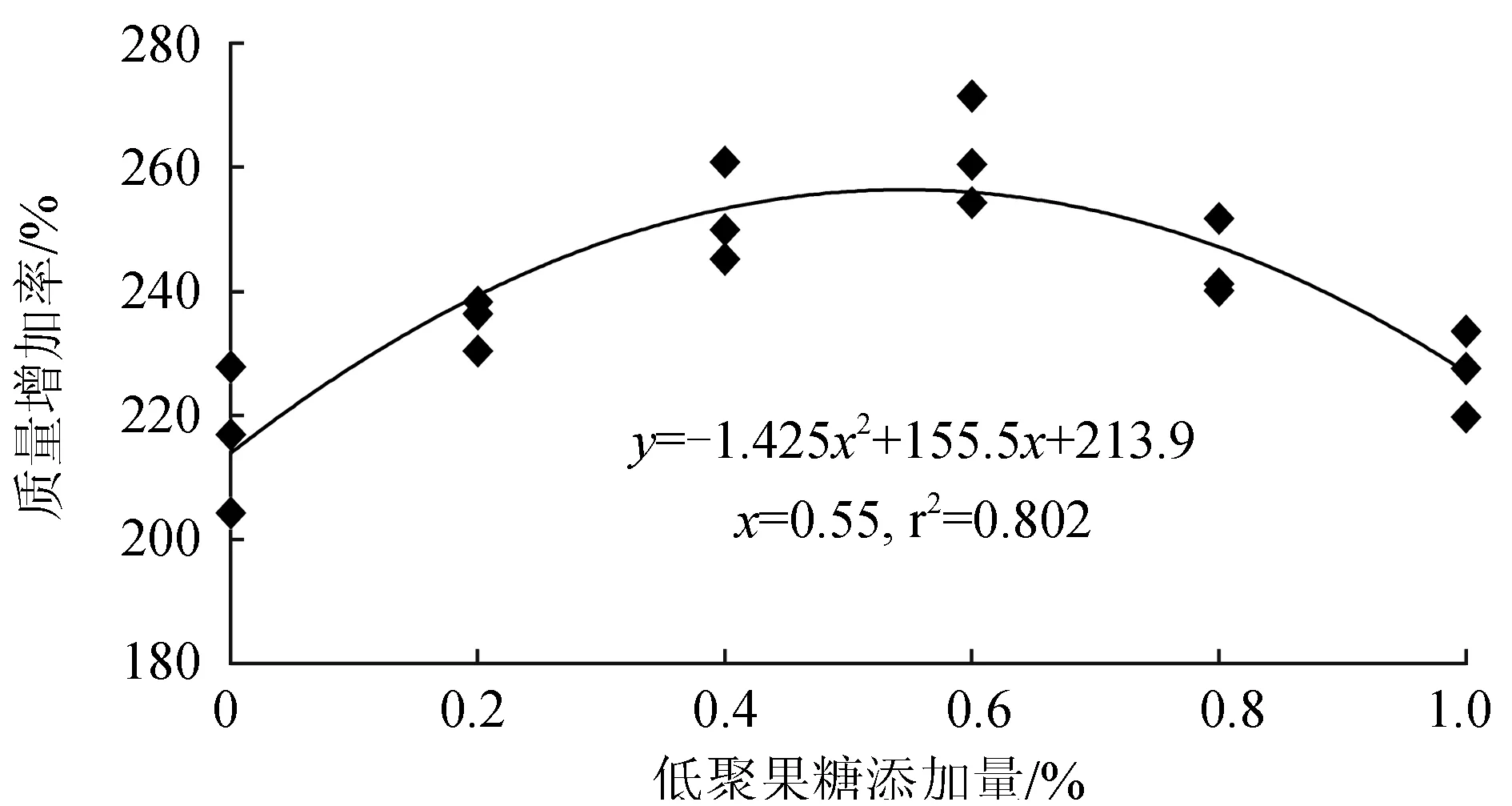
图1 仿刺参质量增加率与饲料低聚果糖含量的曲线回归分析
低聚果糖对仿刺参阶段性生长的影响见表3。由表3可见,对照组、0.20%试验组仿刺参前6周生长无显著差异,显著低于其他各组,其他各组之间无显著差异;试验6~10周,0.20%试验组仿刺参质量增加显著高于对照组,但仍低于其他组;试验10周后,1.00%组仿刺参质量增加率下降,12周时与0.20%试验组无显著差异,14周时与对照组、0.20%组均无显著差异。
以体质量与养殖时间对仿刺参生长速率进行回归,仿刺参的生长速率符合一元二次曲线,且随着低聚果糖添加量的增加,曲率逐渐降低;以△增加质量与养殖时间对仿刺参生长速率进行回归,对照组,0.20%~0.60%试验组仿刺参生长速率符合对数函数曲线,0.80%、1.00%试验组仿刺参生长速率符合一元二次曲线,且曲率均为负值(表4)。
2.2 低聚果糖对仿刺参体壁成分的影响
低聚果糖对仿刺参体壁成分的影响见表5。由表5可见,低聚果糖对仿刺参体壁水分和粗脂肪含量无显著影响,粗蛋白及粗灰分含量有升高的趋势,但差异不显著(P>0.05),总糖含量随饲料低聚果糖含量的增加而增加,1.00%试验组比对照组含量提高了11.58%和29.27%(P<0.05)。

表3 低聚果糖对仿刺参阶段性生长的影响 g

表4 低聚果糖对仿刺参生长速率的影响
注:ym为每次取样时仿刺参的体质量,xt为养殖时间,y△m为每次取样时仿刺参的质量增加量.

表5 低聚果糖对仿刺参体壁基本成分的影响 %
注:*粗蛋白、粗脂肪、粗灰分及总糖均为干基含量.
低聚果糖对仿刺参体壁氨基酸的影响见表6。由表6可见,仿刺参体壁中甘氨酸、半胱氨酸及精氨酸随低聚果糖含量的增加均呈先升后降的趋势,分别在0.60%、0.80%、0.60%组达到最高,显著高于对照组(P<0.05);谷氨酸含量随低聚果糖含量的升高呈先升高后平稳的趋势;饲料添加低聚果糖对仿刺参体壁其他氨基酸及总氨基酸含量无显著影响(P>0.05)。
2.3 低聚果糖对仿刺参生长免疫因子的影响
低聚果糖对仿刺参生长免疫因子的影响见表7。由表7可见,体腔液中生长激素、补体C3、补体C4及一氧化氮合酶含量均随低聚果糖的升高呈先升后降的趋势,但肠道丙酮酸激酶和己糖激酶活力随低聚果糖的升高而升高(P<0.05)。

表6 低聚果糖对仿刺参体壁氨基酸含量的影响 %
注:*为必需氨基酸.
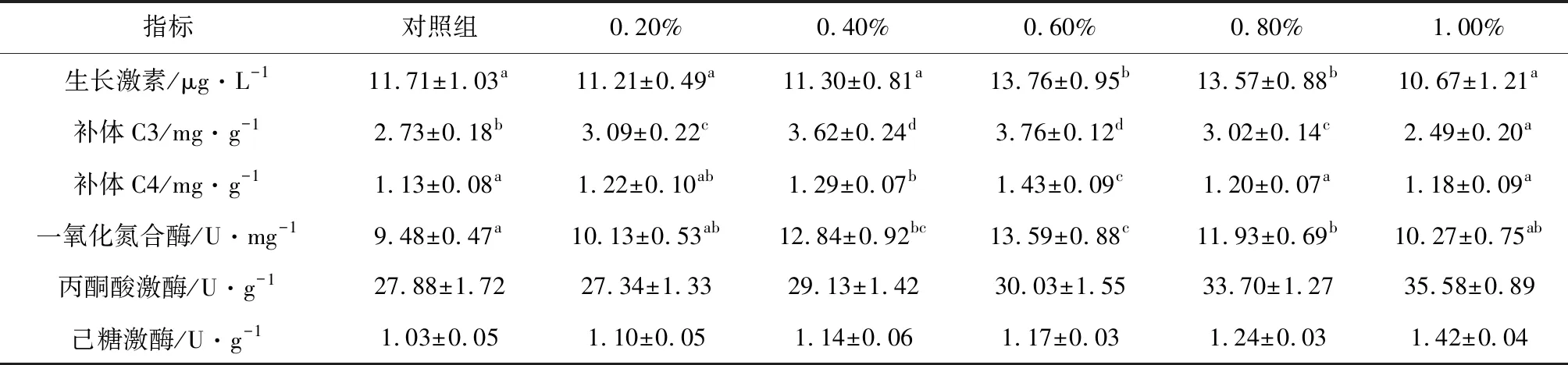
表7 低聚果糖对仿刺参生长免疫因子的影响
3 讨 论
3.1 饲料中添加低聚果糖对仿刺参生长的影响
低聚糖是一种新型功能性糖源,目前已被广泛应用于食品、保健品、饮料、医药、饲料添加剂等领域[15]。低聚糖主要分为两类:一类为普通低聚糖,具有易消化、低甜度、低渗透特性,可延长供能时间,增强肌体耐力,抗疲劳,如蔗糖、乳糖等;另一类为功能性低聚糖,这类糖进入大肠作为双歧杆菌的增殖因子,能有效地促进双歧杆菌的生长繁殖,抑制腐败菌生长[16],如低聚果糖、壳寡糖、低聚木糖等。功能性低聚糖是典型的益生元,其中壳寡糖和低聚木糖已被广泛应用于水产饲料中,并取得了较好的应用效果[17-19]。本试验中,添加低聚果糖显著提高了仿刺参的生长性能,与窄爪小龙虾(Astacusleptodactylusleptodactylus)[20]和奥尼罗非鱼[21]的研究结果一致。与壳寡糖和低聚木糖类似[12-13],低聚果糖促进仿刺参生长的机理与其增殖肠道双歧杆菌、促进肠道蠕动、促进矿物元素吸收等功能有关。本试验中,仿刺参的生长与饲料中低聚果糖的含量呈现显著的剂量反应效应,当低聚果糖添加量过低(≤0.20%)或过高(≥0.80%)时,仿刺参质量增加率均低于中间添加量组(0.20%~0.80%)。从生长速率分析,随着低聚果糖添加量的增加,仿刺参的生长速率逐渐降低,尤其是0.80%及1.00%试验组的生长速率趋于0甚至是负值,表明二者后期仿刺参的生长速度低于不添加组。Shiau等[22]报道了饲料中添加壳寡糖(≥2.00%)会抑制奥尼罗非鱼生长;而黄燕华等[23]研究表明,凡纳滨对虾(Litopenaeusvannamei)的质量增加率与饲料中低聚木糖含量(≤0.05%)呈正相关。有研究报道,低聚糖类能吸附金属离子[24],与蛋白质、脂类等结合[25],过量添加会直接阻碍机体对营养物质的吸收。由此可见,功能性低聚糖类在水产饲料中的应用需严格控制添加量。
3.2 饲料中添加低聚果糖对仿刺参体壁基本成分的影响
本试验中,仿刺参体壁基本成分含量未受低聚果糖含量的影响,但Barbara等[26]研究表明,低聚果糖降低了大西洋鲑(Salmosalar)全鱼粗蛋白含量。这可能与养殖动物的食性、低聚果糖添加量、养殖时间等有关。同时有研究表明,添加壳寡糖或低聚木糖等功能性低聚糖,对仿刺参[12]、大菱鲆[27]、奥尼罗非鱼[28]的体成分均无显著影响。本试验中,仿刺参体壁粗灰分含量有升高的趋势,与饲料中低聚果糖促进钙的吸收有关[4],未达显著水平,可能与仿刺参生长环境中钙离子含量较为丰富有关。低聚果糖显著提高了仿刺参体壁中总糖的含量,与白阳[14]的研究中壳寡糖能提高仿刺参体壁中总糖含量的结果类似。
本试验中,低聚果糖提高了仿刺参体壁中谷氨酸、甘氨酸、半胱氨酸和精氨酸的含量。目前尚无关于低聚果糖改变机体氨基酸组成的报道,但白阳[14]的研究表明,壳寡糖可显著提高仿刺参体壁中胶原蛋白的含量,而甘氨酸和谷氨酸含量分别占仿刺参胶原蛋白中总氨基酸含量的1/3和1/10[29],因此本试验中仿刺参体壁中甘氨酸和谷氨酸含量的增加,可能是低聚果糖增加了仿刺参体壁胶原蛋白的含量所致。
3.3 饲料中添加低聚果糖对仿刺参生长免疫因子的影响
生长激素是机体内最重要的神经内分泌激素,在代谢和促生长方面发挥着重要作用[30],能调节水生动物的渗透压[31]。目前在棘皮动物中尚未见关于生长激素的相关报道,但Matthew等[32]在仿刺参体内已发现促甲状腺激素释放激素、促肾上腺皮质激素释放素等激素的前体,预示着仿刺参体内存在着内分泌系统。本试验的仿刺参体腔液中生长激素含量与褐牙鲆(Paralichthysolivaceus)血浆中生长激素含量[31]相差无几,但仿刺参体腔液处于开放的循环系统中,其激素的分泌与调控值得深入研究。
目前已经证实仿刺参体内存在补体系统[33],且补体活力的大小与其疾病抵抗能力密切相关[34]。本试验中所测得仿刺参体腔液中补体C3和补体C4含量显著低于中华鳖(Pelodiscussinensis)[35]和团头鲂(Megalobramaamblycephala)[36],这与试验动物与测定方法的不同有关。仿刺参体腔液中补体C3及补体C4与低聚果糖均存在剂量反应效应,说明低聚果糖能通过激活补体系统,提高仿刺参的免疫能力。
一氧化氮合酶是催化L-精氨酸裂解成L-瓜氨酸和一氧化氮的酶,是仿刺参体内重要的免疫指标之一[14,37]。本试验中,一氧化氮合酶活力随低聚果糖添加量的增加呈先升后降的趋势,说明低聚果糖对仿刺参的免疫有刺激作用。仿刺参体腔细胞体外试验表明,褐藻寡糖可提升一氧化氮合酶活力[38];但低聚果糖可增殖机体内双歧杆菌,而双歧杆菌可引起整体免疫应答的特异抗原、影响肠道黏膜免疫细胞群的数量及分布[39]。因此,不同寡糖类物质提高机体免疫能力的机理可能存在差异。
丙酮酸激酶和己糖激酶是生物体糖代谢的关键酶,二者活力升高表明机体糖代谢活跃。本试验中,仿刺参肠道丙酮酸激酶和己糖激酶活力均随低聚果糖含量的增加而增大,表明低聚果糖的添加促进了仿刺参体内糖代谢。低聚果糖是由果糖基通过β(2-1)糖苷键与蔗糖中的果糖基结合生成的寡糖,从结构与生理功能分析,其促进糖代谢的原因可能有两方面:(1)仿刺参体内存在β(2-1)糖苷键水解酶,可直接利用低聚果糖;(2)低聚果糖通过增殖体内有益菌群,产生糖类代谢物,促进体内糖代谢。通常来讲,生物体内缺乏β(2-1)糖苷键水解酶,因此低聚果糖促进仿刺参糖代谢的原因更倾向于后者,但目前尚缺乏直接证据。
4 结 论
饲料中添加适量的低聚果糖可以促进仿刺参生长,提高体壁总糖含量,增强机体免疫能力。以质量增加率为评价指标,仿刺参饲料中低聚果糖适宜添加量为0.55%。
