肿瘤标志物在恶性胸水中的诊断价值探讨
2019-03-29陈聪李再清通讯作者刘卫庭
陈聪 李再清(通讯作者) 刘卫庭
(南华大学附属邵阳市中心医院呼吸内科 湖南 邵阳 422000)
恶性胸腔积液临床诊断相对容易,但病理确诊困难,这主要依赖于胸腔镜胸膜活检[1]。胸膜活检为有创操作,因此,寻找一种特异度和敏感度均较高且简便有效的试验检测方法对恶性胸腔积液的诊断显得非常重要。
1.资料与方法
1.1 一般资料
选择2017年1月—2018年1月邵阳市中心医院呼吸内科有中量以上胸腔积液患者80例,其中有57名男性和23名女性,平均年龄(50.3±20.6)岁。根据2010英国胸科学会内科胸腔镜指南所有的风险都被评估,所有的禁忌症患者被排除在外[2],在接受检查前,患者及家属均签署知情同意书并通过邵阳市中心医院伦理委员会审查同意。
1.2 研究方法
1.2.1 仪器 Olympus BF TYPE P150 电子支气管镜;一次性气管切开导管(苏嘉公司生产);一次性活检钳(江苏省常州洛克曼医疗器械有限公司,型号:LMFB-18-105-I);胸腔闭式引流管、引流瓶;多肿瘤标志物检测试剂盒(流式荧光发光法),luminex多功能流点式点阵仪(上海透景生命科技股份有限公司)。
1.2.2 研究方法 住院后完善血常规、凝血功能、输血前常规、血清肿瘤标志物(癌胚抗原、细胞角蛋白19片段、神经元特异性烯醇化酶)、肺部CT等检查。使用气管切开导管为胸壁套管行气管镜代胸腔镜进行内科胸腔镜检查具体操作方法:患者健侧卧位,选择患侧腋前线与腋后线4~8肋间为手术部位,包裹性积液则选取B超定位点为手术点。将胸腔闭式引流管套入气切导管内。沿肋间隙切开皮肤1~1.5cm,钝性分离皮下组织、肌肉达壁层胸膜,以胸腔闭式引流管穿刺达到胸膜腔后,引导插入气切导管,拔出胸腔闭式引流管,将电子支气管镜插入气切导管内,调节套管方向及深度,可进行各部位胸膜的观察。用一次性活检钳取病变组织送病理检查,取材部位为壁层胸膜或膈胸膜,然后拔出套管,沿切口置入胸腔引流管,同时外接水封瓶进行闭式引流。并留取胸水标本进行癌胚抗原、细胞角蛋白19片段、神经元特异性烯醇化酶检测。
1.3 观察指标
所有患者的胸水以及血清中癌胚抗原、细胞角蛋白19片段、神经元特异性烯醇化酶检测的绝对值。
1.4 统计学处理
应用SPSS20.0软件对数据进行统计处理,计量资料以均数±标准差(±s)表示,组间比较采用t检验,计数资料比较采用χ2检验,检验水准α=0.05。P<0.05,表示差异有统计学意义。应用受试者工作特征(receiver operating characteristic curve,ROC)曲线,做出 CEA、CYFRA-21、NSE的ROC曲线;联合诊断的ROC曲线通过建立logistic回归模型,根据模型中的概率值拟合完成。
2.结果
2.1 80 例胸腔积液患者支气管镜代胸腔镜检查顺利完成,无不良反应,最后诊断恶性胸腔积液的为28例,良性胸腔积液(结核性胸膜炎)的为48例,4例无法确诊。其中恶性胸腔积液据WHO关于肺癌组织分类法分为腺癌17例、鳞癌 10例、间皮瘤1例。
2.2 确诊为恶性胸腔积液的28例患者中,三项肿瘤标志物检测平均值远高于正常值,而良性胸腔积液组多低于正常值。恶性胸腔积液组中癌胚抗原、细胞角蛋白19片段、神经元特异性烯醇化酶3种肿瘤标志物平均水平与良性胸腔积液组比较,差别均有统计学意义(P<0.05)(见表1)。恶性胸腔积液组胸水中的癌胚抗原、细胞角蛋白19、神经元特异性烯醇化酶三种肿瘤标志物平均水平显著高于该组血清中的三种肿癌标志物(P<0.05),见(表2)。
2.3 CEA、CYFRA-21、NSE及CEA+CYFRA-21+NSE诊断恶性胸腔积液的ROC 曲线分析及比较ROC曲线越靠近左上角,表明其诊断价值越大(图1)。CEA、CYFRA-21、NSE及CEA+CYFRA-21+NSE诊断恶性胸腔积液患者的曲线下面积分别为0.890、0.873、0.654、0.948,四者比较差异均有统计学意义(P<0.05),图1。
表1 两组CEA、CYFRA-21、NSE三项指标比较 (±s)
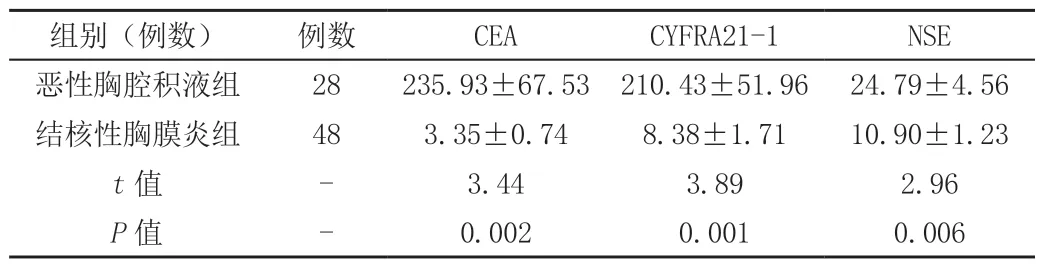
表1 两组CEA、CYFRA-21、NSE三项指标比较 (±s)
组别(例数) 例数 CEA CYFRA21-1 NSE恶性胸腔积液组 28 235.93±67.53 210.43±51.96 24.79±4.56结核性胸膜炎组 48 3.35±0.74 8.38±1.71 10.90±1.23 t值 - 3.44 3.89 2.96 P值 - 0.002 0.001 0.006
表2 恶性胸腔积液组中胸水和血清中CEA、CYFRA-21、NSE比较 (±s)
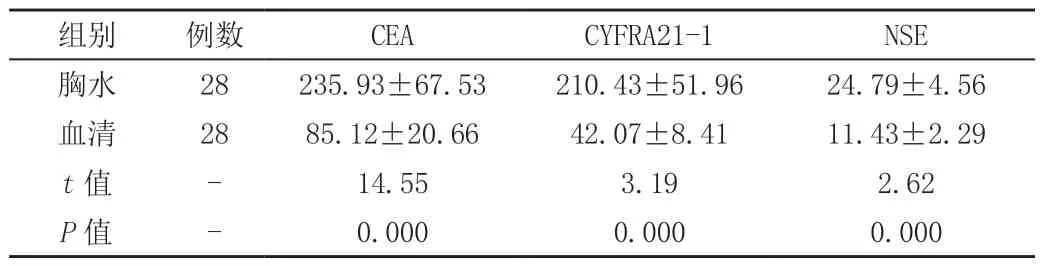
表2 恶性胸腔积液组中胸水和血清中CEA、CYFRA-21、NSE比较 (±s)
组别 例数 CEA CYFRA21-1 NSE胸水 28 235.93±67.53 210.43±51.96 24.79±4.56血清 28 85.12±20.66 42.07±8.41 11.43±2.29 t值 - 14.55 3.19 2.62 P值 - 0.000 0.000 0.000

图1 CEA、CYFRA21-1、NSE及三项指标联合的ROC曲线图
3.讨论
恶性胸腔积液的诊断主要依靠临床表现、影像学检查、胸水常规生化推断,其确诊依赖于胸腔镜活检后病理检查,支气管镜代胸腔镜检查为有创操作,部分病人不能耐受。
癌胚抗原(CEA)一种广谱肿瘤标志物,对肺癌有较高的敏感性和特异性。恶性胸水中的肿瘤细胞释放癌胚抗原进入胸水后,有助于恶性胸水的诊断[3]。细胞角蛋白19片段(CYFRA21-1)目前被认为是检测肺鳞癌的首选肿瘤标志物[4],主要存在于单层和复层上皮肿瘤细胞的胞质中,细胞溶解时血清中细胞角蛋白19片段含量升高,一般是鳞癌高于腺癌。神经元特异性烯醇化酶(NSE)是神经元、神经内分泌细胞所独有的一种酸性蛋白,对小细胞肺癌的诊断具有较高的敏感性和特异性[5]。
胸腔镜下胸膜活检是确诊恶性胸腔积液的金标准,目前大部分的支气管镜代胸腔镜行胸腔检查时,多采用的是套管针或直接用气管插管作为引导管,操作时往往存在镜体操作不灵活、易损伤镜体、密闭性差等缺点[6]。本研究为邵阳市中心医院呼吸内科自创使用气管切开导管为胸壁套管行气管镜代胸腔镜进行内科胸腔镜检查,具有便于定位,减少视野盲区,有利于活检,增加标本阳性率的应用价值[7]。
检测胸水中癌胚抗原、细胞角蛋白19片段、神经元特异性烯醇化酶等对良恶性胸水的鉴别诊断有重要价值,通过ROC曲线分析发现诊断价值最高的为癌胚抗原(89.0%),三项联合检测则诊断价值达到94.8%(图1)。这与其它文献报道基本相符[8],提示在胸水中行肿瘤标志物检查对良恶性胸水的鉴别有意义。且在胸水中进行肿瘤标志物的联合检测比在血清中检测有更重要的意义。另外在非恶性胸腔积液中发现4例肿瘤标志物阳性的患者,考虑与炎性反应相关。恶性胸腔积液组中胸水肿瘤标志物的平均水平明显高于血清组,考虑是因为恶性肿瘤侵犯胸膜,癌细胞释放肿瘤标志物蓄积在胸腔内,不能被带至肝脏代谢和灭活,因而胸腔内浓度高于血清,本文研究结果也与有关研究结果大致相同[9]。本研究也有不足之处,比如胸腔积液病人的入组数量相对较少,所检查出来的病理分型可能与流行病学有所差异。另外小细胞癌患者未发现胸膜转移。
通过本文研究,一次性气管切开导管作为胸腔套管在支气管镜代胸腔镜检查中具有可行性。对于不明原因的胸腔积液,在胸水中联合检测癌胚抗原、细胞角蛋白19、神经元烯醇化酶对良恶性胸水的鉴别诊断有意义。胸水中肿瘤标志物的检测在单检和联检中均优于血清。
