超声波联合一磷酸腺苷(AMP)处理 对鹅胸肉的嫩化效果
2019-03-28,,,,*,,*,,,
, , , ,*,,*,,,
(1.江苏省农业科学院农产品加工所,江苏南京 210014; 2.南京财经大学食品科学与工程学院,江苏南京 210046; 3.江苏省肉类生产与加工质量安全控制协同创新中心,江苏南京 210095; 4.徐州汉戌堂食品有限公司,江苏徐州 221600)
鹅肉营养价值丰富,肉质鲜美,不仅具有高蛋白、低脂肪和胆固醇含量低等特点[1],而且富含亚油酸等多种不饱和脂肪酸[2],蛋白质含量稍高于同为禽类的鸡鸭等,且其所含各种氨基酸组成接近人体所需氨基酸比例,有较好的吸收消化率[3],具有食药两用功能,因此深受消费者喜爱。但是鹅肉肌原纤维较粗,肌纤维间多覆有结缔组织[4],肌肉硬度大且保水性差,肉质粗老不易咀嚼,发展适宜的鹅肉嫩化处理技术具有重要现实意义。
目前,关于改善肉品品质方法研究较多,主要包括物理法[5-6]、化学法[7-8]、生物法[9-10],其中物理方法简单安全,实践应用最广,但可选的方法较少。超声嫩化是90年代提出的一种与其它的肉类嫩化原理不同的全新嫩化技术,现普遍认为其空化效应、热效应和机械作用是超声技术三大理论依据,“声耦”作用使肉产生振动,致使肌肉结构破坏,快速嫩化肉品[11]。Lyng等[12]、Chemat等[13]均发现超声波可用于提高肉品嫩度。近年来,国内也有关于超声波对肉品嫩度影响的研究[14-15],结果均表明,超声波对肌肉有显著嫩化作用。AMP(5′-Adenosine monophosphate)在食品加工中通常作为畜禽肉类的风味改性剂或食品添加剂,近年来被证实适当的添加有助于肌肉快速解僵,嫩化效果明显[16-17]。目前,超声波与其它嫩化方法共同作用的复合嫩化法效果较好,应用较广,且超声效应可促进AMP在肉品中的渗透[18],猜想超声波与AMP联合使用,可用于嫩化禽肉且能适当减小超声处理功率、时间以及AMP腌制时间,达到效率高且绿色环保的目的,但目前没有关于AMP与超声波联合嫩化肉品的相关报道。
因此本研究分别对超声波处理、AMP腌制以及超声波联合AMP处理鹅胸肉的剪切力、组织切片以及提取的肌动球蛋白的同步荧光光谱、差式量热扫描热流曲线等特性指标进行分析,研究超声波处理、AMP腌制以及超声波联合AMP处理对鹅胸肉的嫩化效果,进一步明确超声波与AMP联合嫩化鹅胸肉的方法是否具有可行性及优势,为深入了解肉品嫩化机制、改善肉品品质及开发高效绿色环保的肉品嫩化方法提供新思路和理论基础。
1 材料与方法
1.1 材料与仪器
扬州鹅 常州市阳湖养鹅业专业合作社;一磷酸腺苷(Adenosine 5′-Monophosphate,AMP) 美国Sigma公司;预染宽范围标准蛋白 加拿大Fermentas公司,其他试剂 均为分析纯。
SCIENTZ-IID超声波细胞破碎仪 宁波新芝生物科技股份有限公司;T-25型数显匀浆机 德国IKA公司;UniCenMR冷冻离心机 德国Herolab公司;TVT-300XP质构仪 瑞典泰沃公司;Gen5多功能酶标仪 美国Biotek仪器有限公司;CHRIST冷冻干燥机 德国Christ公司;Q20差式量热扫描仪 美国TA公司;Mini-PROTEAN Tetra Cell垂直电泳系统 美国Bio-Rad公司;Nikon Eclipse E100正置光学显微镜 日本尼康;NIKON DS-U3成像系统 日本尼康;EVO-LS10扫描电镜 德国Zeisse Oberkochen公司。
1.2 实验方法
1.2.1 样品处理 随机选取90日龄左右大小相近的健康扬州鹅,取鹅胸大肌,去除表面肌膜。选取大小、薄厚相近的鹅胸肉,切成5 cm×5 cm×2 cm的肉块(50±5)g,从中随机选取25块分别做以下处理:第一组不做任何处理放置30 min(4 ℃)作为对照组,标记为C;第二组经32 mmol·L-1AMP腌制30 min,标记为A;第三组超声波处理(功率:300 W,时间:5 min)后经去离子水腌制25 min,标记为U;第四组则先经超声波处理(同第三组)后用32 mmol·L-1AMP腌制25 min,标记为A+U。每组处理做三个平行。
1.2.2 蒸煮损失的测定 鹅胸肉块(50±5) g用滤纸吸干表面水分后称重,记录蒸煮前肉块质量m1。然后将肉块置于5号自封袋(10 cm×15 cm)中,将数显温度计插入肉块中央[19]。在95 ℃水浴锅中加热至中心温度75 ℃,立即取出流水冲至室温,再次用滤纸吸干表面水分后称重,记录蒸煮后肉块质量m2[3]。根据蒸煮前后肉块重量代入下列公式(1)计算得出肉块蒸煮损失。
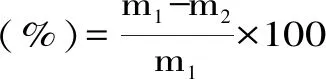
式(1)
1.2.3 剪切力的测定 测定鹅胸肉块剪切力:将上述蒸煮后的肉块用手术刀和直尺沿肌纤维方向切割成3 cm×1 cm×1 cm大小肉条,使用质构仪连接的刀片式探头(Razor-Blade Shear),垂直肌纤维的方向进行剪切,测定其剪切力变化曲线,记录最大剪切力值[20],多次测量取平均值。剪切力测定参数设定为:预试速度:10 mm/s;测试速度:2 mm/s;测后速度:10 mm/s;距离:30 mm;触发力:50 g。
1.2.4 肌原纤维小片化指数(MFI)测定 参考Culler等[21]的方法测定MFI:称取2 g肉糜,加入20 mL MFI提取缓冲液(0.1 mol·L-1KCl,l mmol·L-1NaN3,7 mmol·L-1KH2PO4,18 mmol·L-1K2HPO4,1 mmol·L-1MgCl2,1 mmol·L-1EGTA,pH7.0,4 ℃),冰浴均质(12000 r/min,30 s,2次,中间间隔10 s),冷冻离心(12000×g,15 min,4 ℃),弃上清,沉淀加20 mL MFI提取缓冲液,再次离心(同上),弃上清,沉淀加15 mL MFI提取缓冲液,搅匀,经两层纱布过滤,滤液即为肌原纤维蛋白(Myofibrillar protein,MP)溶液。MP溶液用考马斯亮蓝试剂盒测定蛋白浓度,用MFI提取缓冲液调节MP浓度为0.5 mg/mL,将稀释的MP溶液摇匀,立即用紫外分光光度计测定其在 540 nm处吸光度值,测定三次取平均值,所得吸光度乘以200后,即为MFI值。
1.2.5 肌动球蛋白的提取 参考Okitani等[21-22]的方法提取肌动球蛋白:每个样品取2 g肉样,加入20 mL Weber溶液(0.6 mol·L-1KCl,0.04 mol·L-1NaHCO3,0.01 mol·L-1Na2CO3,pH7.2),冰浴匀浆(12000 r/min,30 s/次,重复2次,中间间隔10 s)。匀浆液置于摇床振荡24 h(200 r/min,4 ℃),用两层纱布过滤除去不溶物质。每10 mL滤液中加入20 mL超纯水稀释,调整滤液中 KCl浓度为0.2 mol·L-1,再次于摇床(同上)振荡1 h后,离心(4 ℃,15000×g,20 min),上清液即为游离肌动蛋白溶液。将沉淀溶解于KCl-Tris溶液(0.6 mol·L-1KCl,0.02 mol·L-1Tris-HCl,pH7.2)中,即为肌动球蛋白溶液。
部分肌动球蛋白溶液冷冻干燥(-50 ℃,真空度0.070 Pa,24 h)处理,用于扫描电镜分析。剩余肌动球蛋白溶液用KCl-Tris溶液稀释到蛋白浓度1.0 mg/mL,用于相关实验。
1.2.6 SDS-PAGE电泳分析 0.2 mL提取的肌动球蛋白溶液中加入0.4 mL上样缓冲液后于95 ℃加热5 min灭酶,离心(12000×g,5 min)取上清用于SDS-PAGE。采用变性不连续电泳,12%分离胶[总体积4 mL,H2O 1.32 mL,Acr/Bis(30%)1.60 mL,1.5 mol/L Tris-HCl(pH8.8)1.0 mL,SDS(30%)40 μL,AP(10%)40 μL,TEMED 1.6 μL],5%浓缩胶[总体积2 mL,H2O 1.36 mL,Acr/Bis(30%)0.33 mL,1.0 M Tris-HCl(pH6.8)0.25 mL,SDS(30%)20 μL,AP(10%)20 μL,TEMED 2.0 μL]0.1 mL(m(丙烯酰胺)∶m(甲叉双丙烯酰胺)=36.5∶1)。每孔等体积上样20 μL,200 V恒压约50 min。凝胶块用考马斯亮蓝染色液染色10 min后取出,加入适量的脱色液,脱色时放在摇床上使脱色更为均匀迅速,1 h后更换脱色液,直至脱色完成,用凝胶成像仪对胶块进行成像分析,并用ImageJ软件扫描条带,得出光密度值用于数据分析。
1.2.7 鹅胸肉组织切片分析 将1.2.1中经过处理的鸡胸肉样切成5 mm厚的小块,用3%的戊二醛固定后做石蜡切片,然后将石蜡切片脱蜡后先后用苏木精-伊红染色(HE染色法),之后脱水封片,经正置光显微镜镜检,采集图像进行分析。每个样品做三个重复。
1.2.8 超微结构分析 鹅胸肉样的微观结构用扫描电镜(Scanning electron microscopy,SEM)测定。将处理好的肉样切成5 mm×2 mm×2 mm小块,用3%戊二醛固定,喷金镀膜后SEM观察样品超微结构。
1.2.9 圆二色谱(CD)分析 蛋白质的二级结构可采用圆二色谱仪进行表征。调节肌动球蛋白浓度为0.1 mg·mL-1,参比溶液为KCl-Tris溶液,使用1 mm石英比色皿,扫描范围设定为190~250 nm,布阶为0.5 nm,对肌动球蛋白溶液进行扫描。扫描结束后使用圆二色谱仪软件输入样品蛋白浓度,计算生成样品蛋白二级结构比例,用于统计分析。
1.2.10 同步荧光光谱分析 用荧光分光光度计通过改变发射波长λem和激发波长λex之间的波长差Δλ,使λem=λem+Δλ,得到肌动球蛋白溶液中色氨酸残基和酪氨酸残基的同步荧光光谱图。在发射波长245~350 nm,Δλ=60 nm时测定色氨酸基团的同步荧光光谱图;在发射波长265~350 nm,Δλ=15 nm时测定酪氨酸基团的同步荧光光谱图。
1.2.11 热力学性质变化分析 以差式扫描量热仪(DSC)测定样品TG/DSC曲线,由变性温度表征蛋白质样品的热稳定性。铝坩埚中放入12 mg 左右的鹅胸肉样品。温度范围25~105 ℃,升温速率5 ℃/min测定其TG/DSC曲线。通过TA Universal Analysis 软件对热变曲线中的峰处理以得到峰值温度(Tm),并对其面积积分后得出焓变(ΔH)。
1.3 数据分析
采用Excel软件统计数据。用SPSS 18.0进行单因素方差分析和相关性分析。分析统计图使用Origin 8.0绘制。
2 结果与分析
2.1 鸡胸肉蒸煮损失和剪切力变化分析
图1显示,与未处理组相比,单独超声波处理和AMP腌制均可降低鹅胸肉的剪切力和蒸煮损失,说明超声处理和AMP腌制均可嫩化鹅胸肉,但超声处理与AMP腌制组之间的剪切力和蒸煮损失无显著性差异(p>0.05)。经超声波和AMP联合处理的鹅胸肉的蒸煮损失和剪切力与其他三组相比均显著减小(p<0.05),说明联合处理组鹅胸肉系水力最好且联合处理方法嫩化效果最佳。这是因为超声波的机械效应和空化效应等破坏了细胞结构,肌原纤维结构被破坏,释放出大量盐溶性蛋白、肌浆蛋白和嫩化酶等,且在一定程度上促进了盐溶性蛋白向肉块表面富集[23-25],对肉的嫩化和系水力起到促进作用,显著改善肉品嫩度,同时降低肉品蒸煮损失,从而提高了肉品品质。

图1 超声波和AMP联合处理 对鹅胸肉剪切力和蒸煮损失的影响Fig.1 Effects of ultrasound combined AMP on shear force and cooking loss of goose breast meat
2.2 鹅胸肉MFI分析
MFI是表征肉品嫩度的重要指标,是表现肌原纤维断裂程度的参数[26],MFI值与肌原纤维断裂程度及肉品嫩度成正比,与剪切力值的变化息息相关[27]。如图2所示,与对照组相比,除了AMP组外,其他两组的MFI显著低于对照组(p<0.05),说明超声波和A+U联合处理都能显著提高鹅胸肉的嫩度。
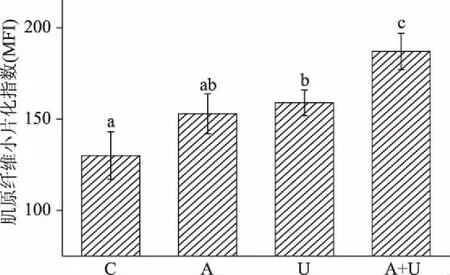
图2 超声波和AMP联合处理对鹅胸肉MFI的影响Fig.2 Effects of ultrasound combined AMP on MFI of goose breast meat
而联合嫩化组的MFI值则显著大于其它组(p<0.05),说明联合嫩化效果显著优于AMP腌制、超声波单独处理组。这是因为:一方面,超声波具有空化效应和较强的穿透力,严重破坏肌原纤维和结缔组织等,肌纤维断裂为肌节小片,MFI增大;另一方面,AMP处理过程中,AMP可结合肌球蛋白的某些结合位点形成复合物,从而促使肌球蛋白和肌动蛋白之间的连接键断裂,造成肌动球蛋白的解离,肌原纤维由完整结构变为肌节小片,肌肉舒张[28]。此外,联合嫩化组中超声波和AMP相互促进了彼此的作用效果,致使MFI增加,剪切力变小,与2.1结论相符。
2.3 肌动球蛋白SDS-PAGE电泳分析
图3A和3B为不同处理后鹅胸肉中肌动球蛋白的SDS-PAGE电泳图及其光密度分析得到的肌动蛋白相对含量图。由图3A可看出,不同处理组之间肌动蛋白条带深浅不同,变化明显。AMP和超声波联合处理组肌动蛋白含量最高,且与其它三组差异显著(p<0.05),超声波处理组和AMP处理组与对照组和联合处理组均差异显著(p<0.05),但其两者之间肌动蛋白含量无显著性差异(p>0.05)。这是由于超声波处理联合AMP腌制可加快破坏细胞结构,释放组织蛋白酶和钙蛋白酶,加速肌动球蛋白降解,导致大量肌动蛋白游离出来[29],对嫩化肌肉、缩短宰后僵直期有显著效果,这也与以上2.1中肉品剪切力及2.2肉品的MFI等指标的结论相符。
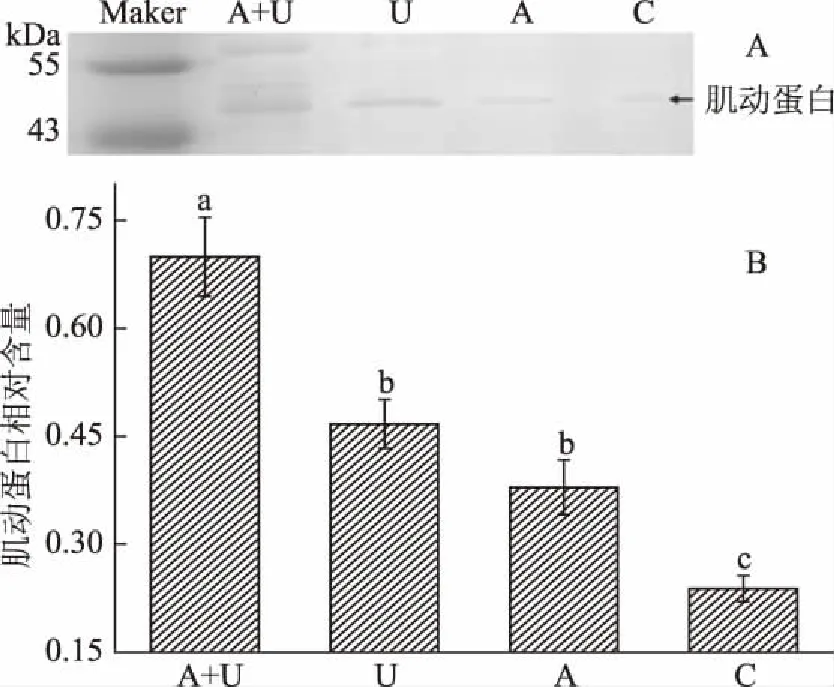
图3 鹅胸肉肌动球蛋白的SDS-PAGE图和定量分析图Fig.3 Sodium dodecyl sulfate-gel electrophoresis patterns and quantity analysis of actomyosin in goose
2.4 鹅胸肉组织切片分析
肌肉组织学性状与肌肉嫩度、pH和质地等密切相关[30],且肌纤维的大小对肌肉的嫩度和咀嚼性、质地等有直接作用[31]。图4为不同嫩化方式处理后的鹅胸肉组织学图像,包括鹅胸肉组织纵切和横切图像。由图可知,对照组具有形状和大小较为一致的圆柱形肌纤维,肌原纤维束完整且排列紧密,而其它三个处理组的肌原纤维结构均产生一定程度的破坏,并观察到部分释放的内容物和破碎的肌原纤维,同时发现纤维间间隔增大且不均匀,导致肌纤维结构不再完整,断裂为大小不一的碎片,另外纤维内部出现明显空隙间隔。超声波的空化效应引起肌纤维沿着肌肉组织Z线断裂,同时造成组织内容物包括内源酶的释放,

图4 不同处理组的鹅胸肉组织切片图 Fig.4 Histofram of goose breast meat from different treatments
这也增强了组织蛋白酶的活性,促进肌纤维结构进一步被破坏[32-33]。AMP作为三磷酸腺苷即ATP的分解产物,能与肌原纤维蛋白中的肌动球蛋白产生特异性反应,促进肌动球蛋白解离,破坏肌原纤维结构,当宰后肉品添加AMP进行腌制处理时,AMP对肉品的嫩化作用更为明显,这也合理解释了超声波与AMP联合处理组的纤维断裂程度最显著,肌原纤维破碎明显且纤维间空隙多且明显,其次,超声波处理组、AMP腌制组也出现肌纤维的较显著断裂。这也证实了上述MFI的结论。肌纤维结构破碎和纤维间间隔变大能显著促进肉类嫩化,肉品具有更好的食用效果。
2.5 鹅胸肉肌动球蛋白超微结构分析
通过SEM拍摄到不同处理的鹅胸肉肌动球蛋白的超微结构如图5所示。图中对照组C肌动球蛋白结构致密、完整且相互之间基本没有空隙、孔洞,且蛋白颗粒较其它组明显偏大。图中A(即AMP腌制组)与U(即超声波处理组)显示蛋白排列由致密趋向松散,且蛋白间出现较大空隙,蛋白颗粒减小,可能是超声波的“机械效应”、“空化效应”和AMP的化学作用破坏了蛋白间的致密结构,部分蛋白连接件遭到破坏而断裂,部分肌动球蛋白解离为较小分子的蛋白[34-35]。A+U复合处理组显示肌动球蛋白间的致密连接遭到严重破坏,可能导致大分子的肌动球蛋白分解成为小分子的肌动蛋白和肌球蛋白,这是因为高浓度的AMP与肌肉中大量肌动球蛋白发生特异性反应,导致大分子量的蛋白解离为小分子[36-37],蛋白间致密连接遭到破坏,孔隙增多,肌肉因此变得柔软、嫩度好,这也与上述肉品剪切力和MFI的结论一致。
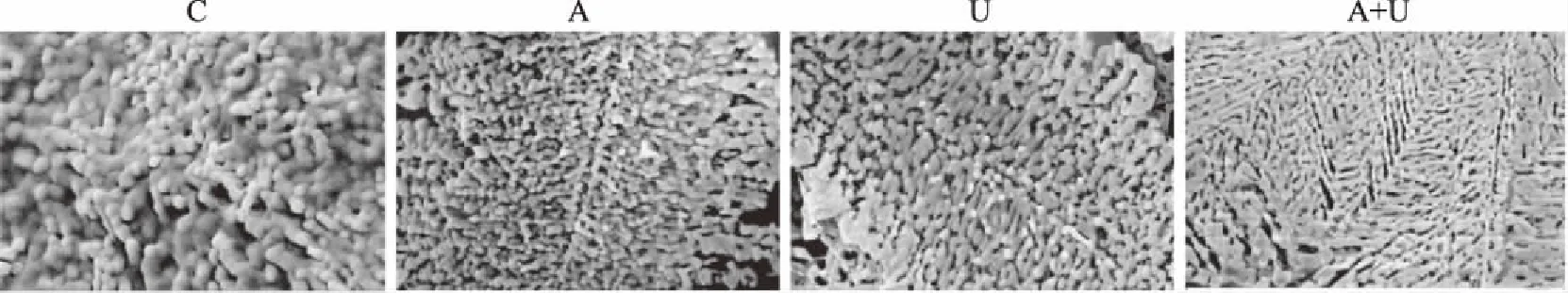
图5 不同处理组鹅胸肉的扫描电镜图Fig.5 Scanning electron microscopy of goose breast meat in different treatment groups
2.6 圆二色谱分析
图6和表1分别是不同处理下鹅胸肉肌动球蛋白的CD图和采用圆二色谱仪软件计算出的肌动球蛋白各二级结构含量。肌球蛋白的球状区域为非共价键轻链,尾部则有一个α-螺旋[38],且肌球蛋白中48%的氨基酸残基包含在α-螺旋中,因此肌球蛋白和肌动球蛋白的结构变化与α-螺旋息息相关。图6所示三个峰为α-螺旋在圆二光谱中的特征峰[39-40]。结合表1可知,AMP、超声波及其联合处理使α-螺旋含量减低,稳定的二级结构构象发生变化,构象重排使蛋白发生变性,其原因可能是肌动球蛋白解离为小分子的肌动蛋白和肌球蛋白,使蛋白分子的高级结构发生变化。
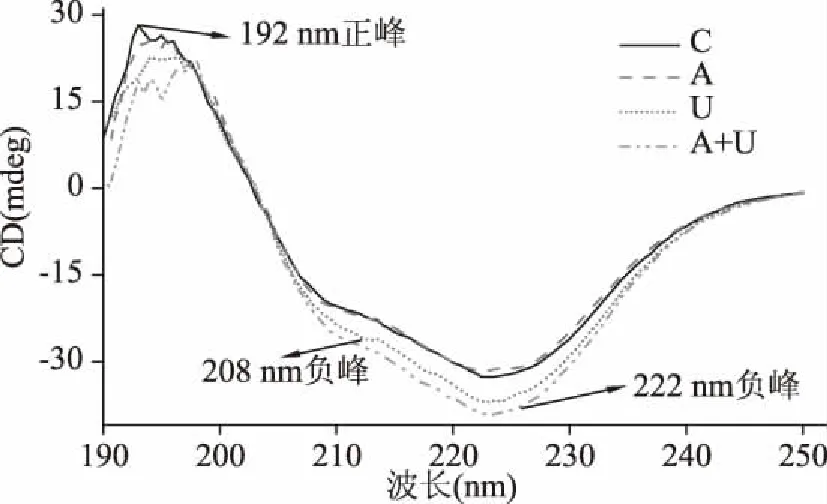
图6 鹅胸肉肌动球蛋白圆二色谱Fig.6 Circular dichroism of actomyosin from goose breast meat
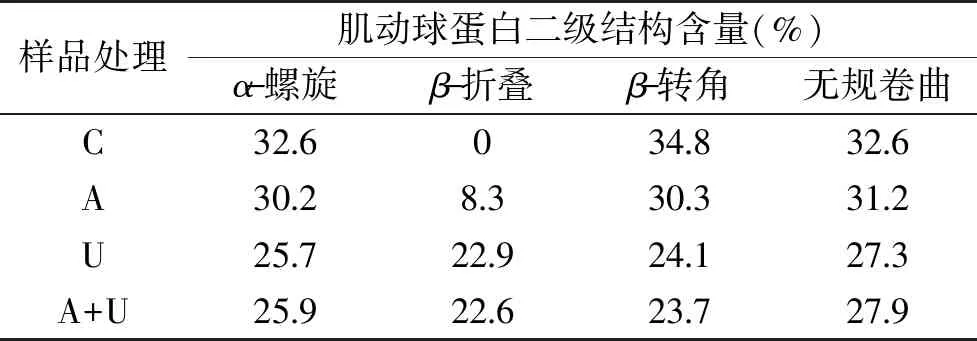
表1 鹅胸肉肌动球蛋白二级结构含量Table 1 Secondary structure contents of actomyosin from goose breast meat
2.7 肌动球蛋白同步荧光光谱分析
芳香族氨基酸残基是蛋白质的内源荧光的主要来源[41]。如图7A所示,色氨酸在280 nm左右有一个强荧光峰,且不同处理方式得到的肌动球蛋白色氨酸荧光值大小显著差异,各组色氨酸荧光强度从强到弱的次序分别为A+U>U>A>C,由图7B则可以看出酪氨酸在295 nm左右有一个强荧光峰,各处理组间峰强差异显著。可能是超声波和AMP腌制改变了极性微环境,之前埋于疏水环境中的酪氨酸和色氨酸逐渐暴露[42],肽链伸展程度增大,肌球蛋白球状头部和杆状尾部的氨基酸残基暴露[43],肌动球蛋白复合体解离为肌球蛋白和肌动蛋白。

图7 肌动球蛋白同步荧光光谱Fig.7 Synchoronous fluorescence spectroscopy of actomyosin from goose breast meat注:A:色氨酸残基光谱图;B:酪氨酸残基光谱图。
2.8 鹅胸肉DSC变化分析
不同处理的鹅胸肉DSC热流曲线如图8所示,峰Ⅰ和峰Ⅱ分别代表肌球蛋白和肌动蛋白热变性引起的热流变化[44-45];表2则为根据图8得出的肌球蛋白和肌动蛋白的峰值温度Tm(T1、T2)和焓变ΔH值(ΔH1、ΔH2)。由表2可以看出,与对照组相比,其它三个处理组(A、U、A+U处理)的鹅胸肉峰值温度Tm均发生改变,也就是蛋白的热变性温度发生变化,表明超声波和AMP处理显著影响蛋白的热稳定性,可能是超声波和AMP处理促使肌原纤维降解,肌动蛋白和肌球蛋白间联接键断裂[46],肌动球蛋白解离,肌肉蛋白舒展,引起蛋白二级结构变化,进而引起构象变化和相变[47],肉品蛋白质的二、三级结构被改变,从而显著改善了肌肉的柔软性。
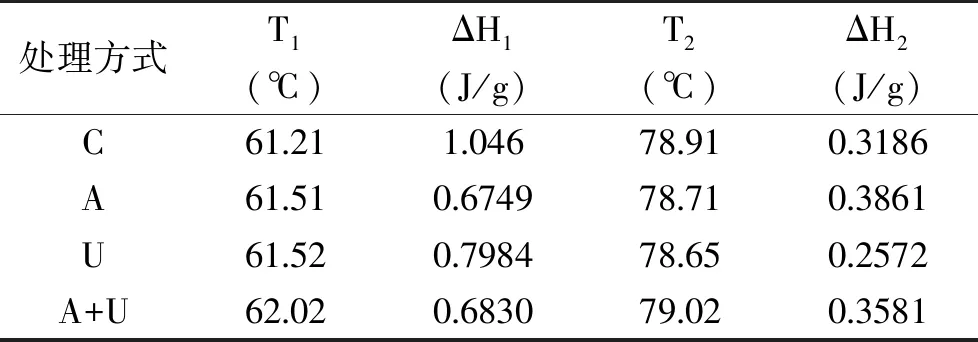
表2 超声波和AMP对鹅胸肉变性温度和变性焓的影响Table 2 Effects of ultrasound and AMP on thermal denaturation temperature and denaturation enthalpy of goose breast meat
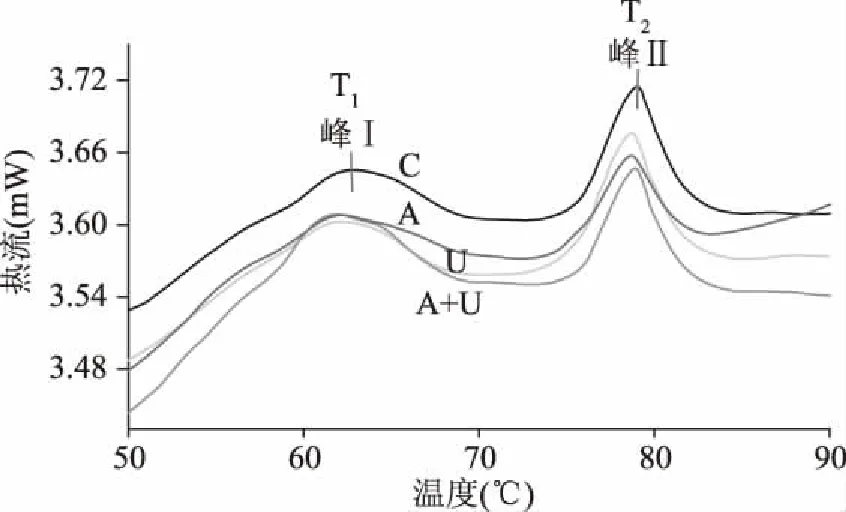
图8 鹅胸肉的差式量热扫描图Fig.8 Differential scanning calorimetry thermogram of goose breast meat
2.9 相关性分析
表3可以看出,p值在0.05水平和0.01水平上均显著相关,因此具有统计意义。剪切力和MFI之间以及剪切力和肌动蛋白相对含量之间对应的相关系数分别为-0.984和-0.997,呈显著负相关,而肌动蛋白含量和MFI之间的相关系数为0.994,呈显著正相关,即肌动蛋白含量越高、MFI越高,鹅胸肉的剪切力越小,鹅胸肉的嫩度品质越好,这也与上述剪切力等的结果一致。

表3 剪切力、肌原纤维小片化指数 和肌动蛋白含量相关性分析Table 3 The correlations among shear force, myofibril fragmentation index and actin content
3 结论
AMP可通过与肌动球蛋白形成复合物等促使肌动球蛋白解离,从而显著改善鹅肉嫩度。通过与未处理的对照组相比,比较分析单独超声波处理、AMP腌制以及超声波联合AMP处理对鹅胸肉的嫩度及肌动球蛋白性质,研究发现超声波与AMP联合处理组能在低超声功率和短时间AMP腌制条件下,达到更佳的肉品嫩化效果,相关性分析表明,鹅胸肉剪切力MFI、肌动球蛋白解离显著相关。因此,超声波联合AMP方法可用于鹅胸肉的嫩化,不仅节约能源绿色环保、嫩化效率高,还可为超声嫩化技术在肉品加工领域的广泛应用奠定理论基础。
