1型和2型黏蛋白在新生儿坏死性小肠结肠炎患儿肠组织中的表达变化
2019-03-28余加林李志光黄进洁徐艳珍
刘 东 余加林 李志光 贺 雨 杜 华 黄进洁 徐艳珍
新生儿坏死性小肠结肠炎(NEC)是新生儿期严重威胁患儿生命的疾病,主要病变包括黏膜和黏膜下层的糜烂、坏死、炎症和细菌侵入,严重者可发生肠壁全层坏死和穿孔。肠黏膜屏障结构和功能损坏与细菌的入侵被认为是NEC发病的中心环节之一[1]。肠道黏液层是肠黏膜屏障的化学/机械屏障的重要组成部分。黏蛋白则是肠道黏液层中主要的大分子物质,其所赋予肠道黏液层的黏性及其他理化性质是保证细菌与肠黏膜屏障之间稳态不可或缺的一环。目前尚少见NEC患儿肠组织中黏蛋白表达变化的相关报道。本研究拟通过观察NEC患儿肠组织黏膜屏障中与细菌关系最为密切的2种黏蛋白[1型和2型黏蛋白(MUC1 和MUC2)]的表达,探讨NEC患儿肠黏膜屏障黏液层的改变,更加深入理解肠黏膜屏障破坏在NEC发病中的角色。
1 方法
1.1 研究设计 病例对照研究。NEC组为NEC患儿手术肠组织标本病理切片,对照组为先天性肠闭锁患儿手术肠组织标本病理切片,观察2组MUC1及MUC2免疫组织化学表达变化。
1.2 知情同意和伦理 本研究设计获得广东省深圳市人民医院和重庆医科大学附属儿童医院伦理委员会的批准[2016伦审(研)第(106)号]。NEC组和对照组手术肠组织病理切片均来自于重庆医科大学附属儿童医院病理科,手术和病理检查均得到了患儿及其监护人知情同意。
1.3 NEC组病理切片选取 2017年1月10日至2018年5月31日重庆医科大学附属儿童医院病理科NEC患儿病理切片共27份,以随机数字表法从中随机选取10份病理切片,并查阅住院病历收集一般临床资料(性别、胎龄、生产方式和出生体重等)。
1.4 对照组病理切片选取 2012年3月21日至2018年4月24日重庆医科大学附属儿童医院病理科先天性肠闭锁患儿病理切片共241份,查阅住院病历收集一般临床资料,以本文选取的NEC患儿的胎龄和发病日龄行1∶1匹配。
1.5 肠组织病理染色 NEC组和对照组手术切除的病变肠组织石蜡包埋,行4 μm厚连续切片,常规HE染色。
1.6 肠组织免疫组织化学检测 NEC组和对照组病理切片的MUC1和MUC2免疫组织化学分析由广东省广州永诺生物科技有限公司完成。石蜡包埋肠组织标本4 μm切片,常规脱蜡及水化处理,PBS洗2次,各5 min。用PBS配置新鲜的3% H2O2,室温封闭5~10 min,PBS洗3次,各2 min。水浴锅加热0.01 mol·L-1枸橼酸钠缓冲溶液(pH 6.0)至95℃左右,放入组织切片加热10~15 min,用自来水冷却至室温,将切片取出。PBS洗5 min。滴加5% BSA封闭液,室温封闭15 min。甩去多余液体,滴加一抗:兔抗人MUC1及MUC2多克隆抗体(Abcam,英国),抗体工作浓度为MUC1为1∶50,MUC2为1∶400(用已知阳性片做阳性对照,PBS代替一抗做阴性对照)。4℃过夜后在室温复温45 min。PBS洗3次,各2 min。滴加多聚体抗兔IgG-HRP作为二抗(博士德,武汉),室温孵育1 h。PBS洗3次,各2 min。DAB显色:用DAB显色试剂盒,观察至目的信号深、背景颜色浅时,立即用蒸馏水终止反应。苏木素复染20 s,蒸馏水洗2次,各2 min,脱水,将切片放入100%二甲苯10 min透明。中性树脂50 μL封片,室温保存。
结果判定及分析:MUC1及MUC2阳性为黄色、棕黄色、黄褐色,MUC1定位于细胞膜,MUC2定位于杯状细胞及黏液层。图像采集用OPTEC CCD TP510(重庆)显微镜,应用“ImagePro Plus 6.0”图像分析软件进行分析,分析200倍视野下各指标在组织内阳性产物的光密度,定量分析MUC1及MUC2在肠管组织的表达。

2 结果
2.1 一般资料 表1显示,NEC组及对照组患儿性别、胎龄、生产方式、出生体重和样本采集日龄差异无统计学意义。
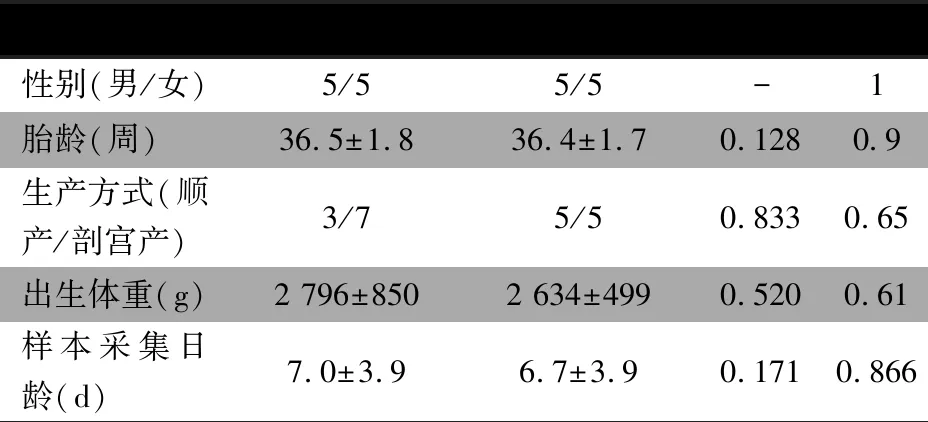
表1 NEC组及对照组患儿临床资料
2.2 HE染色 图1 HE染色显示,NEC组及对照组肠组织结构有明显差异,NEC组患儿肠组织结构的完整性破坏甚至消失,表现为大量绒毛脱落、坏死,黏膜下层及肌层水肿,毛细血管扩张充血,肠壁层炎性细胞浸润,肠组织杯状细胞及隐窝减少。
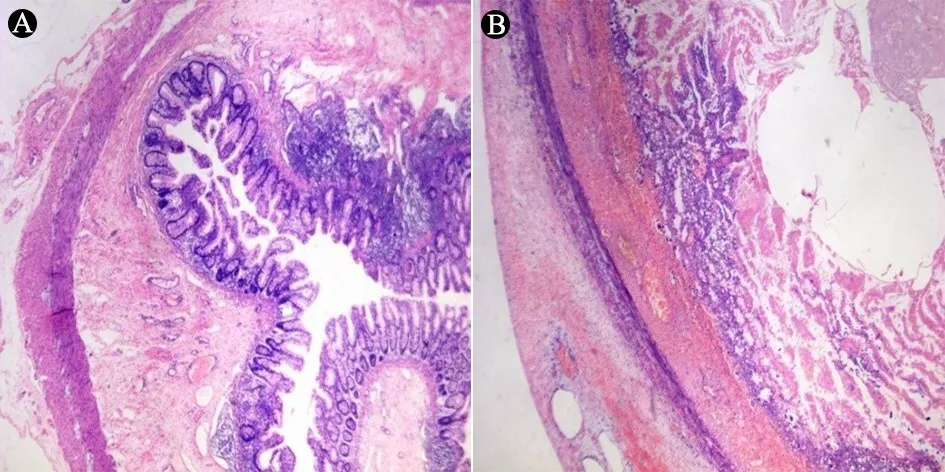
图1NEC组和对照组患儿肠组织HE染色(×40)
注 A:对照组肠壁组织结构完整清晰,绒毛排列规则整齐,上皮完整连续,腺体排列规则有序。B:NEC组患儿肠壁组织结构破坏甚至消失,表现为大量绒毛脱落、坏死,黏膜下层及肌层水肿,毛细血管扩张充血,肠壁层炎性细胞浸润,肠组织杯状细胞及隐窝减少
2.3 MUC1及MUC2免疫组织化学分析 2组免疫组织化学结果见图2和3。MUC1位于肠组织细胞的细胞膜表面,NEC组与对照组相比,MUC1蛋白表达(以累计光密度值统计)明显减少(NEC组中位数780 455.5vs对照组中位数19 175 070.4,P=0.004); MUC2位于肠组织细胞杯状细胞内外(由杯状细胞分泌),与对照组相比,NEC组患儿肠组织MUC2蛋白表达(以累计光密度值统计)显著降低(NEC组中位数3 039 120vs对照组中位数45 750 707.5,P=0.001)。
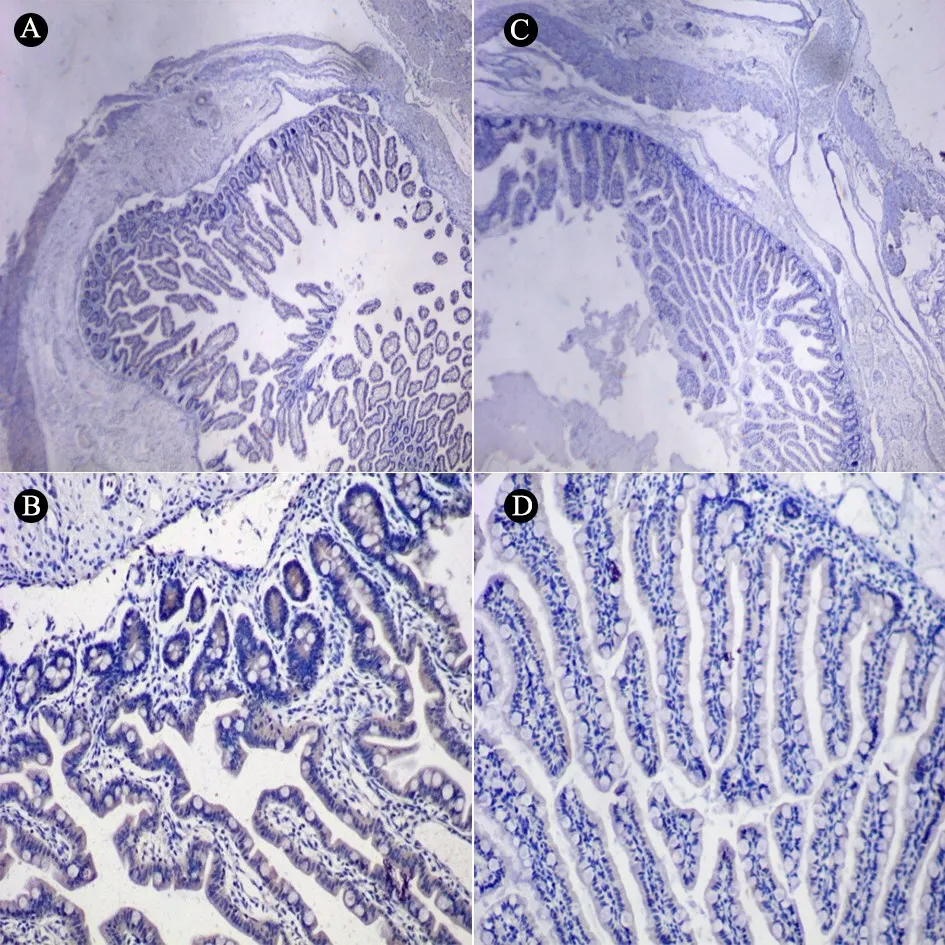
图2NEC组及对照组患儿肠组织MUC1免疫组织化学
注 MUC1阳性(黄棕色)示其定位于细胞膜水平。A(×40)、B(×200):对照组;C(×40)、D(×200):NEC组
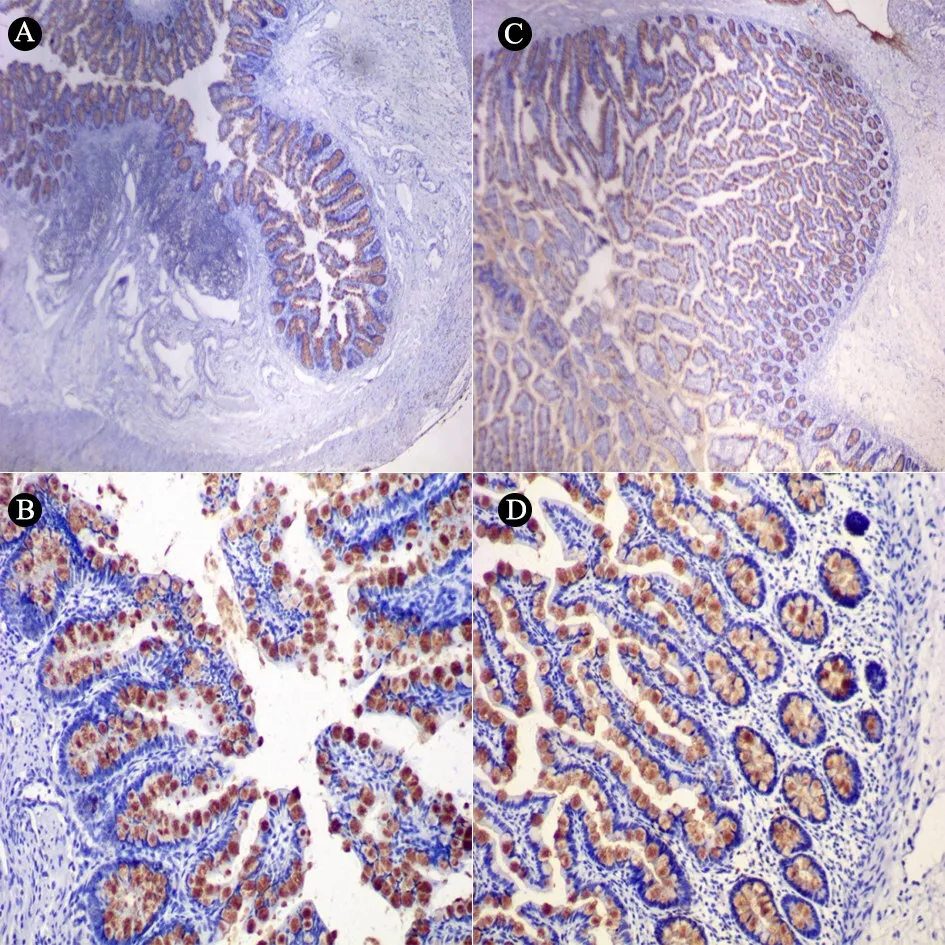
图3NEC组及对照组患儿肠组织MUC2免疫组织化学
注 MUC2阳性(黄褐色)示其定位于杯状细胞细胞内外。A(×40)、B(×200):对照组;C(×40)、D(×200):NEC组
3 讨论
NEC预防和治疗面临着许多棘手的问题,阐明其发病机制十分迫切。遗传易感性、肠道不成熟、微血流灌注失衡、异常肠道菌群定植、肠黏膜免疫应激性增高等都是NEC的发病危险因素[1]。尽管迄今为止仍不能确定何种因素起主导作用,但肠黏膜屏障结构与功能破坏使细菌与机体的正常关系失衡导致NEC发生这一观点逐渐被认可。
本研究对肠黏液层中的两种主要大分子物质MUC1及MUC2的表达变化进行观察,发现2种黏蛋白分子在NEC患儿肠组织中均显著减少。
在黏蛋白与NEC关系的研究中,MUC2较早受到关注。MUC2是分泌型黏蛋白中的一种,能赋予肠道黏液黏性和弹性。以往研究发现,NEC大鼠的回肠部位MUC2阳性的杯状细胞数量减少,MUC2基因表达水平反馈性明显升高,MUC2蛋白表达减少,表皮生长因子可加速MUC2合成,改善肠道屏障功能[2]。Winnie+/+小鼠(MUC2合成异常)较野生型小鼠(Winnie-/-)易发生NEC且更重,而胆盐可降低MUC2表达,促进NEC发生[3]。本研究利用免疫组织化学技术对NEC患儿肠组织MUC2的表达水平进行检测,结果表明较对照组明显降低,与已有动物实验研究结果相符。有研究表明,益生菌、母乳中的低聚糖可使MUC2蛋白表达上调,而这两者均可降低NEC发生率[4, 5]。肠黏液层MUC2水平降低可能导致黏液层通透性升高,使细菌更容易穿透黏液层而导致肠黏膜屏障破坏,其在NEC的发生过程中可能扮演着重要角色,具体机制尚待进一步阐明。
肠道黏液层中存在的另一种与MUC2截然不同的膜结合型黏蛋白——MUC1则功能相对多样。MUC1广泛分布于人类呼吸道、消化道、泌尿道和生殖道等黏膜组织细胞的细胞膜表面,其分子结构包括细胞内和细胞外两部分,分别是蛋白主体及O-聚糖侧链。在这个结构中,其细胞内的蛋白质“小尾巴”(MUC1CT)结构尤为引人注意。在不同物种之间,这一结构都十分保守,提示其具有特定的作用。对MUC1功能的研究涉及多种疾病,如肿瘤、呼吸道疾病、眼部疾病以及炎症性肠病等。与MUC2相比,MUC1功能呈现多样化,不仅具有抗感染作用,而且对细胞凋亡及炎症等有调节作用。但迄今为止尚未发现NEC发病与MUC1关系的研究报道。
MUC1的功能包括:①抗感染: 喂养MUC1-/-小鼠空肠弯曲菌后其胃肠道细菌定植的密度较野生型小鼠明显增高,全身感染的发生率亦较野生型小鼠明显增高。与MUC1-/-小鼠相比,表达MUC1的小鼠细胞结合幽门螺杆菌明显减少[6]。细菌可与MUC1结合,但随之从细胞表面释放[7]。MUC1胞外黏蛋白结构域较短的患者,如幽门螺杆菌阳性,则更易发生胃炎,可能是短的MUC1分子使得细菌容易接触细胞表面受体的缘故[8]。②抗凋亡: MUC1的MUC1CT结构可激活PI3K/Akt信号通路,上调抗凋亡蛋白Bcl-xl的表达[9]。而MUC1过表达则可减轻抗癌药物诱导的3Y1成纤维细胞凋亡[10]。MUC1表达被氧化应激激活后可减少活性氧簇(ROS)的水平以及由氧化应激引发的细胞凋亡[11]。MUC1过表达可减轻细胞色素c的释放,从而抑制凋亡发生[12]。③调节炎症反应:膜结合型黏蛋白可通过MUC1CT调节炎症反应。MUC1胞外部分与细菌结合后,MUC1CT从细胞膜释放,可激活NF-κB来调节炎症通路[13, 14]。与野生型小鼠相比,基因敲除小鼠Muc1-/-气道上皮TNF-α、角化细胞趋化因子(KC)水平及NF-κB激活的水平明显增高[15]。TNF-α可上调MUC1表达,而MUC1过表达可抑制IL-8表达水平[16]。MUC1作为肠黏液层分布于细胞膜表面的最后一道黏蛋白屏障,在调整肠黏膜屏障方面具有潜在的重要作用。本研究首次表明NEC患儿肠组织MUC1表达水平较对照组显著降低,这种变化对于NEC发生发展的意义尚待进一步阐明。
本研究表明,NEC患儿肠组织MCU1及MUC2表达水平均显著降低,说明它们可能参与了NEC的发病过程,其在NEC发生发展中的地位尚需进一步研究。在NEC临床诊疗过程中,采取措施避免肠黏膜屏障中MCU1及MUC2表达水平降低,可能为临床NEC防治提供新的理论依据及合理干预方案,并加深对NEC发病机制的理解。
