终末期肾脏病患者桡动脉钙化与血液透析及糖尿病的关系*
2019-03-26陈圳炜曾海鸥袁丽萍何东玲唐海容伍强杨铁城
陈圳炜, 曾海鸥, 袁丽萍, 何东玲, 唐海容, 伍强, 杨铁城
中山大学附属第八医院肾内科(广东深圳 518000)
由刘志红院士牵头目前国内最大的对血管钙化(vascular calcification, VC)多中心研究显示,透析患者VC发生率为77.4%[1],VC会增加患者心血管疾病(cardiovascular disease, CVD)发病风险和增加患者全因死亡风险[2-3]。慢性肾脏病(chronic kidney disease, CKD)患者VC的发病机制很复杂,VC目前认为是一个主动的过程,中心环节是血管平滑肌细胞(vascular smooth muscle cells, VSMC)凋亡和囊泡形成并转分化为成骨样细胞,这些细胞可以诱导基质形成并引起局部的矿化的启动[4]。流行病学和临床资料发现CKD患者发生VC和导致CVD的危险因素既包括糖尿病、性别、高血压、血脂异常、年龄、吸烟等传统危险因素,也包括透析时间、钙磷代谢异常、甲状旁腺功能亢进、炎症状态、氧化应激等CKD特征性危险因素[5]。这些危险因素在一定作用下导致VSMC转分化为成骨样细胞,从而启动组织的矿化过程[6]。终末期肾脏病(end-stage renal disease, ESRD)患者行动静脉内瘘(arteriovenous fistula, AVF)成形术,术中我们可以获得桡动脉残端,通过钙化染色我们可以判断有无桡动脉钙化(radial arterial calcification, RAC)。我们既往研究发现RAC与血液透析(hemodialysis, HD)时间>5年及糖尿病相关[7],但并未对不同HD及糖尿病亚组人群RAC特点进行细化分析,因此,本课题继续对ESRD患者AVF成形术获取的吻合口处的桡动脉残端进行钙化染色,判断有无吻合口处RAC,观察不同HD及糖尿病亚组人群的RAC临床特点,并对可能的机制进行分析。
1 资料与方法
1.1 一般资料 广东省深圳市血液净化中心2014年1月至2016年1月行自体AVF成形术的ESRD患者。排除采用移植血管者;尿毒症合并肿瘤行HD的患者;肾移植术后,移植肾失功,行HD的患者;腹膜透析患者。研究获得伦理委员会批准,所有患者签署知情同意书。
1.2 钙化判断 桡动脉标本取自手术中对桡动脉的修剪,用10%中性甲醛溶液固定24 h后石腊包埋,采用茜素红S法对动脉进行钙化染色,通过光学显微镜判断有无钙化,阳性为红色嗜碱性沉积物。
1.3 分组标准 (1)根据有无血管钙化将血管标本分无钙化组及钙化组。(2)根据是否行HD分HD组及非HD组。(3)根据HD时间是否≥5年分HD≥5年组及HD<5年组。(4)根据是否合并糖尿病分糖尿病组及非糖尿病组。(5)根据糖尿病病程是否≥15年分≥15年组及<15年组。
1.4 血液指标检测 应用贝克曼库尔特DXC800全自动生化分析仪检测血清中钙、磷、尿素氮、肌酐、胆固醇(total cholesterol, TC)、低密度脂蛋白(low density lipoprotein, LDL)、三酰甘油(triglyceride, TG),采用散射比浊法测定超敏C反应蛋白(high sensitivity C reactive protein, hs-CRP),采用库尔特电阻抗法测定糖化血红蛋白(glycosylated hemoglobin, HbA1C),采用电化学发光法检测血清中全段甲状旁腺激素(intact parathyroid hormone, iPTH)。同型半胱氨酸(homocysteine, Hcy)采用循环酶法测定(正常值5~15 μmol/L)。计算校正血钙,公式为: 校正血钙(mmol/L)=测定血钙(mmol/L)+[40-血白蛋白(g/L)]×0.025。计算钙磷乘积(mg2/dL2)=校正血钙(mg/dL)×血磷(mg/dL)。
1.5 统计学方法 采用SPSS 22.0统计软件进行分析,计量资料以M(P25,P75)表示。符合正态分布的计量资料,两组比较采用t检验;非正态分布的计量资料,对其进行正态转换进行参数检验,或采用秩和检验;计数资料采用2检验及Fisher确切概率法;采用多因素logistic回归分析方法建立RAC的回归方程。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 180例行自体AVF成形术的ESRD患者基本情况详见表1。原发病为慢性肾小球肾炎83例,糖尿病肾病50例,高血压肾损害19例,多囊肾8例,梗阻性肾病8例,狼疮性肾炎4例,其他8例。
2.2 组织学特点 茜素红S染色结果显示:180例ESRD患者中38例发现钙化,发生率为21.1%。在桡动脉沉积的钙盐,表现为红色嗜碱性沉积物,随着钙化程度的加重,红色嗜碱性沉积物逐渐增多。钙盐在桡动脉沉积主要发生在血管中膜,38例RAC中动脉中膜钙化(arterial medial calcification,AMC)占37例,仅1例动脉内膜钙化(arterial intimal calcification,AIC),外膜钙化未检出。同时我们在大部分桡动脉亦发现了不同程度的动脉内膜增生。见图1。
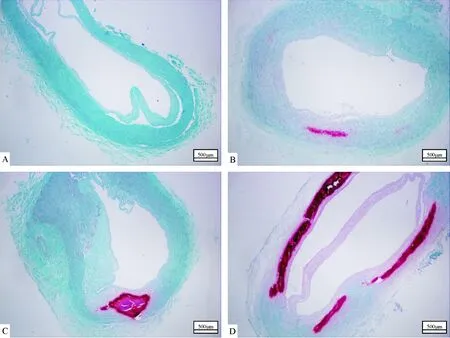
A:动脉内膜增厚无钙盐沉积;B:动脉中膜轻度钙化;C:动脉中膜中度钙化;D:动脉中膜重度钙化
2.3 钙化组与非钙化组的临床资料比较 180例ESRD行AVF的患者中38例来自钙化组,142例来自非钙化组。钙化组与非钙化组观察项目比较结果见表1。钙化组HD时间≥5年占比、糖尿病发病率、HbA1C较非钙化组差异有统计学意义(P<0.05)。

表1 钙化组和非钙化组临床资料比较 M(P25, P75)
2.4 RAC危险因素的logistic回归分析 以有无RAC为因变量,模型1纳入HD时间≥5年、糖尿病、HbA1C为自变量,模型2纳入年龄、吸烟、HD时间≥5年、糖尿病、HbA1C、TG、TC、LDL、hs-CRP、服用钙剂、服用活性维生素D、甲状旁腺激素、校正血钙、血磷、钙磷乘积为自变量,多因素logistic 回归分析结果显示,HD时间≥5年、糖尿病是ESRD患者发生AVF吻合口处RAC的独立危险因素。见表2。

表2 RAC影响因素的logistic回归分析
2.5 HD对ESRD患者影响 180例ESRD患者中160例来自HD组,20例来自非透析组,HD组与非透析组观察项目比较结果见表3。从表3可看出HD组血红蛋白、尿素氮、hs-CRP、校正血钙较非透析组差异有统计学意义(P<0.05)。180例ESRD患者中148例来自HD<5年组,32例来自HD≥5年组,HD<5年及HD≥5年观察项目比较结果见表3。从表3可看出HD≥5年组糖尿病、RAC、血红蛋白、血肌酐、服用钙剂、iPTH、校正血钙、血磷、钙磷乘积较HD<5年组差异有统计学意义(P<0.05)。
2.6 糖尿病对ESRD患者影响 180例ESRD患者中62例来自糖尿病组,118例来自非糖尿病组。糖尿病组HD时间≥5年比率、RAC、年龄、收缩压、舒张压、TG、白蛋白、HbA1C、血磷较非糖尿病组差异有统计学意义(P<0.05)。62例糖尿病ESRD患者中40例糖尿病<15年,22例糖尿病≥15年。糖尿病≥15年组RAC、年龄较糖尿病<15年组差异有统计学意义(P<0.05)。见表4。
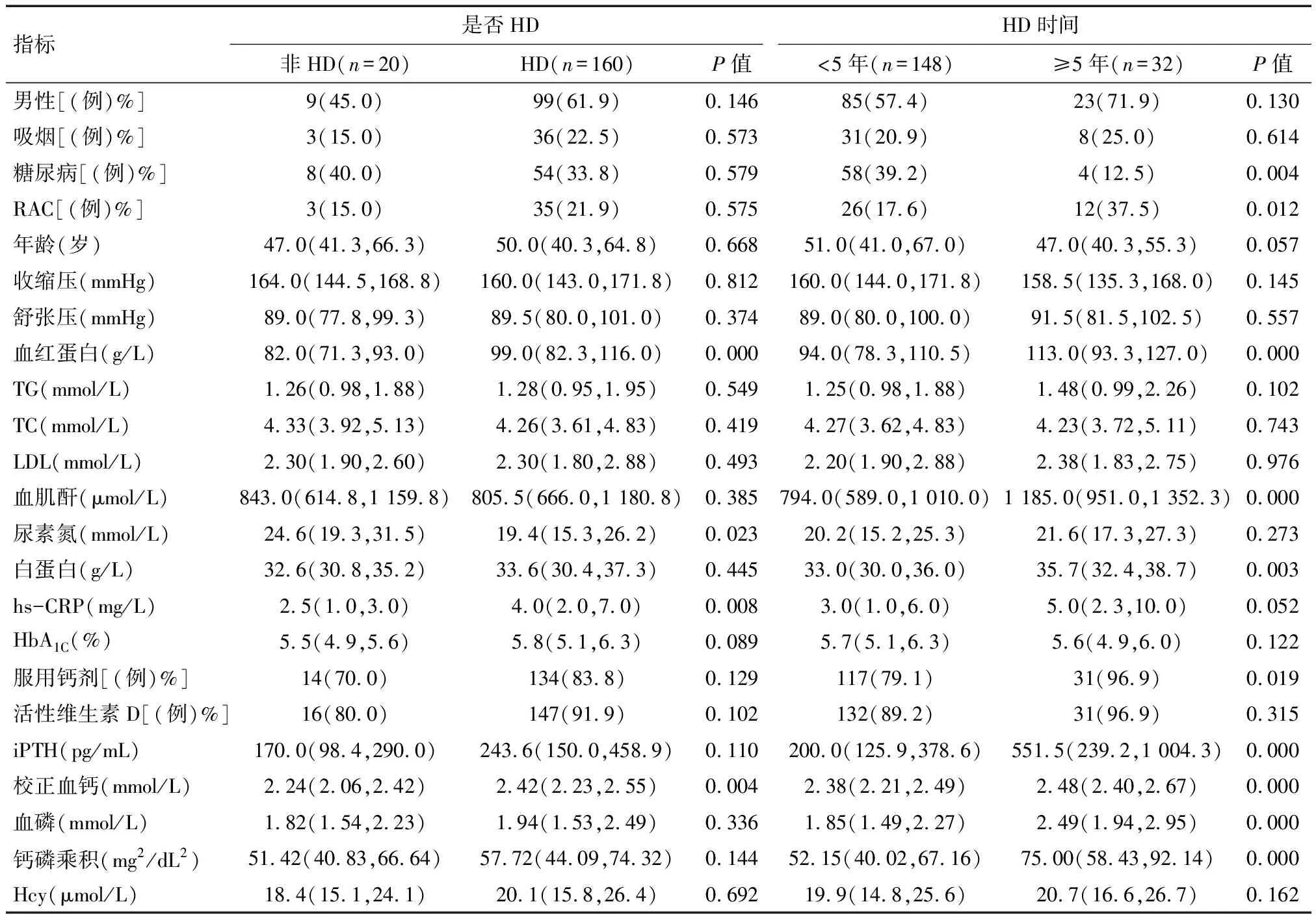
表3 不同透析组临床资料比较 M(P25, P75)
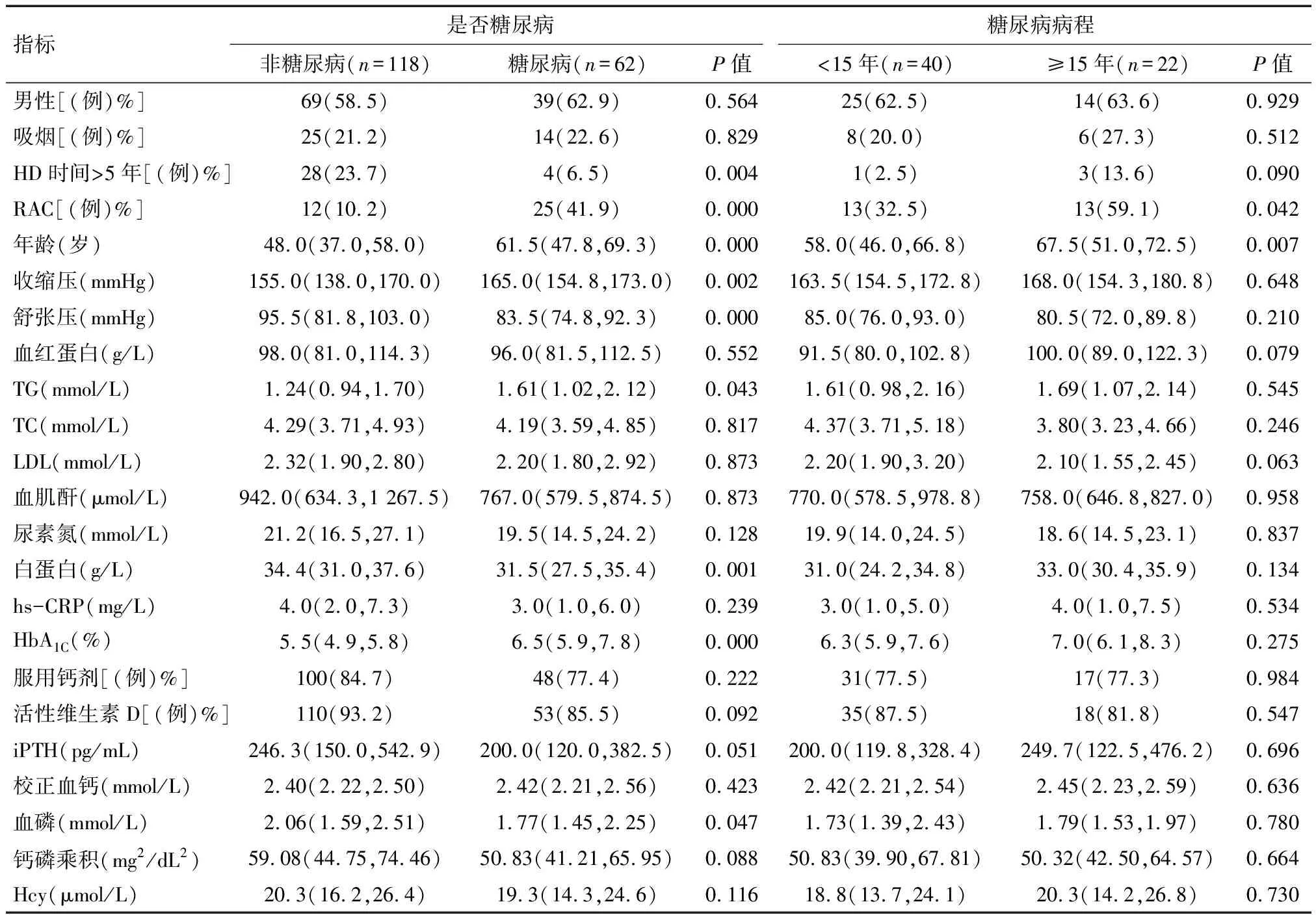
表4 不同糖尿病组临床资料比较 M(P25, P75)
3 讨论
据我们查阅,这可能是目前最大的通过动脉活检对VC检测的临床观察研究,VC在ESRD患者中非常普遍,仅桡动脉远端组织病理证实的VC发生率已达21.1%。VC可以出现在血管的内膜及中膜,和炎症相关的AIC出现在CKD的早期阶段,而AMC即Monckeberg钙化则出现在CKD的晚期阶段[8]。ESRD患者VC绝大部分以AMC为主,随着钙化程度的加重,嗜碱性羟基磷灰石逐渐弥漫整个动脉中膜。AIC极少发现,但动脉内膜存在不同程度的增生,这在发育成熟的AVF表现更加明显,考虑可能与血流量及压力的改变刺激动脉内膜的增生有关[9]。
VC是多因素在一定的时间上共同作用的结果,VSMC向成骨样细胞的转分化是VC发生的中心环节[10]。与我们既往研究相符[7],本次在扩大了入组患者后,继续通过组织活检证实RAC,然后分析其与VC传统危险因素及CKD特征危险因素的关系,发现RAC仍与HD≥5年及糖尿病相关。进一步的logistic回归分析发现,在纠正了干扰因素后,HD时间≥5年、糖尿病是ESRD患者发生RAC的独立危险因素。那么HD和非透析、HD时间长短、糖尿病与非糖尿病、糖尿病病史长短患者的RAC有什么特点,我们以下对此进行了进一步的亚组分析。
HD是ESRD患者重要的治疗方法,我们在亚组分析中,通过对比HD及保守治疗的ESRD患者中发现,HD可以改善ESRD患者贫血状态、降低尿素氮水平、提升血钙,但也带来了全身的炎症状态的提升。血钙的升高导致钙磷沉积升高,可导致钙磷沉积物被动沉积在VSMC,从而导致VSMC钙化[11]。而血管的微炎症状态在CKD早期即可出现,并且可以通过多种途径导致VC的发生[12],其中一条就是可以通过扰乱LDL受体途径[13]。通过对比HD及保守治疗组患者,我们并未发现其RAC有显著差别,提示单纯的启动HD并不是导致RAC的主因。
那随着HD时间的延长,是否会有更多的导致VC的因素参与其中,故我们参阅了文献及对比了我们既往的研究结果[14-15],把HD时间≥5年作为一个长期透析的分界点。在对HD时间的亚组分析中我们发现,当HD时间≥5年,校正血钙、血磷、钙磷乘积、甲状旁腺激素、服用钙剂的比例较HD<5年明显升高,这些结果印证了既往对ESRD患者导致VC的相关观点[16-18]。从组织病理学角度,我们发现两组患者的RAC发生率出现显著差别,这给我们提示HD必须要有时间的积累才能导致组织学上可检测的钙化,而从影像学检测的VC,也得到VC与HD时间相关的相似的结果[19]。ESRD患者在继发性甲状旁腺功能亢进导致的钙磷代谢紊乱、钙磷负荷增加(食物、医源性药物)、HD时穿刺及血液的涡流、乱流对血管壁的长期刺激等因素作用下[20],经过一定时间的积累,最终导致在组织病理上可检测的RAC。
糖尿病既是ESRD的主要病因,也是CVD的主要危险因素之一[21]。我们纳入的ESRD患者中,糖尿病患者占34.4%,在亚组分析中,我们对比糖尿病及非糖尿病ESRD患者,发现糖尿病组尽管在HD时间及血磷两个导致VC的因素中低于非糖尿病组,但其RAC发生率却远远高于非糖尿病组,提示糖尿病本身就是一个很强的致VC因素。目前研究发现,糖尿病导致VC可能与炎症状态、氧化应激级骨矿物质代谢紊乱等因素有关[22]。糖尿病组患者同时存在更高年龄、脉压差(收缩压减舒张压)及TG,高龄、血脂代谢紊乱可以导致血管僵硬或钙化[5],僵硬及钙化的血管脉压差必然增高,且血压更难控制。此外,患有糖尿病的ESRD患者VC程度高于非糖尿患者,因为除了CKD的危险因素外,还与糖尿病特有的内皮功能紊乱、高脂血症、高胰岛素血症、血糖控制欠佳、组织缺氧等因素有关[23]。最后,糖尿病患者HD≥5年的比例明显少于非糖尿病患者,考虑这与糖尿病患者普遍年龄大,VC程度重增加CVD死亡风险有关。
那糖尿病的病程是否也对ESRD患者的VC有进一步的加重作用,故我们对糖尿病的ESRD患者作进一步的亚组分析,我们发现当糖尿病病史≥15年即可出现RAC的显著差别,且这部分患者更为年长。对于冠状动脉而言,结论也是相似的,糖尿病病程与冠状动脉的钙化指数相关[24]。VC被看作是与年龄时间相关的矿物质及细胞外基质被动在血管沉积的一种衰退[25],羟基磷灰石在血管沉积还要有一个时间的过程,而这体现在糖尿病病程及年龄方面的差异。
我们的研究尚存在一些局限性:首先,组织学活检只能检测一小部分动脉,并不能像影像学对整体血管进行评估,虽然补充了以影像学为基础的观察,但本研究没有对血管进行组织学联合影像学对比观察,故未来将补充对患者进行联合组织学、影像学及血清学观察;其次,纵然是可查阅目前最大的动脉活检数量,大部分数据仍呈偏态分布,提示入组数量仍不足,故将来仍需继续扩大样本数量;再次,这是一个单中心的研究,未来将联合更多中心观察。
综上所述,ESRD的患者存在较高的RAC率,HD时间≥5年及糖尿病是导致组织病理学RAC的独立危险因素。RAC是多方面因素在一定时间上共同作用的结果,ESRD患者HD≥5年或糖尿病病史≥15年即可出现明显的组织病理学RAC。
