肝癌TAE后正常肝组织中PPAR-α和氧化应激指标的表达*
2019-03-26李娟娟杜伟郭伟莲王光明
李娟娟, 杜伟△, 郭伟莲, 王光明
大理大学第一附属医院 1放射科, 2病理科(云南大理 671000)
肝癌是世界上常见的恶性肿瘤之一,在我国已成为第2位的肿瘤致死性疾病[1]。外科手术切除、肝移植是肝癌患者最有效的治疗手段,但大部分患者确诊时已为中晚期,致使根治性手术切除率仅为20%[2]。因此,经导管肝动脉栓塞术(transcatheter hepatic artery embolization,TAE)已经成为治疗中晚期肝癌的首选方法[3]。在我国90%以上的肝癌发生于肝硬化基础上,肝癌患者常需多次进行TAE治疗,但TAE对肝组织的损伤往往使原本脆弱的肝脏储备功能进一步受损,导致肝功能失代偿,甚至肝衰竭。肝功能损伤的发生率在22.4%~66.7%之间,是TAE术后影响患者生存期的主要因素[4-5],限制了TAE的广泛应用,因此,怎样减轻甚至避免TAE术后对肝组织的损伤已经成为影响患者预后的关键因素。过氧化物酶体增殖物激活受体α(peroxisome proliferators-activated receptor-α,PPAR-α)作为配体依赖性的核转录调节因子,高表达于肝脏,是一种肝细胞保护因子[6]。研究发现,PPAR-α参与氧化应激、细胞周期的调节。尽管PPAR-α是一种肝细胞保护因子,但在肝癌术后肝组织发生损伤的过程中PPAR-α和氧化应激(OS)是如何改变的,目前国内外很少有研究报道。2017年2月至2018年2月,本研究通过观察肝癌TAE后肝组织中PPAR-α和OS的表达,旨在探讨肝癌TAE术后PPAR-α和OS的改变与肝功能损伤间的作用机制,为临床PPAR-α靶点治疗提供实验依据。
1 材料与方法
1.1 实验动物 荷瘤兔2只(由东南大学附属中大医院惠赠),新西兰大白兔35只(由大理大学实验动物中心代购),体重2.5~3.2 kg,雌雄不限,月龄4~5个月,营养状况一致。
1.2 主要药品及检测试剂 3%巴比妥钠,硫酸庆大霉素注射液,0.9%氯化钠溶液,碘伏消毒液,购自茂名市消毒用品厂有限公司(广东,中国),PPAR-α鼠抗兔多克隆抗体,小鼠IgG免疫组化试剂盒SV001,购自武汉博士德生物技术有限公司(武汉,中国),兔[超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)]ELISA试剂盒、丙二醛(MDA)测试盒、PPAR-α ELISA试剂盒,购于上海酶联生物科技有限公司(上海,中国)。
1.3 肝癌动物模型建立 实验兔于造模前12 h禁食,8 h禁饮,麻醉、固定于兔台,手术区域备皮后常规消毒铺巾。于剑突下沿腹部正中线逐层切开进入腹腔暴露肝脏后,在棉签与纱布帮助下用无齿镊轻轻将肝左叶拉出,眼科剪刺破肝组织建立窦道,窦口直径约1 mm,深约0.5 cm,将制备好的肿瘤颗粒用眼科镊夹取填塞入窦道内,按压窦口,腹腔内洒入4万U庆大霉素,纱布压迫穿刺点止血3~5 min,无渗血后将肝脏放回腹腔内,并按腹膜、肌肉、皮肤逐层缝合切口,碘伏消毒,查看生命体征存在,放回饲养房。术后肌内注射4万U庆大霉素,1次/d,连续3 d,预防感染,注意保温[7]。
1.4 实验动物模型分组及TAE术 造模后4周行CT检查追踪肿瘤生长情况,将建模成功的27只新西兰大白兔VX2肝癌模型进行随机分组,对照组、造影组及TAE组各9只。TAE组用碘化油0.2 mL/只栓塞供血肝动脉;造影组仅行肝动脉插管造影不注入任何药物;对照组不做任何处理。新西兰大白兔全麻后固定于操作台上,右腹股沟附近10 cm范围内备皮、消毒,用18G穿刺针穿刺进入股动脉后引入导丝,拔去穿刺针后引入4F导管鞘,经导管鞘放入4F导管,通过导丝选入腹腔干,然后将3F微导管通过4F导管超选入肝总动脉,造影明确肿瘤供血动脉,然后行超选择性肝动脉造影,TAE组用3F微导管推入0.2 mL碘化油后再用明胶海绵颗粒栓塞。TAE组术后10 h,处死各组实验兔并切取所需肝脏标本。
1.5 PPAR-α和氧化应激指标(SOD、CAT、GSH-Px和 MDA)含量的测定及方法 造影和TAE治疗后10 h,处死各组实验兔,立即取各组样品放在0.9%氯化钠溶液溶液中(0℃或以下)洗涤,在冰浴中制成不同浓度的组织匀浆,生化酶学法检测肝组织中氧化应激指标(SOD、CAT、GSH-Px和MDA)在不同实验组间癌旁肝组织中的活力或含量改变;免疫组化法检测PPAR-α在不同组间肝组织中的表达情况,严格按试剂盒说明操作。
1.6 PPAR-α免疫组化染色方法 肝组织取材后石蜡包埋,切片厚度6 μm,放到载波片上脱蜡到水,用甲醇双氧水处理,非免疫血清封闭,滴加稀释的一抗(1∶2 000)4℃过夜,PBS冲洗3次,滴加聚合HRP标记抗小鼠IgG 37℃孵育30 min,PBS冲洗3次,然后DAB显色镜检。
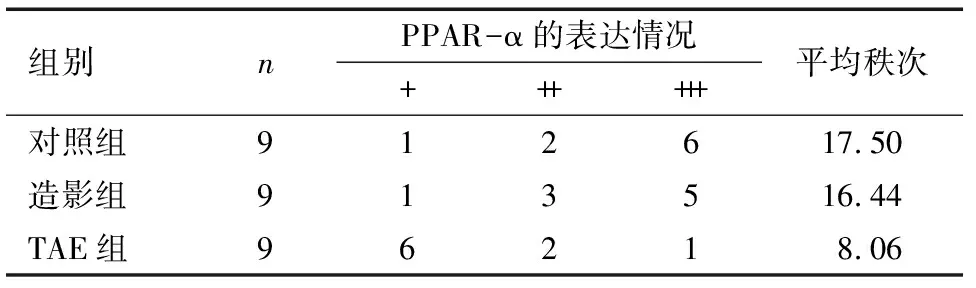
1.7 PPAR-α阳性判断标准 PPAR-α阳性细胞反应物主要分布于细胞核,染色由深到浅分别为棕褐色、棕黄色、黄色以及浅黄色等。采用Fromowitz的计分法评分。每张切片选5个高倍镜视野计数。根据阳性细胞染色的深度以及细胞数进行评分:(1)染色深度:无着色0分,淡黄色1分,黄棕色2分,棕褐色3分;(2)阳性细胞数量:<5%记0分,5%~24%记1分,25%~50%记2分,51%~75%记3分,75%以上记4分。以两者之和作为判断结果。判定标准如下:<2分记作阴性(-),2~3分记作弱阳性(+),4~5分记作阳性(++),6~7记作强阳性(+++)。
2 结果
2.1 肝癌TAE后各组肝组织的HE染色 肝癌TAE术后肝组织HE染色显示,与其他两组相比,TAE组的大部分肝细胞胞浆淡红,核深染、核固缩、核碎裂,部分形成空泡,周围见中性粒及淋巴细胞浸润。见图1。
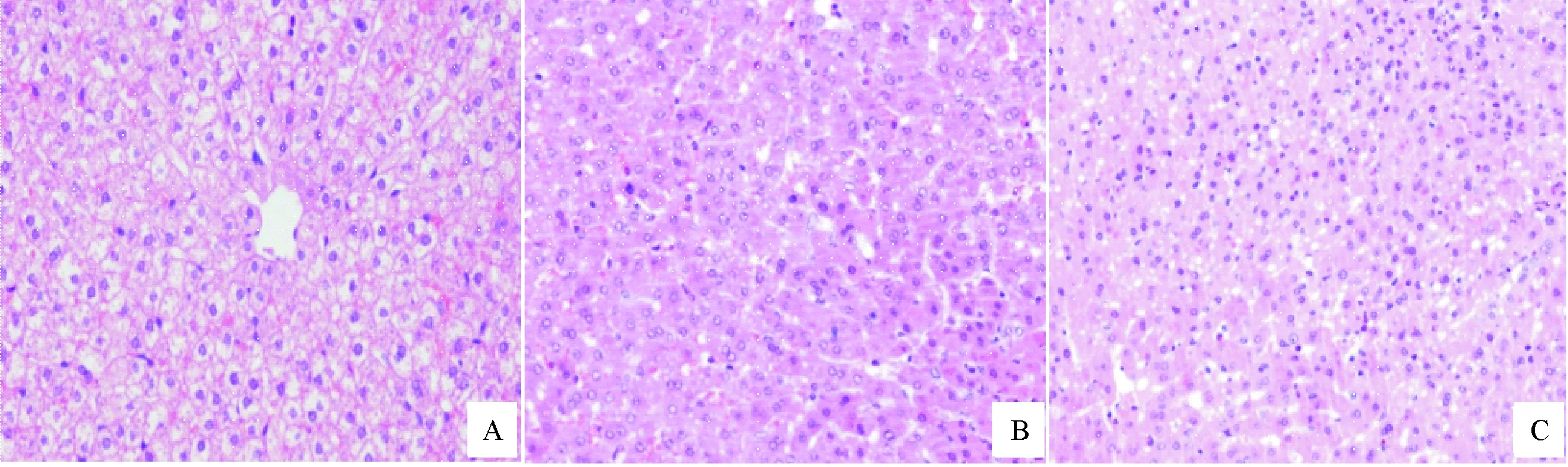
A:对照组;B:造影组;C:TAE组
2.2 肝癌TAE后肝组织中PPAR-α的表达 PPAR-α表达于3组肝细胞的细胞核,呈现淡黄至棕褐色颗粒,着色程度不一,3组均见PPAR-α的阳性表达,见图2。与对照组相比,造影组PPAR-α的表达有降低趋势,但差异无统计学意义(P>0.05),TAE组与其他两组相比,PPAR-α的表达明显降低,差异有统计学意义(P<0.01)。见表1。
2.3 肝癌TAE后肝组织SOD、CAT、GSH-Px和MDA的活力或含量的比较 造影组与对照组相比,肝组织抗氧化指标SOD、CAT和GSH-Px活力有降低趋势,而过氧化产物MDA含量有升高趋势,两组差异无统计学意义(P>0.05);TAE组肝组织抗氧化指标SOD、CAT和GSH-Px活力明显低于造影组,而过氧化产物MDA含量升高,差异有统计学意义(P<0.01)。见表2。

A:对照组;B:造影组;C:TAE组
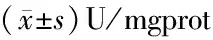

组别nSODCATGSH-PxMDA(nmol/mgprot)对照组946.27± 2.693.12±0.68263.14±6.7419.15±2.25造影组945.56±2.133.09±0.56259.07±5.9020.33±1.69TAE组921.92±2.06∗1.17±0.49∗189.72±8.21∗25.98±2.53∗
*与造影组比较P<0.01
3 讨论
研究表明,PPAR-α对组织和器官遭受的损伤具有保护作用,可通过多种途径参与组织的抗损伤,维持其正常生理功能[8-9]。对于参与人体多种物质代谢的肝组织,这种保护作用显得更为重要,当PPAR-α表达降低或者缺失时,肝细胞的损伤有进一步加重的趋势。在神经胶质瘤的研究发现[10],使用PPAR-α拮抗剂GW6471可使细胞增殖所致的缺氧和血管生成保护作用下降;相反,使用PPAR-α激动剂非诺贝特治疗后,可降低炎性细胞浸润、总蛋白浓度、血管密度、炎性细胞因子的产生[11]。研究显示[12],小鼠发生非酒精性脂肪肝时,其肝脏PPAR-α表达下调,表明肝脏损伤时可导致其降低。而使用激动PPAR-α表达的药物后,机体表现为肝脏脂肪变性和炎症反应减轻[13]。这些研究均表明,PPAR-α对维持机体的代谢平衡、抗氧化和抗炎损伤方面具有极其重要的作用。有研究报道[14],PPAR-α活化可以通过细胞自噬减轻肝组织的炎症反应,能够对急性肝损伤产生保护作用,因此,肝癌TAE术后周围的肝细胞缺血缺氧,导致炎症反应,引起PPAR-α的表达增加,从而发挥抗炎作用[15],但是,PPAR-α对自噬的诱导抗炎作用具有剂量依赖性[14],随着肝癌疾病的进展,细胞自噬受到抑制,抑制自噬可以加重肝脏损伤及肝组织的炎症反应,逆转PPAR-α对肝损伤原有的抗炎作用。
本研究通过免疫组化法检测肝组织中PPAR-α的表达,结果显示,肝组织中PPAR-α在造影术后表达有降低,但差异无统计学意义(P>0.05),提示造影剂不影响PPAR-α的表达。而肝癌介入栓塞术后PPAR-α显著降低,差异有统计学意义(P<0.05),推测可能的机制为肝癌TAE术后,随着疾病的进展,肝细胞自噬受到抑制,逆转PPAR-α对肝损伤原有的抗炎作用,使PPAR-α的表达降低,最终加重肝脏损伤及肝组织的炎症反应。基于这一研究结果和上述文献结论,笔者认为通过使用PPAR-α的激动剂可以作为降低介入术后肝功能损伤的靶点,具体结果有待进一步研究。
肝脏作为机体内最大的实质器官,也是体内最大的腺体,具有维持血糖稳定,调节脂类代谢、蛋白质合成及分解代谢、参与多种维生素和辅酶的代谢,参与多种激素的灭活等作用,对能量和氧的需求极大,使其对缺氧或缺血更为敏感,与其他细胞相比,肝细胞含有更多的抗氧化酶,增加了其抗氧化的能力,肝细胞中如果有ROS的过量产生,则立即引发氧化应激[16]。氧化应激既是导致肝功能障碍的原因,也是所有肝脏损伤的病理生理基础[17]。氧化应激是指机体遭受各种有害刺激(如栓塞、手术、创伤等)时,细胞中的ROS过度产生,使机体ROS的生成和清除平衡打破,自由基蓄积,抗氧化能力减弱,导致MDA堆积,引起细胞和组织损伤[18]。生理条件下,机体抗氧化防御系统主要为酶促抗氧化系统,包括SOD、CAT、GSH-Px等。其通过多种方式和途径,清除体内过多的自由基,维持机体抗氧化体系和ROS之间动态平衡,保护组织细胞的各项生理功能正常发挥[19]。研究显示[20],在肝脏缺氧时,表现为抗氧化酶基因的表达下调。本研究通过对TAE术后肝组织中SOD、CAT和GSH-Px的活性以及MDA的含量检测发现,TAE组与造影组相比,TAE组肝组织中SOD、CAT和GSH-Px的活性显著降低,MDA含量显著增加(P<0.01),表明TAE术后肝组织缺血缺氧使脂质过氧化程度加重,肝脏遭受了严重的氧化应激。
综上所述,肝癌TAE术中导管操作物理损伤、造影剂药物化学毒性反应、栓塞剂碘油堵塞血管以及多次进行TAE术治疗,引起癌旁肝组织中PPAR-α表达明显降低,抗氧化指标SOD、CAT和GSH-Px活力减低,过氧化产物MDA含量升高,导致活性氧在体内蓄积,引起氧自由基释放增多,炎症因子表达增加,炎性细胞聚集、浸润在肝组织中,损伤肝细胞,激活了一系列复杂的反应以及持续产生内源性的变化,导致肝细胞受损,肝功能下降。因此,本研究为今后肝癌TAE治疗中肝功能损伤提供了新的治疗靶点,我们可以通过预先使用PPAR-α激动剂来预防和减轻TAE治疗中的肝损伤,这具有重要的临床价值。
