注射途径对骨髓间充质干细胞在器官移植受体内分布的影响*
2019-03-26龚勇泉曹健斌韦成信李富骊黄维佳何凌云农巍伍义文罗鹏
龚勇泉, 曹健斌, 韦成信, 李富骊, 黄维佳, 何凌云, 农巍, 伍义文, 罗鹏
柳州市人民医院心胸血管外科(广西柳州 545003)
研究不同途径注射骨髓间充质干细胞(Bone marrow mesenchymal stem cells, BMSCs)后该细胞在器官移植受体内的分布和存活规律,有利于合理应用该细胞调节器官移植免疫排斥反应,在临床上有重要的意义。我们前期的研究发现,BMSCs能减轻心脏移植排斥反应,动脉途径注射BMSCs比静脉注射途径能更加显著延长移植心脏的存活时间,我们分析原因可能是BMSCs在体内的分布不同所致。对此, 2016年1—6月,我们进行了本研究课题,研究了BMSCs不同途径注射后在器官移植受体内的分布,我们将体外培养的绿色荧光(enhanced green flurorescent protein, eGFP)BMSCs(eGFP-BMSCs),经移植心脏物右心室腔内、升主动脉两种途径注射到小鼠体内,对比观察了细胞在心脏移植受体内心脏移植物、肺脏以及肝脏分布和存活规律,现报告如下。
1 材料与方法
1.1 实验动物 清洁级近交系C57小鼠,购于北京维通利华实验动物技术有限公司,共48只(n=48),周龄6~8周,体重16~24 g。eGFP转基因C57小鼠购于南京大学-南京生物医药研究院。实验中动物的使用严格遵守柳州市人民医院实验动物使用管理规定。
1.2 eGFP-BMSCs的培养 雄性eGFP-C57小鼠,断颈处死,无菌条件下取出股骨和胫骨,去除周围附着的软组织,将骨头移入干净的盛有2%FBS-PBS培养皿中,并放置于冰上。分别切除股骨和胫骨的两端,用2%FBS-PBS反复冲洗骨髓腔直至冲洗液颜色苍白,收集冲洗液,70 μm滤网过滤,1 200 r/min离心5 min,弃上清,小心吹打制成细胞悬液,细胞计数后,2×106个接种于10 cm培养皿中,加入小鼠间充质干细胞基础培养基(stemcell technilogies)10 mL,37℃、5%CO2培养箱中培养,48 h后换液除去非贴壁细胞,此后每2~3 d换液1次,在细胞达到80%融合时应用0.25%胰酶消化传代,传至第3代时,细胞可以开始用于动物实验。取生长良好的第3代细胞,胰酶消化后,分别加入荧光标记抗体CD29、CD44、CD34单克隆抗体,应用流式细胞术检测细胞表面标志表达。
1.3 小鼠颈部心脏移植模型的建立以及动物分组 使用单人双目手术显微镜(启航光学仪器凤凰显微镜),放大16倍,麻醉采用腹腔注射氯胺酮(100 mg/kg)和甲苯噻嗪(25 mg/kg)的混合液(购于柳州市人民医院药剂科),移植术前12 h动物禁食但不禁水。供体手术:小鼠麻醉成功后,手术部位备皮,将小鼠仰卧固定于自制的手术板上,正中腹部剪开,暴露下腔静脉,注入4℃肝素生理盐水1 mL(肝素浓度100 U/mL),等待1 min后横断腹主动脉和下腔静脉全身放血,延长切口,暴露心脏,局部冰泥降温,游离上腔静脉以及下腔静脉并结扎离断,尽量靠近无名动脉离断升主动脉,游离肺动脉主干,尽可能靠近肺动脉分叉处离断,6-0丝线一次集束结扎左右肺静脉、左上腔静脉,在结扎线远心端剪断,取出供心,置于预冷的生理盐水中保存。受体手术:麻醉成功后小鼠颈部备皮,右侧颈部作一反“L”形切口,切除右侧下颌腺,游离右侧颈外静脉,切除部分右侧胸锁乳突肌,显露并游离右侧颈总动脉,6-0丝线结扎阻断血管,使用10-0尼龙线将供体升主动脉与受体颈总动脉行端侧吻合,供体肺动脉与受体颈外静脉行对端吻合,先后开放颈外静脉和颈总动脉近心端阻断线,颈总动脉远心端阻断线保持结扎状态,可见血管充盈良好,心脏立即开始跳动。
1.4 实验动物分组以及细胞移植的方法 心脏移植手术成功后,受体小鼠随机分为A组和B组,每组12只。A组为动脉途径干细胞移植组,在移植心脏跳动后立即经过移植心脏升主动脉注射eGFP-BMSCs悬液30 μL(含1×106细胞);B组为静脉途径干细胞移植组,同样时间点经过移植心脏右心室腔内注射相同剂量细胞悬液,注射完毕后使用棉签压迫注射针眼止血,确认无出血后缝合皮肤切口,手术后小鼠单笼喂养,观察小鼠存活的情况。
1.5 病理学检测 分别在移植后1、3、7、14 d不同时间点处死两组小鼠,每个时间点每组各处死3只小鼠。切取移植心脏、肺以及肝组织,OCT包埋后冰冻切片,在40倍荧光显微镜下观察eGFP-BMSCs细胞在各组织中的存活情况。随机选取10个视野,计算每个视野中绿色荧光细胞的平均数目,每个时间点的绿色荧光细胞计数取3只小鼠计数结果的平均值。
2 结果
2.1 eGFP-BMSCs细胞的培养 体外培养eGFP-BMSCs生长良好,24 h能贴壁生长,48 h细胞明显增多,形态呈梭状、星形(图1)。细胞传至第7代时,荧光显微镜下观察细胞仍呈较强的绿色荧光表达(图2)。使用流式细胞检测培养的第3代BMSCs,发现CD29阳性细胞达到99%,CD44阳性细胞达到99%,CD34阳性细胞达到98%,见图3。
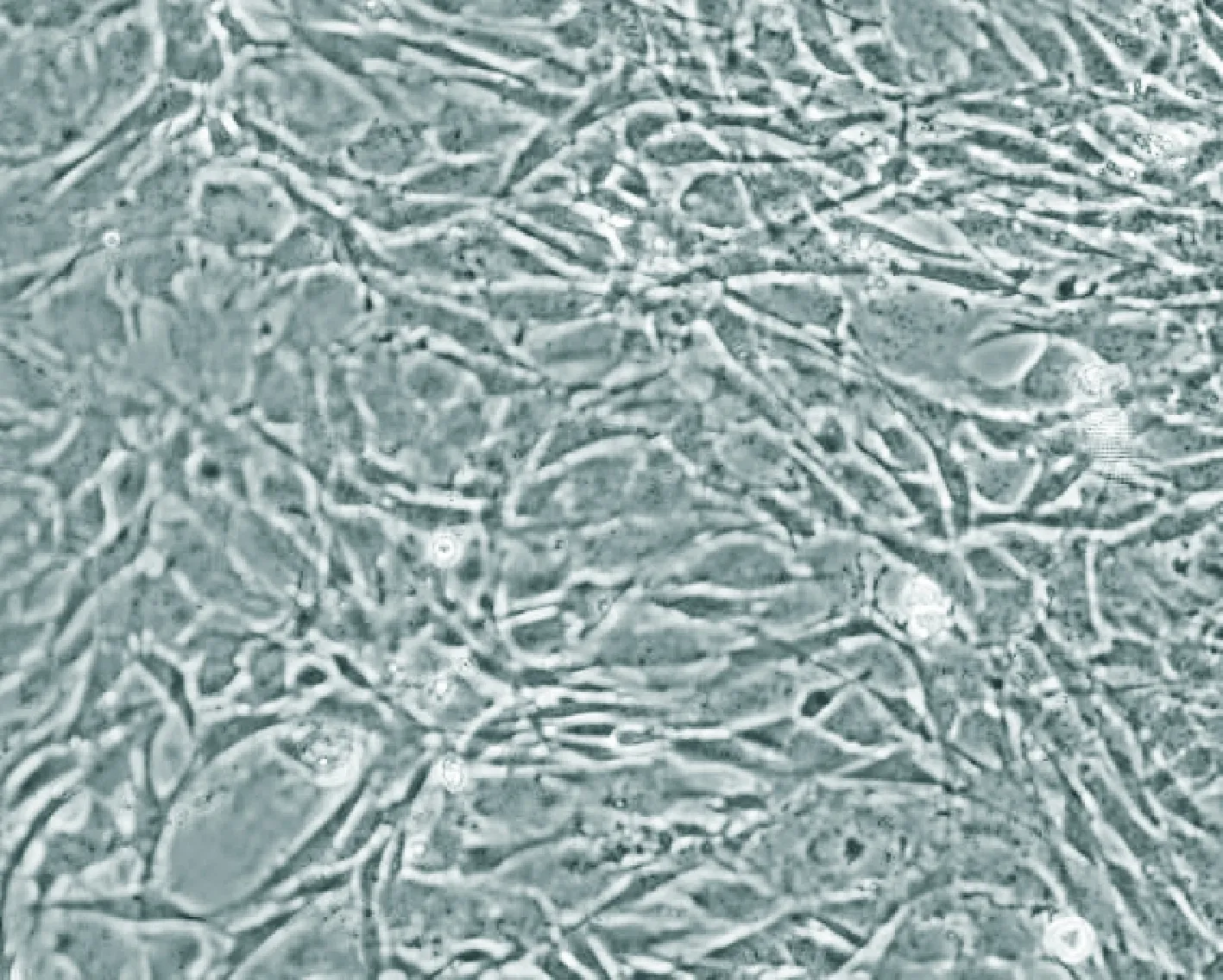
图1 第3代eGFP-BMSCs细胞形态(×40)
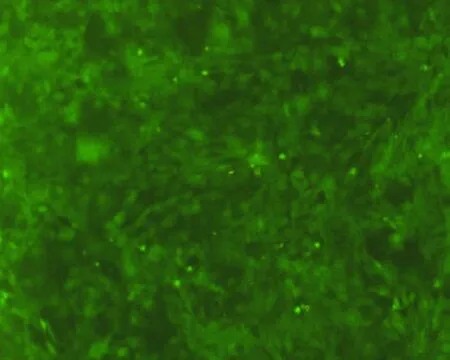
图2 第7代eGFP-BMSCs(×40)
2.2 心脏移植以及细胞移植后的结果 小鼠颈部心脏移植共进行24例,移植心脏均跳动良好,手术未见死亡。细胞移植后小鼠耐受良好,无干细胞移植后动物死亡。术后小鼠存活良好,颈部触诊心脏移植物均跳动良好。
2.3 细胞在移植心脏、肺以及肝脏内的存活情况 移植后第1天,A组和B组绿色荧光细胞主要分布于心脏移植物和肺,肝脏内未发现绿色荧光细胞,但是A组心脏移植物内的荧光细胞数明显多于B组,而肺内明显少于B组,差异均有统计学意义(P<0.01)。术后3 d,两组心脏移植物内的绿色荧光细胞对比术后第1天均减少,但A组差异无统计学意义(P>0.05),B组差异有统计学意义(P<0.05)。两组肺内的绿色荧光细胞对比术后第1天减少,差异均有统计学意义(P<0.01)。术后第3天,A组与B组之间相比,心脏移植物内的绿色荧光细胞数,A组仍大大超过B组,而肺内绿色荧光细胞数A组小于B组,差异均有统计学意义(P<0.01),见表1。细胞移植后第3天肝脏内可见绿色荧光细胞。移植术后第7天,仅A组的心脏移植物内有荧光细胞存在,A组的肺组织和肝脏以及B组的心脏移植物以及肝脏和肺内均未见绿色荧光细胞。移植术后第14天,两组的心脏移植物、肺和肝脏均未见细胞存活的迹象(图4~6)。
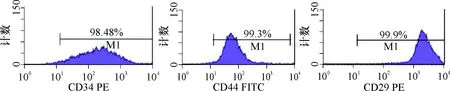
图3 流式细胞检测细胞表面标志
3 讨论
应用BMSCs减轻器官移植排斥反应具有重要的临床应用前景[1-3],研究不同注射途径移植干细胞后细胞在体内的分布和存活规律,能为干细胞在临床器官移植领域的应用提供理论依据,具有重要的意义[4]。
表1 两组不同组织中eGFP-BMSCs数目的比较个
与第1天比较*P<0.05,**P<0.01;△与B组同时间比较P<0.01
干细胞常用的移植方法有静脉注射和动脉注射。由于小鼠的静脉细,经尾静脉或者阴茎背静脉注射干细胞难度非常高[5],容易引起实验误差。我们的实验使用移植心脏右心室腔内注射的方法替代静脉注射的方法,细胞注入移植心脏右心室后顺血流方向回流进入肺动脉,通过供体的肺动脉和受体的颈外静脉吻合口,血液回流到受体的颈外静脉[6],该方法与静脉注射方法效果相同,而且在显微镜下该方法操作简单易行,显微镜直视下可以确保注射器针头在右心室腔内而不是心肌壁,注射细胞前回抽注射器,回抽有血,也可确认注射器针头在右心室心腔内。动脉注射的方法我们采用经过移植心脏升主动脉注射,细胞顺血流方向,进入移植心脏的冠脉系统,随后进入移植心脏微循环,该方法与动脉注射效果相同。
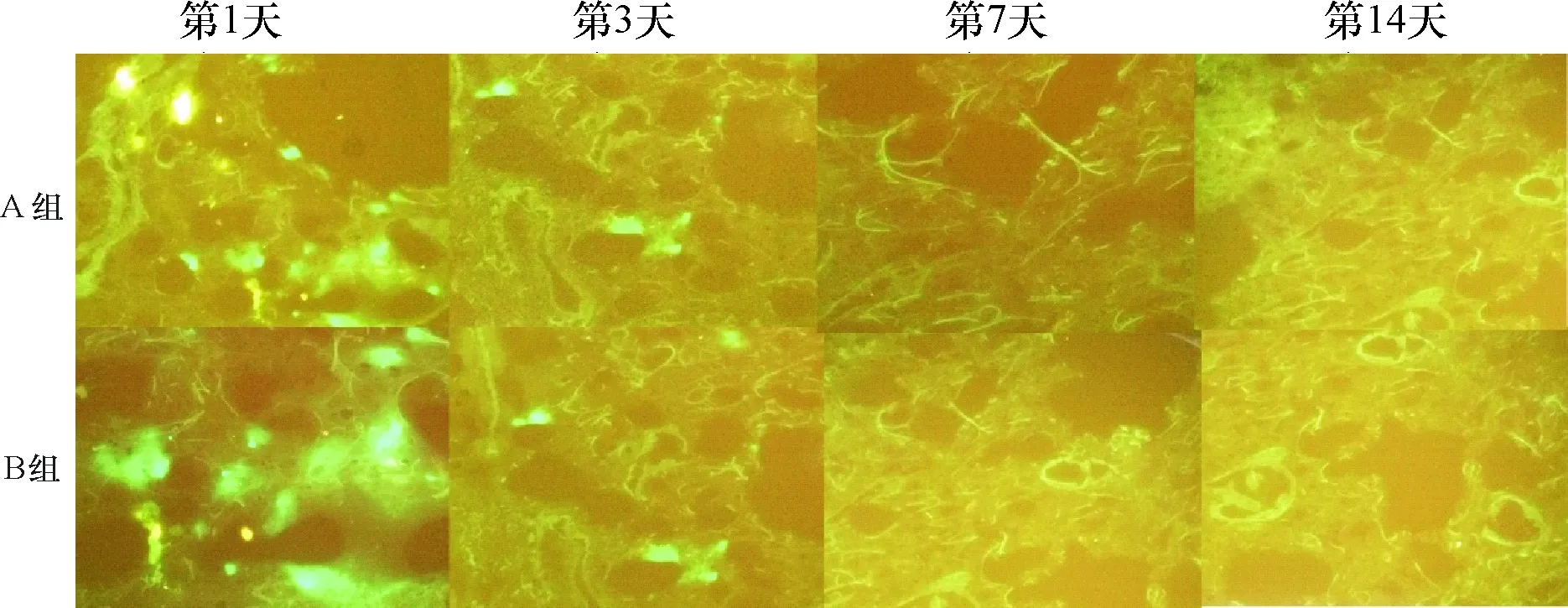
图4 荧光显微镜下A组和B组肺内绿色荧光细胞表达的典型冰冻切片(×40)

图5 荧光显微镜下A组和B组肝脏内绿色荧光细胞表达的典型冰冻切片(×40)
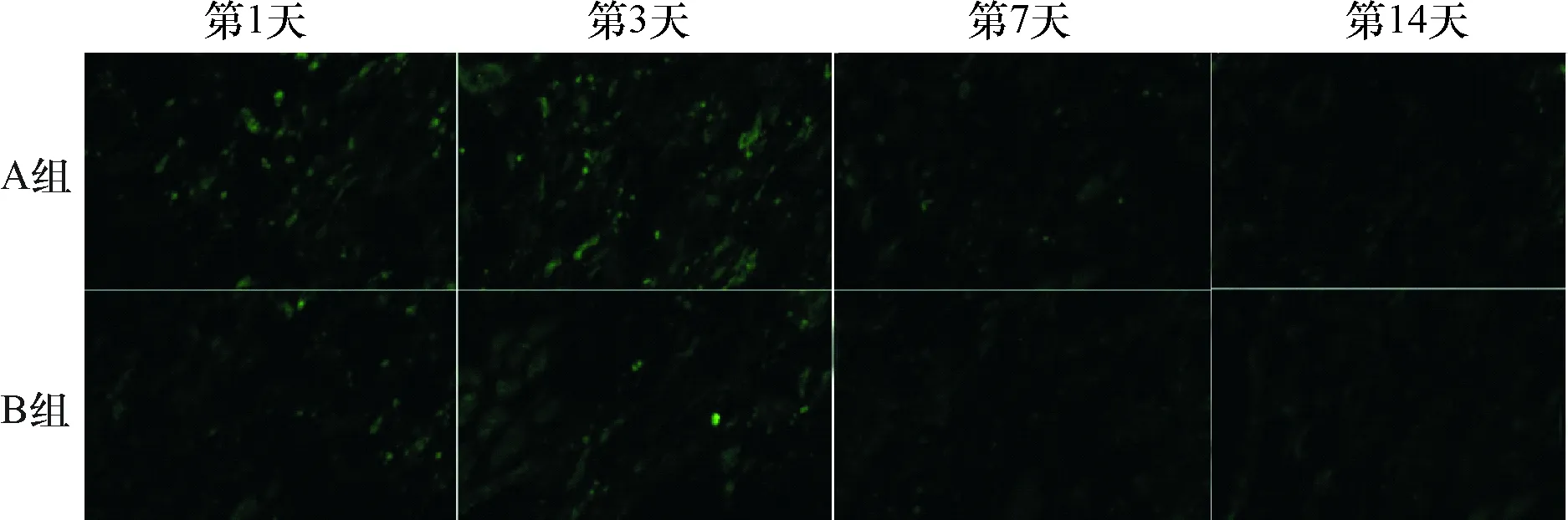
图6 荧光显微镜下A组和B组心脏移植物内绿色荧光细胞表达的典型冰冻切片(×40)
本研究发现,经过移植心脏升主动脉途径注射BMSCs后,细胞主要分布于移植心脏内。BMSCs经过动脉注射后,细胞进入移植心脏的毛细血管网,器官移植术后早期有缺血再灌注损伤,能产生趋化因子,加上血管内皮细胞受损,细胞间隙增加,同时分泌黏附分子增加,利于BMSCs进入组织内定植[7-8]。少部分BMSCs经过血液回流进入肺内,滞留于肺的毛细血管网,但是肺内的BMSC数量明显少于移植心脏。经过移植心脏右心室腔内注射BMSCs后,细胞主要分布于肺内,肺内的BMSCs数量大大超过移植心脏内的BMSCs数量,这是由于细胞经过培养后体积较大,大部分细胞滞留于肺的毛细血管网[9-10],少部分细胞进入血液循环,由于移植的心脏存在缺血再灌注损伤,能分泌趋化因子,血液循环系统内的BMSCs趋化到移植的心脏并定植[11]。
本实验中发现移植心脏内的BMSCs存活时间有限,动脉途径移植细胞存活时间不超过2周,移植心脏右心室腔内注射途径细胞存活时间约7 d,其原因是移植心脏内微环境较为恶劣,不利于BMSCs在心脏内长期存活,导致细胞死亡[12]。动脉途径移植细胞存活时间长的原因可能为动脉途径注射BMSCs后定植的细胞相对较多。对干细胞进行预处理如基因修饰[13]、低氧预处理[14-15]等方法,能改善干细胞的存活,有利于干细胞最大限度地发挥免疫调节作用。在临床器官移植领域,应用该细胞来调节免疫排斥反应,应该考虑细胞的存活时间,可以对BMSCs进行预处理,必要时可反复多次注射干细胞。
本研究发现,动脉途径较静脉途径注射BMSCs,更多的细胞聚集在移植心脏内,存活时间更久,因此动脉途径注射的方法更有利于BMSCs充分发挥免疫调节作用。但是动脉移植BMSCs需要应用介入的方法,有一定的创伤,而且动脉注射有栓子栓塞的风险。Cui以及Guzman等[16-17]报道颈内动脉内注射干细胞后能引起中风,增加了动物的病死率,其原因是栓子栓塞。我们分析可能是与移植细胞的浓度、注射的速度有关。我们的方法使用的细胞浓度是1×106/30 μL,移植前对细胞进行反复洗涤并过滤掉坏死的细胞,细胞移植时控制速度尽可能慢,经动脉途径移植BMSCs后,心脏病理学改变未见微循环栓塞的改变,说明只要注意细胞的浓度和注射速度,优化细胞的准备过程,完全可以避免栓塞并发症。
经动脉注射途径和静脉注射途径移植BMSCs后,仅术后第3天,肝脏内可见绿色荧光细胞,这是由于循环系统内的BMSCs经过肝脏微循环时被动滞留于肝脏组织,但是由于缺乏趋化因子的作用,我们分析这些细胞只是经过肝脏的微循环时被动的滞留在肝脏组织内,未能在肝脏内定植[18]。
本研究并未涉及到BMSCs在其他组织中的分布,如受体心脏、脾脏、肾脏、胸腺、淋巴结等等,我们认为由于缺乏趋化因子,干细胞趋化到这些组织中的可能性较小[19],即便细胞能够在这些组织毛细血管网滞留,由于细胞数量少、存活时间短,发挥的治疗作用有限。
总之,本研究发现,移植器官动脉注射较静脉注射BMSCs,能使更多的细胞聚集于移植器官内,存活时间更久,可能更有利于BMSCs在移植物局部发挥免疫调节作用,而静脉途径注射干细胞后细胞大量的聚集在肺内,趋化到移植器官内的干细胞较少。在临床上应用BMSCs调节免疫反应,应该考虑细胞注射途径对细胞在体内分布的影响。
