年龄和性别因素对健康成人面部皮肤细菌和真菌的影响
2019-03-26钟彩梅邓裕华周美凤赵伟峰广东省佛山市顺德区慢性病防治中心皮肤科58399南方医科大学公共卫生学院预防医学实验教学中心广州5055
钟彩梅 邓裕华 周美凤 赵伟峰广东省佛山市顺德区慢性病防治中心皮肤科 58399;南方医科大学公共卫生学院预防医学实验教学中心,广州 5055
人体皮肤表面存在大量的微生物,而微生物的存在影响了皮肤免疫系统及健康[1]。越来越多的研究[2-3]表明,年龄及性别能影响人体皮肤的健康和皮肤微生物群落的变化。年龄对人体皮肤的免疫系统有重要影响[4];然而性别也是一些皮肤疾病发生发展的影响因素,如痤疮多见于年轻男性,红斑狼疮多见于女性。另外,疾病的发生和发展,如银屑病等免疫相关疾病,与皮肤微生物的变化息息相关[5-6]。逐渐增多的证据[5-8]也表明,皮肤微生物对皮肤免疫系统有免疫调节作用,并能影响疾病发展。目前,已有一些研究通过细菌16S rRNA测序分析了皮肤微生物组成与年龄、性别间的关系[3,9-10],但由于不同菌种间16S rRNA具有较高的同源性且该分析只能精确到菌属水平,故不能更准确地分析年龄和/或性别因素如何影响皮肤微生物群落的变化。我们通过宏基因组测序分析年龄和性别对面部皮肤细菌和真菌的影响。
对象与方法
一、研究对象
所有研究对象均为2017年6月至2018年6月于广东省佛山市顺德区慢性病防治中心皮肤科门诊招募的无面部皮肤疾病的志愿者。纳入标准:①面部无炎症性表现(即红、肿、热、痛等);②在知情的情况下签署知情同意书。排除标准:①患有免疫性皮肤病,如系统性红斑狼疮、银屑病、天疱疮等;②患有身体其他部位的皮肤疾病可能影响或累及面部;③有吸烟史,近1个月内面部使用过抗生素、维A酸类、糖皮质激素等药物;④妊娠期及哺乳期;⑤有高血脂、肝肾功能异常等系统性疾病;⑥近1个月内无面部手术或美容治疗。按上述标准共招募36例志愿者(跖疣8例、胼胝9例、足癣10例、汗疱疹5例及甲癣4例),包括16例年轻志愿者(男9例,女7例)和20例老年志愿者(男女各10例);年轻组年龄24~31(27.1±1.3)岁,老年组年龄61~84(75.8±2.2)岁。本研究经佛山市顺德区慢性病防治中心伦理委员会及中山大学中山眼科中心伦理委员会批准(2015MEKY011)。
二、皮肤微生物样品的采集
采用无菌有齿镊夹住无菌MF滤膜(型号REF:HAWP01300,直径0.45 μm;美国Merck Millipore公司)紧贴面颊部皮肤表面来回摩擦5~10次。随即将此MF滤膜放入含有1 μl蛋白酶K和300 μl组织和细胞裂解液(两者均来自MasterPure DNA and RNA Purification Kit,英国Epicentre公司)的无菌Eppendorf管中。样品保存于-80℃冰箱待用。
另外,设立6个阴性对照,即含有未接触皮肤的无菌MF滤膜及1 μl蛋白酶K和300 μl组织和细胞裂解液的无菌Eppendorf管,依据MasterPure DNA and RNA Purification Kit说明提取DNA。此外,分析文献[11]中测序数据,主成分1(principal component 1,PC1)=46.93%,PC2=22.23%,人体两侧面部皮肤微生物的β多样性差异无统计学意义(t=1.161,P=0.300),故采样时面部两侧皮肤均有涉及。
三、DNA提取及宏基因组测序
皮肤微生物DNA的提取采用MasterPure DNA and RNA Purification Kit(英国Epicentre公司)。通过超声碎裂仪(比利时Diagenode公司)将总量约100 ng DNA碎裂成长度为300~400 bp的DNA片段;然后,通过KAPA LTP文库纯化试剂盒(美国Kapa Biosystems公司)进行DNA测序文库的构建。使用HiSeq PE Cluster V4试剂盒和HiSeq SBS V4 250 cycle试剂盒(美国Illumina公司)在IlluminaHiSeq 2500测序仪上对DNA文库进行双端测序。测序结束后利用软件CASAVA v1.8.2(美国Illumina公司)对原始数据进行Fastq格式转换。测序工作由中山大学中山眼科中心魏来教授课题组完成。
四、测序数据分析
采用软件FastQC、Cutadapt、Fastx、PrinSeq对测序数据进行质控分析,在最终得到的高质量数据中用软件HiSAT2(v2.0.1)和DeconSeq去除人的数据,得到不含宿主数据的高质量微生物数据。采用序列比对软件 Burrows-Wheeler Aligner(BWA)0.7.5a在通用微生物数据库中比对该高质量微生物数据,对成功匹配的微生物基因组进行菌种注释,并采用RPKM法标准化计算微生物相对丰度。采用Mothur软件计算Shannon指数(Shannon index)以评估微生物α多样性。微生物KEGG代谢途径的重建及其丰度的分析采用软件HMP Unified Metabolic Analysis Network(HUMAnN2),计算微生物总体代谢途径的相对丰度,以反映代谢途径的活跃程度。此外,采用R软件(v3.4.3)中Ade4程序进行基于菌种相对丰度的主成分分析(principal component analysis,PCA),计算PC1和PC2在组间的权重,并通过比较组间PC1的坐标值,反映组间物种的种类和相对丰度的差异,以评估β多样性。采用Lefse程序计算组间差异微生物的相对丰度,通过线性判别分析(linear discriminant analysis,LDA)获得各组具有代表性且差异显著的菌种,以LDA分值的大小反映组间各物种的差异大小。
五、统计学分析
采用SPSS 17.0软件处理。计量数据若符合正态分布,以±s表示,并采用两独立样本t检验分析;若不符合正态分布,则以中位数M(P25,P75)表示,并采用Wilcoxon秩和检验分析。PCA分析中,采用两独立样本t检验比较PC1。采用R软件(v3.4.3)进行Pearson相关性分析,计算LDA分析获得的有差异的细菌和真菌相对丰度的相关性。相关系数r取绝对值后,如0≤r<0.1为无相关性,0.1≤r<0.3为弱相关,0.3≤r<0.5为中等相关,0.5≤r<1.0为强相关。P<0.05为差异有统计学意义。
结 果
一、宏基因组测序分析健康成人面部皮肤微生物数据
分析36例志愿者面部皮肤微生物数,单样本总测序reads数目为16.4 M~27.8 M,其中大部分数据来源于宿主人,但每个样品可获得2.8 M~5.1 M高质量微生物reads,占总测序reads数目的17.2%~18.6%。对6个阴性对照的测序样品进行文库构建、测序及分析显示,对照数据均为重复、无效或低质量的数据,且未获得足够可用于分析的微生物数据,因此该数据未展示。
分析排除人数据后的高质量微生物reads数据显示,微生物数据主要为细菌来源(93.69%±1.02%),而真菌和病毒数据仅分别占5.45%±1.09%和0.86%±0.13%。细菌主要以痤疮丙酸杆菌为主(图1A),而真菌以球形马拉色菌为主(图1B)。
二、年龄影响面部皮肤微生物群落多样性及其代谢途径
老年组面部皮肤细菌群落的α多样性(Shannon指数0.98±0.07)显著高于年轻组(0.72±0.09,t=2.201,P=0.035),见图2A。PCA分析显示,年龄也能显著影响面部皮肤细菌群落的β多样性(PC1:老年组-1.256±0.349,年轻组1.591±0.116,t=6.991,P< 0.001),见图2B。此外,选取相对丰度≥1%的细菌进行差异及相关性分析,痤疮丙酸杆菌及球形马拉色菌相对丰度年轻组(91.29%±1.71%、75.69%±3.97%)均显著高于老年组(74.87% ±4.38%、52.31% ±2.72%;t=3.101、5.004,P=0.004、< 0.001),且与年龄呈负相关(r=-0.51,P=0.002);而老年组面部皮肤绿脓假单胞 菌(Pseudomonas aeruginosa,t=3.998,P<0.001)、藤黄微球菌(t=2.359,P=0.033)、野油菜黄单胞菌(t=3.003,P=0.005)、食酸丛毛单胞菌(t=4.510,P< 0.001)、大肠埃希菌(t=4.332,P<0.001)、施氏假单胞菌(t=2.222,P=0.033)、人苍白杆菌(t=3.525,P=0.001)、鲍氏不动杆菌(t=5.124,P< 0.001)、恶臭假单胞菌(t=3.825,P<0.001)、致黑嗜热菌(t=5.754,P<0.001)和伯氏食酸菌(t=4.623,P<0.001)的相对丰度均显著高于年轻组(图2D),且这些细菌的相对丰度与年龄呈正相关(r=0.79、0.56、0.71、0.75、0.80、0.75、0.83、0.71、0.68、0.81、0.83,均P< 0.001)。
此外,年龄因素还会影响面部皮肤真菌群落的结构。老年组面部皮肤真菌的α多样性(Shannon指数1.11±0.05)显著高于年轻组(0.81±0.05,t=3.836,P<0.001),见图2A。PCA分析显示,面部皮肤真菌群落的β多样性亦受到年龄因素的影响(PC1:老年组-2.006±0.234,年轻组2.508±0.323,t=11.591,P<0.001),见图2C。选取相对丰度 ≥1%的真菌进行差异及相关性分析,年轻组球形马拉色菌(t=5.004,P<0.001)和费氏新萨托菌相对丰度(t=3.068,P=0.004)显著高于老年组,且这两种真菌丰度与年龄呈负相关(r=-0.63、-0.48,P<0.001、=0.004);而老年组莱布尔氏菌(Albugo laibach,t=3.823,P< 0.001)、黄曲霉菌(t=13.46,P<0.001)、柄篮状菌(t=4.629,P<0.001)和马尔尼菲塔拉霉菌相对丰度(t=2.479,P=0.018)更高,且与年龄呈正相关(r=0.57、0.86、0.60、0.41,均P<0.05),见图2E。
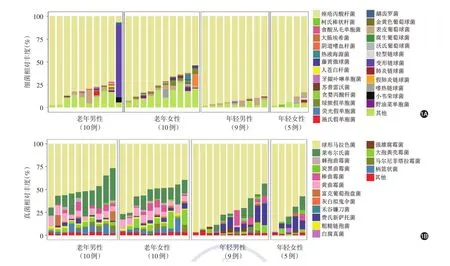
图1 宏基因组测序分析不同年龄及性别健康志愿者面部皮肤微生态结构 1A:各样品中细菌的相对丰度以痤疮丙酸杆菌为主;1B:各样品中真菌的相对丰度以球形马拉色菌为主
LDA分析得到一些具有代表性的菌种,老年组20种细菌、17种真菌的相对丰度高于年轻组,而年轻组仅痤疮丙酸杆菌和6种真菌的相对丰度高于老年组,见图3A、3B。
老年组细菌代谢途径的活跃程度明显低于年轻组(t=1.995,P=0.020),见图4A。同时,HUMAnN2软件计算KEGG代谢途径数据显示,年轻组真菌基因的相对含量(0.000 427%±0.000 050%)显著高于老年组(0.000 272%±0.000 048%,t=5.058,P<0.001),见图4B。年轻组真菌代谢途径活跃程度亦显著高于老年组(0.000 263±0.000 103比0.000 065±0.000 026,t=2.464,P=0.025),其中分支酸合成途径(t=3.810,P=0.002)、戊糖磷酸途径(t=2.341,P=0.033)、乙酰辅酶A合成(t=3.093,P=0.007)、二磷酸鸟苷-甘露糖生物合成(t=3.077,P=0.077)、核糖体生物合成(t=3.344,P=0.004)、有氧呼吸途径Ⅰ(t=5.088,P<0.001)等代谢途径在年轻组中的活跃程度显著高于老年组,见图4B。
三、性别因素对面部皮肤微生物群落的影响
忽略年龄因素,细菌群落的α多样性(Shannon指数:男性组0.83±0.08,女性组0.92±0.09,t=0.801,P=0.430;图5A)和真菌群落的α 多样性(Shannon指数:男性组0.92±0.06,女性组1.04±0.05,t=1.332,P=0.192;图5A)及β多样性(PC1:男性组0.159±0.577,女性组-0.224±0.639,t=0.439,P=0.663;图5B)均未受到性别影响,但细菌群落的β多样性受性别因素影响(PC1:男性组0.521± 0.319,女性组-0.659± 0.559,t=2.149,P=0.020;图5C)。同时,细菌(男性组:0.000 076±0.000 015,女性组:0.000 091 ± 0.000 015,t=0.895,P=0.378)和真菌(男性组:0.000 098±0.000 021,女性组:0.000 109 ± 0.000 022,t=0.483,P=0.631)的代谢途径也未受到性别因素的影响。LDA分析显示,男性与女性组间少数细菌的相对丰度不同(表1),其中女性组面部皮肤绿脓假单胞菌、嗜热链球菌、鲍氏不动杆菌、伯氏食酸菌、嗜麦芽窄食单胞菌、乳酸乳球菌、皮氏罗尔斯顿菌、肺炎克雷伯菌、阴沟肠杆菌、嗜酸乳杆菌、嗜热栖热菌相对丰度更高(均P<0.05),而男性组施氏假单胞菌和耳毛棒状杆菌相对丰度更高(均P<0.05);LDA分析男女两组间真菌相对丰度差异无统计学意义(均P>0.05)。
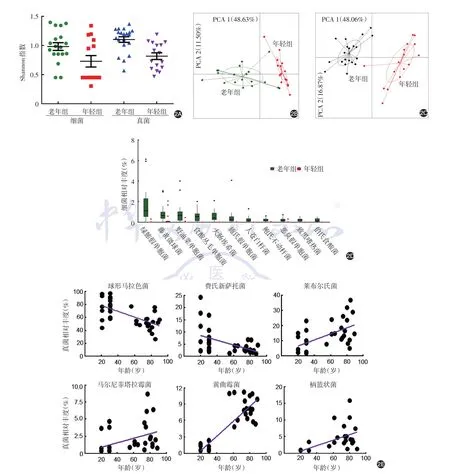
图2 年龄对健康人面部皮肤微生物多样性及相对丰度的影响 2A:Shannon指数显示,年龄因素可同时影响细菌和真菌群落的α多样性;2B、2C:主成分分析法(PCA)比较老年组与年轻组细菌和真菌群落的种类及相对丰度差异,显示年龄因素可同时影响细菌和真菌群落的β多样性;2D:对相对丰度≥1%的细菌进行不同年龄组相对丰度差异分析,显示老年组12种细菌相对丰度显著高于年轻组(由于痤疮丙酸杆菌相对丰度明显高于以上各菌种,故未能在图中标出);2E:Pearson相关分析显示,球形马拉色菌、费氏新萨托菌相对丰度与年龄呈负相关,而莱布尔氏菌、黄曲霉菌、柄篮状菌和马尔尼菲塔拉霉菌相对丰度与年龄呈正相关
老年男性组与老年女性组、年轻男性组与年轻女性组间皮肤细菌群落β多样性差异有统计学意义(t=2.255、1.954,P=0.019、0.035),而真菌群落β多样性差异无统计学意义(t=1.050、0.705,P=0.154、0.246);老年女性组与年轻女性组、老年男性组与年轻男性组间细菌和真菌β多样性差异均有统计学意义(细菌:t=5.673、4.432,均P< 0.001;真菌:t=7.873、8.540,均P< 0.001),见图5D、5E。
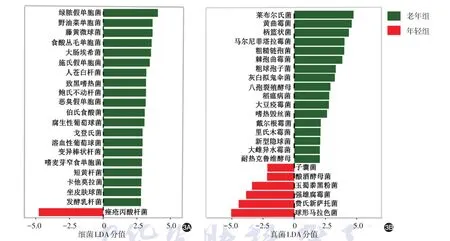
图3 线性判别分析(LDA)比较老年组与年轻组间健康面部细菌和真菌的差异 采用Lefse程序计算微生物相对丰度,通过LDA获得组间差异显著的皮肤微生物。3A:老年组20种细菌的相对丰度高于年轻组,而年轻组仅痤疮丙酸杆菌的相对丰度高于老年组;3B:老年组17种真菌的相对丰度高于年轻组,而年轻组仅6种真菌的相对丰度高于老年组
四、微生物之间相互影响、相互制约
相关性分析显示,细菌与细菌、真菌与真菌,细菌与真菌之间既存在正相关关系,也存在负相关关系。其中,痤疮丙酸杆菌与绿脓假单胞菌在老年女性组、年轻女性组和年轻男性组中呈强负相关(均P<0.05),与表皮葡萄球菌仅在年轻女性和年轻男性组中呈强负相关(均P<0.01);球形马拉色菌与莱布尔氏菌在4组中均呈负相关(均P<0.01)。细菌与真菌之间的相互关系依旧存在,如金黄色葡萄球菌与马尔尼菲塔拉霉菌在年轻男性和年轻女性组中均呈弱负相关(均P<0.05),而与黄曲霉菌在年轻女性组中亦呈弱负相关(P<0.001);绿脓假单胞菌与马尔尼菲塔拉霉菌在老年女性组中呈强正相关(P<0.001),在年轻女性组中呈强负相关(P<0.01),在老年男性组和年轻男性组中无相关性(均P>0.05)。见表2。
讨 论
目前许多研究通过16S测序分析探讨年龄和/或性别对健康皮肤细菌群落变化的影响[2-3,9],由于不同细菌种属间16S序列有较高的同源性,因此16S测序分析只能定位到菌属水平;而且在RDP数据库(http://rdp.cme.msu.edu/)中[12],序列评估可信度≥80%才能确定细菌的菌属。目前,国内外尚无通过18S rRNA或宏基因组分析年龄或性别因素对皮肤真菌群落影响的研究。因此,我们通过宏基因组测序,在菌种水平探讨年龄和/或性别因素对健康面部皮肤细菌群落的影响。

图4 年龄对健康人面部皮肤微生物代谢途径的影响 4A:老年组细菌代谢途径的相对含量明显低于年轻组;4B:部分真菌代谢途径在年轻组中的相对含量高于老年组(均P<0.05)

图5 性别对健康人面部皮肤微生物α和β多样性的影响 5A:男女性组间细菌、真菌群落的α多样性(Shannon指数)均无明显差异;5B:性别因素不影响真菌群落的β多样性;5C:性别因素影响细菌群落的β多样性;5D、5E:主成分分析(PCA)比较年轻男性组、老年男性组、年轻女性组和老年女性组间的细菌、真菌群落β多样性,显示性别因素仅影响细菌群落β多样性,而年龄因素影响细菌和真菌群落β多样性
表1 线性判别分析比较男性组与女性组面部皮肤细菌群落相对丰度的差异[%±s或M(P25,P75)]
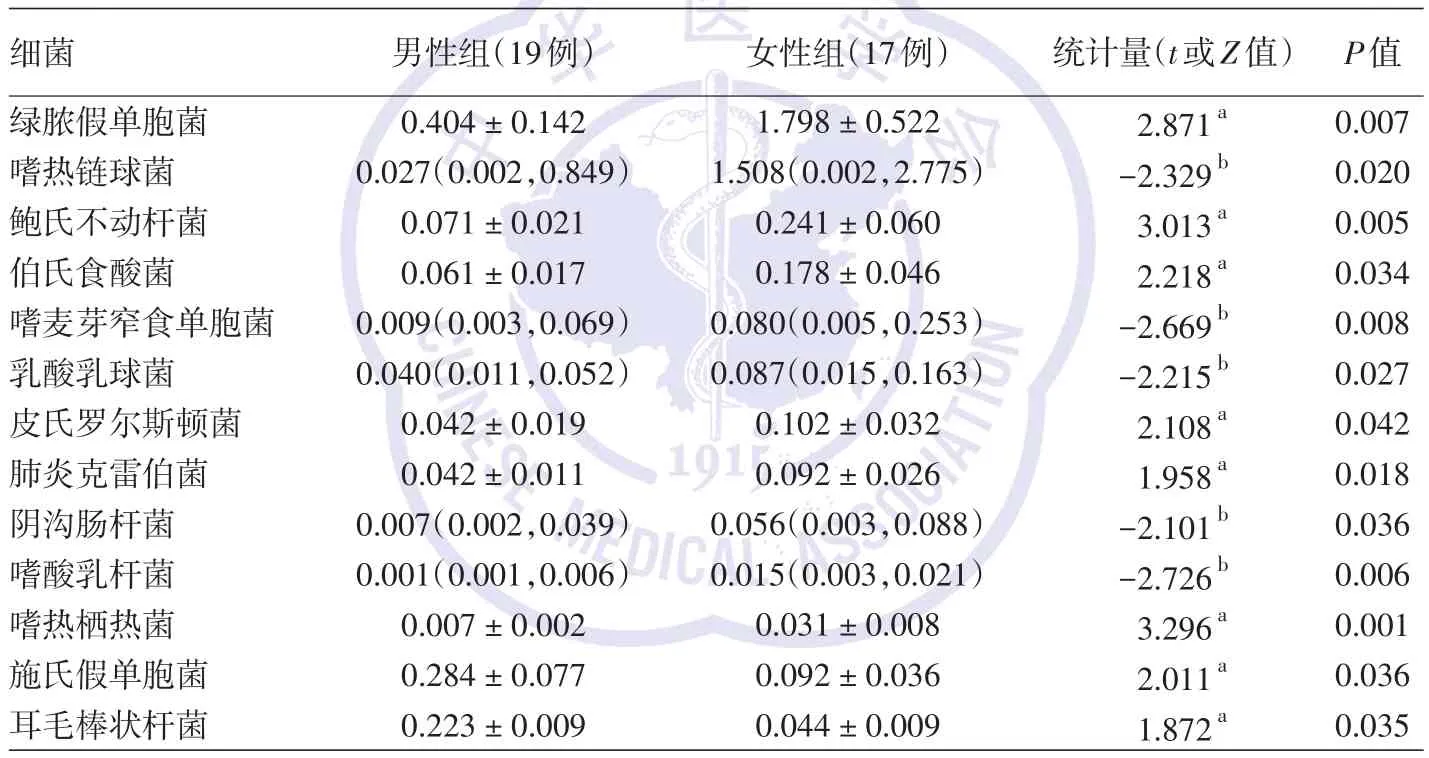
表1 线性判别分析比较男性组与女性组面部皮肤细菌群落相对丰度的差异[%±s或M(P25,P75)]
注:a两独立样本t检验计算出的t值;bWilcoxon秩和检验计算出的Z值
细菌绿脓假单胞菌嗜热链球菌鲍氏不动杆菌伯氏食酸菌嗜麦芽窄食单胞菌乳酸乳球菌皮氏罗尔斯顿菌肺炎克雷伯菌阴沟肠杆菌嗜酸乳杆菌嗜热栖热菌施氏假单胞菌耳毛棒状杆菌男性组(19例)0.404±0.142 0.027(0.002,0.849)0.071±0.021 0.061±0.017 0.009(0.003,0.069)0.040(0.011,0.052)0.042±0.019 0.042±0.011 0.007(0.002,0.039)0.001(0.001,0.006)0.007±0.002 0.284±0.077 0.223±0.009女性组(17例)1.798±0.522 1.508(0.002,2.775)0.241±0.060 0.178±0.046 0.080(0.005,0.253)0.087(0.015,0.163)0.102±0.032 0.092±0.026 0.056(0.003,0.088)0.015(0.003,0.021)0.031±0.008 0.092±0.036 0.044±0.009统计量(t或Z值)2.871a-2.329b 3.013a 2.218a-2.669b-2.215b 2.108a 1.958a-2.101b-2.726b 3.296a 2.011a 1.872a P值0.007 0.020 0.005 0.034 0.008 0.027 0.042 0.018 0.036 0.006 0.001 0.036 0.035

表2 健康人面部皮肤表面细菌与细菌或真菌之间的相互关系
本研究结果显示,健康人面部皮肤表面主要的细菌属和真菌属分别为丙酸杆菌属和马拉色菌属,与已有研究结果相似[2-3,13]。丙酸杆菌属以痤疮丙酸杆菌为主,而马拉色菌属以球形马拉色菌为主,它们均为皮肤正常的共生菌,在维持皮肤健康微生态结构中起重要作用。有研究者[14-15]指出,痤疮丙酸杆菌可产生丙酸,调节皮肤表面的酸碱度,并可抑制致病性金黄色葡萄球菌和其他丙酸杆菌属细菌的生长;同时,痤疮丙酸杆菌还可诱导皮肤角质形成细胞发生自噬,促进细胞去除胞内无功能的线粒体,提高细胞的生存效率,从而维持皮肤的自我平衡[16]。球形马拉色菌除了是皮肤正常菌群外,也是其他组织如鼻窦中的常见菌群[17]。有研究[18]显示,该菌可通过分泌蛋白酶的方式减少金黄色葡萄球菌生物膜形成。可见,痤疮丙酸杆菌和球形马拉色菌在一定程度上有利于人体皮肤的健康。然而,本研究结果显示,这2种微生物受到年龄因素的影响,其在健康面部皮肤表面的相对丰度随着年龄的增加而减少,而一些病原细菌(如绿脓假单胞菌、大肠埃希菌、施氏假单胞菌和人苍白杆菌)和病原真菌(如黄曲霉菌、马尔尼菲塔拉霉菌)在面部皮肤上的相对丰度则随着年龄的增加而增加。究其原因,除了与年龄的增长、人体免疫力下降有关外,可能还与皮肤微生物间相互影响、相互制约关系的变化有关。微生物间相关性分析显示,痤疮丙酸杆菌与绿脓假单胞菌、金黄色葡萄球菌呈强负相关关系;球形马拉色菌与马尔尼菲塔拉霉菌、莱布尔氏菌亦呈中等强度以上的负相关关系。当皮肤上痤疮丙酸杆菌和球形马拉色菌的相对含量减少时,致病菌受到的抑制作用减弱,其相对含量可能升高。但无论我们处于哪个年龄阶段,健康的皮肤微生态结构是维护健康皮肤的重要因素之一。
年龄因素同时影响细菌和真菌群落的α和β多样性,但性别因素仅影响细菌群落的β多样性。此外,一些病原菌如绿脓假单胞菌、肺炎克雷伯菌、阴沟肠杆菌、施氏假单胞菌的相对丰度在男女性组间存在差异,提示性别因素对面部菌群结构及皮肤健康的影响也不容忽视。比如,系统性红斑狼疮多见于女性,其不同的疾病表型又可影响皮肤细菌在皮肤上的含量,如金黄色葡萄球菌在健康男性皮肤中的检出率较女性高,而系统性红斑狼疮女性患者的金黄色葡萄球菌检出率则高于男性[19-20]。
此外,年龄不仅影响了皮肤细菌和真菌的群落结构,也影响其代谢途径。老年组细菌和真菌代谢途径的活跃程度均较年轻组低,这可能提示老年个体的皮肤免疫能力较年轻个体弱[21-23]。有研究[24]显示,肠道微生物与宿主肠道免疫细胞之间通过彼此的代谢产物相互影响、相互调节,共同维护健康、完整的小肠屏障功能。因此,我们推测皮肤表面的大量微生物与皮肤免疫细胞之间亦存在类似肠道的相互调节机制。即使年龄差异导致这种调节机制存在一定差异,但只要皮肤正常微生物和皮肤免疫系统之间的动态平衡未被打破,亦可形成一道天然屏障,抵御外源性病原体的入侵。
综上所述,我们通过宏基因组数据分析阐述了年龄和性别因素对皮肤细菌和真菌的影响,为后续分析和探讨皮肤疾病与皮肤微生物群落之间的关系奠定一定的理论基础,从而更好地了解皮肤疾病的发病机制。但本研究尚存在一些不足,如各组样本量偏少,组间年龄差距明显,缺乏环境影响因素等,有待我们今后进一步细化各种影响因素探讨微生物与皮肤疾病的发病机制。
