DTT诱导线粒体应激引起胶质瘤细胞凋亡的机制研究
2019-03-26周子荐沈璐妍刘远达全成实
周子荐,沈璐妍,刘远达,全成实*
(1.吉林大学 临床医学院,吉林 长春130021;2.吉林大学 基础医学院病理生理学系; 3.吉林大学第二医院 胃肠营养及疝外科)
研究表明,胶质瘤细胞对化疗药的敏感性与其细胞内部发生的内质网应激有着十分密切的关联[1]。在化疗药物的作用下,肿瘤细胞内质网稳态受到破坏,蛋白质无法折叠或错误折叠,引起内质网应激[2]。DTT(二硫苏糖醇)是一种内质网应激诱导剂,可阻止蛋白质中的半胱氨酸残基的氧化,干扰PDI(二硫键异构酶)在蛋白质二硫键形成中的催化作用,导致错误折叠的蛋白大量堆集[3],从而诱发内质网应激。因此,本实验选用DTT诱导脑胶质瘤细胞系SHG44产生内质网应激,并进行线粒体应激相关指标、线粒体ROS水平和细胞凋亡蛋白检测。
1 材料与方法
1.1细胞、主要试剂与仪器人脑胶质瘤细胞系SHG44,购于上海子实生物公司。二硫苏糖醇(DTT)购自北京coolaber公司,Caspase-3 活性检测试剂盒购自上海碧云天公司。GRP78蛋白抗体购自proteintech公司;CHOP购自abcam公司;β-actin、PDI、HSP10、HSP60、ClpP、LON、Htr A2/Omi抗体、HRP标记的山羊抗兔IgG二抗和HRP标记的山羊抗小鼠IgG二抗购自Santa Cruz公司。
1.2实验方法
1.2.1细胞培养及处理 细胞培养:使用10%胎牛血清的低糖DMEM培养基置于37℃,5%CO2细胞培养箱中培养,保持饱和湿度。细胞培养每3天进行一次传代,细胞使用0.01M PBS冲洗一次,0.25%胰酶细胞消化,并按照1∶3的比例进行传代。药物处理:取对数期生长细胞,设置空白对照组和实验组,实验组采用DTT(5 μmol/ml)分别处理3 h,6 h,12 h及24 h。
1.2.2MTT比色法检测 96 孔板接种为1.0×104细胞/孔,细胞用含10%小牛血清的正常培养液混匀,每孔终体积为100 μl,5% CO2、37℃培养箱孵育过夜。设置3个阴性对照组,每个实验组设3个复孔,按实验所需加药物处理,每孔终体积为100 μl。到作用时间点结束后,再往每孔加入10 μl MTT,孵育4-6 h后弃去培养液,每孔加入150 μl DMSO。孔板在平板振荡器上振荡 5-10 min。酶标仪490 nm波长测取吸光度值,记录结果,计算抑制率或存活率。
1.2.3细胞线粒体ROS水平检测 细胞接种于6孔板上,分组处理同1.2.1。以1∶1000 Mito-SOX Red染色30 min,消化、收集细胞,充分洗涤后用流式细胞仪检测。
1.2.4Western Blot 消化、收集处理的细胞,加入RIPA细胞裂解液,裂解充分后以14 000 g、4℃离心20 min,取上清为细胞总蛋白,采用BCA试剂盒进行蛋白浓度定量后,使用裂解液调平后,按照1∶4体积比例加入5×Loading Buffer,100℃煮沸 10 min。根据BCA蛋白定量结果计算样品的上样量,每孔总蛋白25 μg,选用12% SDS-PAGE凝胶和Tris-甘氨酸电泳缓冲液电泳,室温稳压100V电泳。采用湿转法将蛋白转于PVDF膜上,室温下5%脱脂奶粉封闭摇床2 h,TBST洗膜,加入按要求稀释的对应的单克隆抗体,4℃封闭孵育过夜。TBST洗膜,加入二抗室温摇床孵育2 h,TBST洗膜后,发光、凝胶成像系统拍照,结果采用Quantity One软件进行量化分析。
1.2.5Caspase 3活性检测 使用碧云天公司的Caspase-3活性检测试剂盒,按照试剂盒提供的说明书操作规范步骤,检测细胞裂解液中Caspase-3酶活性。

P<0.05表示差异有统计学意义。
2 结果
2.1DTT对脑胶质细胞瘤系SHG44细胞活性及凋亡的影响
实验结果如图1,通过MTT法检测DTT对细胞增殖能力的影响,研究发现高浓度的DTT可以抑制胶质瘤细胞增殖能力;凋亡执行蛋白Caspase-3活性逐渐上升(P<0.05)。
2.2DTT对脑胶质瘤内质网应激相关蛋白的影响
与对照组相比,PDI表达量较对照组逐步下降(P<0.05),GRP78/Bip的表达有显著升高,且表达的升高呈时间依赖性(P<0.05);CHOP表达水平相对于对照组随药物处理时间延长逐渐上升(P<0.05),如图2。
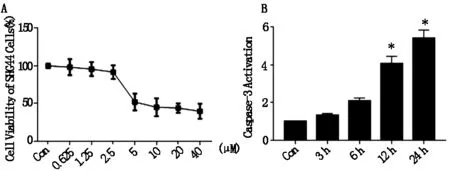
A:MTT检测结果量化图;B:Caspase 3活性检结果量化图(*表示与con组相比,具有统计学意义,*P<0.05)。
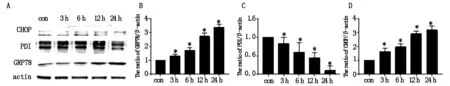
A:内质网应激相关蛋白Western blot条带图;B:GRP78蛋白水平量化图;C:PDI蛋白水平量化图;D:CHOP蛋白水平量化图(*表示与con组相比,具有统计学意义,*P<0.05)。
2.3DTT对脑胶质瘤线粒体内ROS及线粒体应激相关蛋白的影响
实验结果显示,线粒体内部ROS水平呈时间依赖性升高(P<0.05),如图3。与对照组相比,热休克蛋白10在3 h表达量最高,随后表达逐渐下降。热休克蛋白60以及蛋白水解酶LON,ClpP等与对照组相比都呈现出逐渐上升趋势(P<0.05),在到6 h达高峰后表达开始逐渐下降。且以上热休克蛋白,蛋白水解酶在24 h组表达水平均低于对照组的表达量(P<0.01)。Omi的表达量则逐渐下降(P<0.01),如图4。
3 讨论
脑胶质瘤作为成人中枢系统最常见的恶性肿瘤,具有极高的侵袭性,手术难以将其彻底清除。胶质瘤的较强的增殖能力使其常常处于缺氧、营养缺乏等多种不利环境中,为应对这些不利因素,胶质瘤细胞会启动各类应激反应来重建细胞稳态[4]。近年来发现,内质网应激可通过激活未折叠蛋白反应的ATF6,IRE1和 PERK信号通路参与肿瘤化疗药物的耐药机制[5]。然而过度的内质网应激也可以激活PERK-eIF2α-ATF4信号途径下游分子CHOP的表达增加,增加凋亡基因表达,促使细胞凋亡[6]。

A:对照组;B:DTT处理3 h后;C:DTT处理6 h后;D:DTT处理12 h后
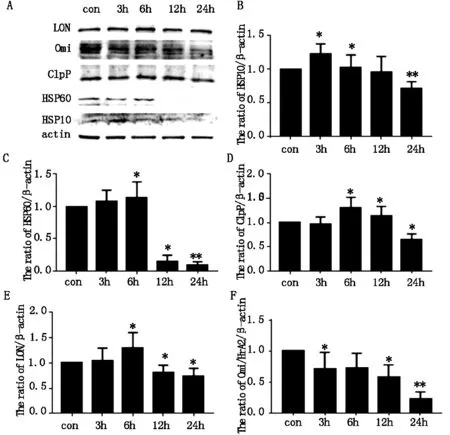
A:线粒体应激相关蛋白Western blot条带图;B:HSP10蛋白水平量化图;C:HSP60蛋白水平量化图;D:ClpP蛋白水平量化图;E:LON蛋白水平量化图;F:Omi蛋白水平量化图(*表示与con组相比,具有统计学意义,*P<0.05,* *P<0.01)。
在本研究中,随着DTT处理SHG44细胞时间的增加,PDI的水平逐渐下降(图2 C)。内质网应激标志性蛋白GRP78的表达逐渐增加(图2 A)。表明DTT抑制了PDI表达,干扰了内质网中蛋白二硫键形成,进而诱导了内质网应激。同时随着DTT处理时间的延长,信号通路PERK-eIF2α-ATF4下游分子CHOP的表达在逐渐上升(图2 C),凋亡蛋白Caspase-3的活性也逐渐升高(图1 A)。由此可见,DTT可诱导脑胶质瘤细胞产生内质网应激,并可通过激活CHOP表达,诱导细胞凋亡。
内质网与线粒体不仅存在物理上的连接,两者在Ca2+信号传递、脂质转运、线粒体分裂融合以及能量代谢等功能上也有着极其紧密的联系[7]。内质网应激后可引起内质网腔中错误折叠和未折叠蛋白的聚集,破坏内质网内Ca2+动态平衡,致使线粒体钙超载,增加了线粒体中ROS的产生[8,9]。大量ROS可以引起线粒体内部的未折叠蛋白堆积,发生线粒体应激反应[10]。本实验结果显示,在DTT作用下,线粒体内部的ROS水平随着应激水平上升而不断上升(图3)。表明线粒体内部已经无法处理其内部大量的ROS,线粒体自身功能已经遭到严重损害。
线粒体内部存在多种分子伴侣,它们可以通过各种方式的组合帮助线粒体内多肽正确折叠。线粒体基质蛋白折叠和修复系统的关键组成部分是由2个HSP60七聚体和1个HSP10七聚体所组成的高分子量聚合物[11]。在线粒体应激时,HSP10、HSP60的表达会增加,以此减少线粒体内部的未折叠蛋白来维持线粒体的稳态[12]。因此在本研究中我们使用HSP10和HSP60作为衡量线粒体应激程度的指标。结果显示,随着DTT作用时间延长,HSP10与HSP60都呈现了先上升后下降的趋势(图4 B、C)。因此我们认为在脑胶质瘤细胞中,内质网应激可诱发线粒体应激,并且随着内质网应激加剧,线粒体未折叠蛋白反应不足以使线粒体恢复正常功能,线粒体处于功能失代偿状态,进而线粒体应激指标表达下降。
为了进一步评价对于线粒体应激水平,我们又检测了相关的线粒体蛋白水解酶表达变化。ClpP是位于线粒体基质中的一种包含丝氨酸蛋白酶催化三联体结构域的蛋白水解酶,可利用ATP提供的能量将蛋白底物去折叠,对蛋白进行降解[13]。同样定位于线粒体基质的Lon也属于作为丝氨酸蛋白酶家族成员,可以对疏水氨基酸的末端进行水解,通过介导异常或损伤的蛋白和短暂调控蛋白的降解来维持线粒体的蛋白稳态[14]。结果所示,随着DTT作用时间延长,蛋白酶ClpP和LON总体上也呈现出了先上升后下降的趋势(图4 D、E)。而定位在线粒体内膜间隙的HtrA2/Omi 是一种寡聚丝氨酸蛋白酶,在内质网合成后,由线粒体定位序列 MTS引导进入线粒体中,并储存在线粒体膜间隙。它能够识别错误折叠蛋白暴露出来的疏水表面,发挥分子伴侣的功能[15]。在本实验结果中,Omi蛋白从3 h就已经开始呈现下降趋势(图4 F)。这说明内质网应激确实诱导了线粒体应激,并且线粒体内膜间隙蛋白稳态失衡的发生可能先于线粒体基质蛋白稳态失衡。
综上,我们认为内质网应激可诱导线粒体应激,且线粒体应激可能存在一个代偿阈值,超过此阈值会使线粒体稳态失衡,其具体表现为分子伴侣水解酶的表达下降以及蛋白水解酶释放等,进而促进细胞凋亡的发生。因此,线粒体应激在内质网应激诱导细胞凋亡中具有重要作用,进一步研究线粒体应激在内质网应激诱导细胞凋亡中的作用为脑胶质瘤的化疗药物提供了新治疗策略和研究靶点。
