重组人生长激素对GHD和ISS患儿的促生长作用及对血脂的影响
2019-03-25王晓岩刘利蕊
王晓岩,王 燕,刘利蕊
(1.承德医学院,河北承德 067000;2.承德医学院附属医院)
随着我国人民生活水平的提高,越来越多的家长开始关注儿童的身高问题。儿童身材矮小的疾病很多,其中生长激素缺乏症(growth hormone deficiency,GHD)与特发性矮小(idiopathic shortstature,ISS)最为常见[1]。近年来,重组人生长激素(recombinant human growth hormone,rhGH)逐步成为临床治疗矮小症的有效药物之一[2]。矮小儿童由于体内生长激素(growth hormone,GH)水平异常,多伴随脂代谢异常和体脂堆积,文献显示GH不仅能明显改善矮小患儿的生长状况,还具有促进脂类物质分解的作用[3]。但外源性rhGH治疗对矮小患儿脂代谢的影响,目前的研究结果不尽相同。为此,本研究选取在承德医学院附属医院小儿内科门诊规律治疗并定期随访的GHD和ISS患儿,观察了rhGH治疗对两种患儿的促生长作用及对血脂的影响。
1 资料与方法
1.1 观察对象 收集2014年1月至2017年1月在承德医学院附属医院小儿内科诊断为GHD和ISS的患儿,其中GHD患儿37例(男22例、女15例)、年龄8.59±2.83岁,ISS患儿35例(男24例、女11例),年龄7.19±2.49岁。
1.2 纳入标准和排除标准 GHD患儿入选标准[4]:身高<P3(同年龄、同性别正常儿童生长曲线的第3百分位)或<2SD(两个标准差);3岁至青春期年身高平均增长值<5cm;实际年龄约超过骨龄2岁;生长激素激发试验(胰岛素及精氨酸)GH峰值<10μg/L;智力发育无障碍;匀称体型。ISS患儿入选标准[1]:出生时身长、体重均正常;身高<P3或<2SD;3岁至青春期年身高平均增长值<5cm;骨龄正常或延迟;生长激素激发试验(胰岛素及精氨酸)GH峰值>10μg/L;智力发育无障碍;匀称体型。排除标准:患有糖尿病、甲状腺功能紊乱、重大感染、先天性心脏病等影响本研究中生长发育指标、代谢相关指标的患儿;不能于我院门诊定期复查。
1.3 治疗方法 使用长春金赛药业有限责任公司生产的rhGH(国药准字S20000001,30IU/支)。患儿或家属需掌握皮下注射rhGH的时间及方法,每晚睡前给药,期间注意注射部位有无红肿、硬结等不良反应。GHD患儿初始治疗剂量为0.10IU/kg/d,ISS患儿初始治疗剂量为0.15IU/kg/d;患儿每3个月门诊随诊1次,随诊12个月,期间根据胰岛素样生长因子-1(insulin-like growth factor,IGF-1)水平、疗效及体重变化适当调整用药剂量[5]。随诊均安排在同一时间段(上午8点-10点),由同一人使用同一测量仪器测量患儿身高,并采集空腹静脉血检测血脂指标。采用放射免疫法测定血脂,包括低密度脂蛋白胆固醇(low density lipoprotein,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein,HDL-C)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TCH)。治疗期间指导患儿每日适当运动、保证足够热量摄入及充足的睡眠时间等。
1.4 统计分析 采用SPSS 19.0统计软件。计量资料以均数±标准差(±s)表示,符合正态分布数据的统计分析使用连续测量的方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 ISS患儿 ISS患儿治疗9个月后的身高明显高于治疗前(P<0.05);治疗12个月时的身高明显高于治疗3个月时(P<0.05)。ISS患儿治疗前后,TCH、TG比较差异无统计学意义(P>0.05);治疗6个月后的HDL-C明显高于治疗前,LDL-C明显低于治疗前(P<0.05)。见附表:
附表 GHD、ISS患儿治疗前后的身高和血脂水平(±s)
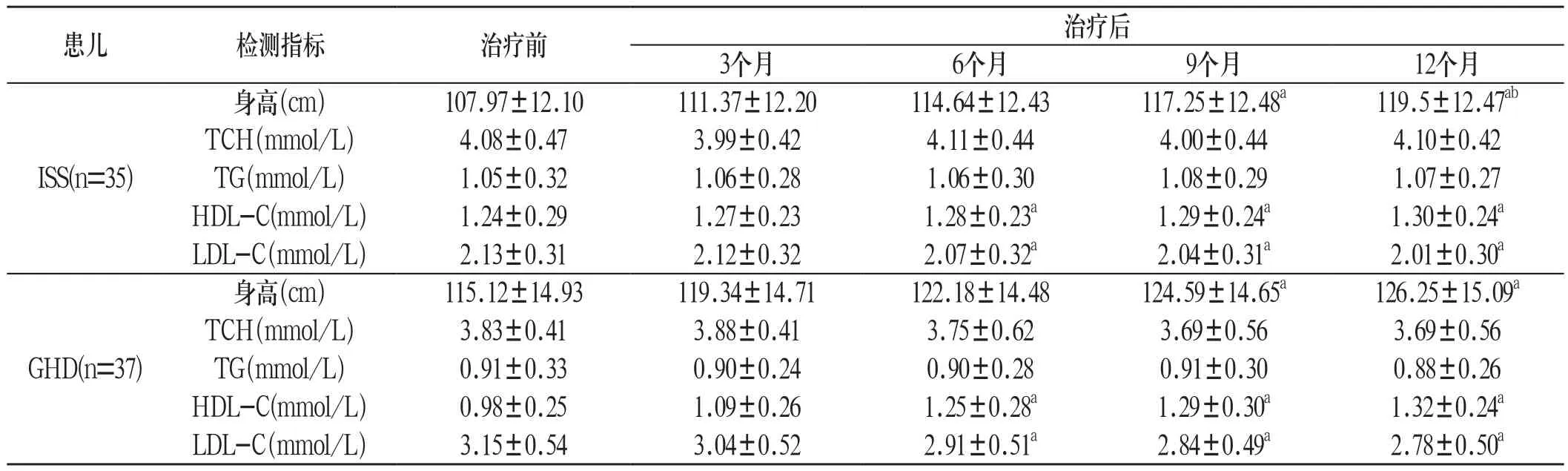
附表 GHD、ISS患儿治疗前后的身高和血脂水平(±s)
与同疾病患儿治疗前比较:aP<0.05;与同疾病患儿治疗3个月比较:bP<0.05
患儿 检测指标 治疗前治疗后3个月 6个月 9个月 12个月ISS(n=35)身高(cm) 107.97±12.10 111.37±12.20 114.64±12.43 117.25±12.48a 119.5±12.47ab TCH(mmol/L) 4.08±0.47 3.99±0.42 4.11±0.44 4.00±0.44 4.10±0.42 TG(mmol/L) 1.05±0.32 1.06±0.28 1.06±0.30 1.08±0.29 1.07±0.27 HDL-C(mmol/L) 1.24±0.29 1.27±0.23 1.28±0.23a 1.29±0.24a 1.30±0.24a LDL-C(mmol/L) 2.13±0.31 2.12±0.32 2.07±0.32a 2.04±0.31a 2.01±0.30a GHD(n=37)身高(cm) 115.12±14.93 119.34±14.71 122.18±14.48 124.59±14.65a 126.25±15.09a TCH(mmol/L) 3.83±0.41 3.88±0.41 3.75±0.62 3.69±0.56 3.69±0.56 TG(mmol/L) 0.91±0.33 0.90±0.24 0.90±0.28 0.91±0.30 0.88±0.26 HDL-C(mmol/L) 0.98±0.25 1.09±0.26 1.25±0.28a 1.29±0.30a 1.32±0.24a LDL-C(mmol/L) 3.15±0.54 3.04±0.52 2.91±0.51a 2.84±0.49a 2.78±0.50a
2.2 GHD患儿 GHD患儿治疗9个月后的身高明显高于治疗前(P<0.05)。GHD患儿治疗前后,TCH、TG比较差异无统计学意义(P>0.05);治疗6个月后的HDL-C明显高于治疗前,LDL-C明显低于治疗前(P<0.05)。见附表。
3 讨论
身材矮小是儿童时期较常见的内分泌疾病,不仅给患儿的日常生活带来不便,还会导致患儿出现沮丧、敏感、自卑等不良情绪,从而影响患儿的生活质量。近年来,rhGH广泛应用于身材矮小儿童的治疗中,能明显提高患儿的终身高,但关于GH改善身高的同时对机体脂代谢的影响,目前研究结果尚不统一。Trepp等[6]认为,GHD患儿伴随脂代谢紊乱,给予外源性rhGH治疗后患儿血脂各指标可逐渐恢复接近正常水平;还有研究发现[3],由于机体的代偿功能,GHD患儿治疗前血脂各指标无明显异常,但应用rhGH治疗后会出现脂代谢紊乱的情况,且能增加远期心血管疾病的发生风险。而ISS患儿治疗前血脂相关指标处于正常范围,当给予外源性rhGH治疗后,有出现脂代谢紊乱的可能[7]。
rhGH是通过重组技术生产的由191个氨基酸残基组成的蛋白质,主要优点是与人体在生理状态下分泌的GH结构、作用相同,并且随着生物技术的发展,rhGH的安全性也越来越高。rhGH可直接作用于骨骺软骨细胞加快其分裂增殖的速度,从而加速骨骼生长[8];另一方面,rhGH也可以促进肝脏分泌IGF-1,IGF-1可通过调节GHRHGH-IGF内分泌轴发挥促生长的作用[4],从而能明显改善矮小患儿的终身高。本研究结果亦证实,与治疗前比较,GHD、ISS患儿治疗后的身高均明显高于治疗前。
本研究还发现,GHD患儿治疗前HDL-C处于正常低水平、LDL-C处于正常高水平,且查体时发现患儿存在腰腹部脂肪堆积的情况;而ISS患儿血脂水平无异常。无论是GHD患儿还是ISS患儿,治疗6个月后HDL-C明显高于、LDL-C明显低于治疗前,TCH、TG与治疗前比较差异无统计学意义,说明rhGH治疗GHD和ISS,在提高患儿身高的同时能改善患儿的脂代谢。给予外源性rhGH替代治疗,可通过激活脂肪细胞表面的特异性受体加快降脂速率,如β肾上腺素能受体、过氧化物酶体增生物激活受体δ(peroxisoIlle proliferator-actirated receptor,PPAR)等[9];GH还可以增加肝脏摄取LDL的能力,从而降低LDL的生成速率、增加其清除速率[10];另外,GH能加快脂肪细胞分泌瘦素的速度,而刘莉等[11]的研究发现,瘦素能够降低脂肪细胞脂肪酸的合成,进而能抑制脂肪的合成。
综上所述,rhGH可明显改善GHD、ISS患儿的身高,同时能够明显改善患儿的血脂指标,临床医师应在治疗过程中密切监测相关指标,以确保rhGH的治疗效果。
