米曲霉乳糖酶基因在乳酸克鲁维酵母中的表达
2019-03-25王敏席志文黄琳娜惠丰立
王敏,席志文,黄琳娜,惠丰立
(南阳师范学院生命科学与技术学院,河南南阳473061)
乳糖在牛奶中的含量极为丰富,乳糖酶能将其水解成被人体直接吸收的半乳糖和葡萄糖,为机体的生命活动提供能量。研究表明,很多消费者由于体内缺乏乳糖酶,不能将食物中的乳糖分解[1-2],尤其是饮用牛奶之后会产生如腹痛、腹胀、水样大便、呕吐等不适症状。乳糖不耐受症在婴幼儿中也较为常见,腹泻婴儿和新生儿中乳糖不耐受症分别占46.95%~70.00%和5.17%~27.30%[3-4]。利用乳糖酶生产的低乳糖制品不仅其营养成分有利于人体吸收,而且乳制品的风味和品质也能得到很大改良。因此乳糖酶在食品和医药领域都有很高的应用价值。
乳糖酶的来源非常广泛,动物、植物、微生物均可产生乳糖酶,随着发酵技术的不断进步,微生物表达乳糖酶具有较大的潜能。目前微生物法生产存在酶表达量低、胞内分泌乳糖酶使得后续纯化工艺复杂和酶回收率低等缺点,导致其无法进行大规模的生产和应用[5-7]。自2005年米曲霉全基因组的破译以来,结合基因工程技术使得米曲霉在食品领域的应用更加广泛[8-9]。欧军[10]研究表明,米曲霉原始菌株可胞外分泌乳糖酶,耐高温,酶学性质好,但酶活性较低,仅有2.34 U/mL。李淑娟[11]将黑曲霉Asperillus DL116乳糖酶基因电转到毕赤酵母中,甲醇诱导发酵12 d后,乳糖酶活性达到271.15 U/mL。张伟等[12]将亮白曲霉乳糖酶基因电转至毕赤酵母中,在5 L发酵罐中利用甲醇诱导表达乳糖酶,120 h后酶活性达到3 600 U/mL。侯重文等[13]将米曲霉乳糖酶基因在毕赤酵母中表达,并对其培养基进行优化,摇瓶发酵72 h后酶活达到672 U/mL。但毕赤酵母在发酵过程中溶氧和甲醇需求量高,且甲醇有毒、易燃,存在非常大的安全隐患。采用基因工程等技术手段,构建适宜的乳糖酶基因表达体系,是实现乳糖酶工艺化生产的关键[14]。目前酵母菌是工业上最常用的真核表达系统,其产物多为胞外分泌,对后续的加工处理有很大的便利。因此,寻求更加有效的表达系统,直接进行胞外高效分泌表达乳糖酶,对减少后续纯化工艺、降低生产成本具有重要意义,也为乳糖酶的工业化生产打下基础[15-16]。
近年来,乳酸克鲁维酵母(Kluyveromyces lactis)表达体系统受到人们的青睐,获得了包括美国食品和药物管理局(Food and Drug Administration,FDA)在内的众多机构的安全认证,证明其表达的乳糖酶和凝乳酶具有极高的安全性[17]。乳酸克鲁维酵母工程菌有着超强的胞外分泌表达能力,其工业发酵规模已超过100m3,和其他酵母表达系统相比,乳酸克鲁维酵母表达载体pKLAC1带有非抗生素筛选标记基因乙酰胺酶基因(amdS)[18-19],筛选和发酵的过程中均不需要添加抗生素或诱导剂,是表达乳糖酶的理想载体。此外,乳酸克鲁维酵母的营养适应性较强,为后期发酵工艺优化提供了便利的条件。该研究将米曲霉乳糖酶基因转化到乳酸克鲁维酵母表达系统中,得到直接胞外分泌表达的乳糖酶基因工程菌株,为乳糖酶的工业化生产奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与载体
乳酸克鲁维酵母GG799:由南阳师范学院能源微生物多样性实验室保存;表达载体pKLAC1:NEW England Biolabs公司。
1.1.2 试剂
质粒小量提取试剂盒:康宁生命科学有限公司;DNA产物纯化试剂盒:Thermo Scientific公司;SacⅡ酶(20 000 U/mL)酵母基本碳源(yeast carbon base,YCB)培养基、乙酰胺溶液(100×):NEB;酵母基因组DNA抽提试剂盒:生工生物工程有限公司。
邻硝基苯β-D-半乳吡喃糖苷(o-nitrophenyl-β-D-galactopyranoside,ONPG)、邻-硝基苯酚(o-nitro phenol,ONP)、碳酸钠颗粒、冰醋酸、氢氧化钠颗粒、95%乙醇、蒸馏水、二硫苏糖醇(dl-dithiothreitol,DTT)、醋酸锂、正丁醇、乙醇、丙酮、苯胺、二苯胺、磷酸、无水葡萄糖、乳糖、半乳糖等常用药品与试剂均是国产分析纯或国外进口分析纯。
1.1.3 培养基
LB 培养基(luria-bertani culture,LB):蛋白胨 1%、酵母粉0.5%、氯化钠1%;YEPD培养基(yeast extract peptone dextrose medium,YEPD):酵母粉 1%、蛋白胨2%、葡萄糖2%。
发酵培养基:乳糖4%、玉米浆5%、酵母粉6%、硫酸镁0.1%、硫酸锰0.03%。
1.1.4 主要仪器与设备
Gel DOC XR型凝胶成像系统:BioRad公司;Electroporator 2510型电转仪:Eppendorf公司;DYY-12型电泳仪:北京六一仪器厂;TC-512型PCR扩增仪:Techne公司;TU-1900型紫外可见分光光度计:北京普析通用仪器公司;超微量分光光度计:Thermo公司;R124CN型分析天平:奥豪斯仪器有限公司。
1.2 试验设计
1.2.1 目的基因的合成
根据米曲霉乳糖酶基因序列和乳酸克鲁维酵母GG799密码子的偏爱性,设计了编码乳糖酶蛋白的lacA DNA序列,由南京金斯瑞生物科技有限公司合成并构建于载体pKLAC1中。
1.2.2 重组质粒的提取及SacⅡ酶切
将含有重组质粒的大肠杆菌过夜培养,用小剂量质粒提取试剂盒提取质粒,通过浓度为1%(10 g/L)的琼脂糖凝胶电泳对提取质粒进行检测。将成功提取的重组质粒pKLAC1-lacA用SacⅡ酶酶切2 h,用普通DNA纯化试剂盒来进行回收,通过浓度为1%(10 g/L)的琼脂糖凝胶电泳检测DNA片段的大小。
1.2.3 电转化乳酸克鲁维酵母GG799[19-20]
利用醋酸锂∶DTT=1∶9(体积比)制备乳酸克鲁维酵母GG799感受态细胞,通过电脉冲法(电压为2500V)将线性化的质粒DNA片段转化到乳酸克鲁维酵母GG799感受态细胞中。电击后的酵母细胞立即加入1 mL预冷的1 mol/L山梨醇溶液中,并收集电转后的酵母溶液。在30℃水浴锅中处理2 h,离心收集菌体,重悬于1 mL无菌水中,均匀涂布在含有5 mmol/L乙酰胺的YCB平板上,30℃培养箱中培养3 d~5 d。
1.2.4 标准曲线的制作[21-22]
ONP标准溶液的配制:称取139.0 mg ONP,先用10 mL浓度为95%乙醇溶解,然后转移至1000 mL容量瓶,蒸馏水定容摇匀。分别准确移取ONP标准制备液 2、4、6、8、10、12、14 mL 至 100 mL 容量瓶中,分别加入25 mL浓度为10%碳酸钠溶液,再用浓度为0.1 mol/L、pH值为5.2醋酸缓冲液定容,摇匀[22-23]。420 nm处测定每个稀释液的吸光值,用蒸馏水作空白对照。以420 nm处吸光值为横坐标,邻硝基苯酚的浓度为纵坐标,绘制标准曲线,结果如图1所示。

图1 乳糖酶酶活标准曲线Fig.1 Standard curve of lactase activity
酶活力单位的定义:一个酶活单位(U)为在反应温度60℃,pH值为5.2的条件下,每分钟将ONPG分解为1 μmolONP所需的酶量。
1.2.5 高表达菌株的筛选
挑取YCB平板上长势良好的单菌落接种到48孔板中,微孔板恒温振荡器在28℃、600 r/min发酵96 h。离心获取发酵上清液,将上清液用0.1 mol/L、pH值为5.2醋酸钠缓冲液适量稀释,ONPG(0.037g/L)2 mL提前预热10 min,加入稀释的发酵上清液500 μL,60℃保温15 min,加入2.5 mL10%碳酸钠溶液终止反应并显色,最加入20 mL蒸馏水稀释,用分光光度计检测420 nm吸光值,筛选出获得高表达量的重组菌株。
1.2.6 重组酵母菌株的PCR鉴定
酵母基因组DNA抽提试剂盒提取重组酵母菌株细胞的全基因组,用全细胞聚合酶链式反应(poly merase chain reaction,PCR)方法验证目的基因与宿主细胞染色体整合的情况。以重组酵母菌株基因组DNA作为PCR反应的模板,单拷贝整合子的鉴定用引物为:Prochy-inter 1(5`-TACCGACGTATATCAAGCCCA-3`)和Prochy-inter2(5`-ATCATCCTTGTCAGCGAAAGC-3`),多拷贝整合子的鉴定用引物为:Prochy-inter 2(5`-ATCATCCTTGTCAGCGAAAGC-3`)和 Prochy-inter 3(5`-CAGTGATTACATGCATATTGT-3`)。PCR条件为:95℃ 5 min;95 ℃ 30 s,50 ℃ 30 s,72 ℃ 2 min,30 个循环;72 ℃ 10 min。
1.2.7 重组酵母菌株的摇瓶表达
挑取重组酵母菌株的单菌落接种于装有5 mL YEPD液体培养基的试管中,在28℃、200 r/min条件下培养18 h获得种子液。将种子液全部接种于装有45 mL/250 mLYEPD液体培养基的摇瓶中,相同条件下培养120 h。每隔12 h取样,5 000 r/min、离心10 min,菌体适当稀释用于测定重组菌株的生物量(OD600),发酵上清液用于测定乳糖酶活力。
1.2.8 十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDSPAGE)分析表达产物
配制SDS-PAGE溶液:5%的浓缩胶和12%的分离胶,在发酵时间分别为 12、24、36、48、60、72 h 进行取样,将发酵液上清与上样缓冲液按3∶1体积比混合,沸水浴中加热10 min,离心去除杂质,用考马斯亮蓝染液染色2 h,过夜脱色。
1.2.9 薄层层析法(thin layer chromatography,TLC)检测重组菌株分泌乳糖酶水解乳糖的产物
展开剂∶水∶乙醇∶正丁醇体积比为 2∶3∶5;显色剂:配置苯胺—二苯胺显色液溶液(A液:0.1二苯胺溶于2.5 mL丙酮溶液中;B液:100 μL苯胺溶液溶于2.4 mL丙酮溶液中;然后将A、B液混合,并加入500 μL磷酸,加入磷酸后会产生白色沉淀,摇匀至白色沉淀消失,4℃保存,用于显色备用[23-24]。配置1%葡萄糖,1%乳糖,1%半乳糖,及1%葡萄糖和半乳糖的混合物。将发酵120h发酵液上清与1%乳糖按体积比为1∶1混合,40℃水浴4 h,沸水终止发应,室温25℃条件下冷却,备用。
在距硅胶板底部1.5 cm处用铅笔划一细横线,等距离间隔画出5个标记,放入105℃烘箱中活化30 min,将活化后硅胶板放在足够干燥的桌面上快速点样,样品剂量为3 μL,再将硅胶板烘干。取出硅胶板放入层析缸中,密封隔绝空气。展开剂自下而上在硅胶板上展开,当展开层的前沿移至硅胶板前沿0.5 cm处,停止展层,取出层析板用电吹风机吹干,均匀的喷洒上显色剂,放在烘箱中85℃烘干,时刻观察颜色变化,直至条带显色明显。
1.3 数据统计分析
采用Excel 2010软件对试验数据进行统计分析,所有试验数据均为3次或3次以上重复试验的平均值;并利用Excel 2010软件绘制作图。

图2 lacA天然序列及其优化后DNA序列比较Fig.2 Comparison of original and optimized sequences for lacA
2 结果与讨论
2.1 目的基因的合成
根据乳酸克鲁维酵母GG799密码子的偏爱性,改造米曲霉lacA基因序列的678个基因位点,设计全长2 982 bp的lacA成熟蛋白编码序列,如图2所示。与原始序列相比较,碱基GC含量由原来的51.4%下降至39.2%。改造后的lacA基因能更稳定的在乳酸克鲁维酵母中高效表达。去除优化序列中的引物序列,改造后的乳糖酶基因一共编码988个氨基酸,表达出的蛋白分子量理论值约为110 kDa。
2.2 重组表达载体pKLAC1-lacA及SacⅡ酶切鉴定
提取已获得转化子的大肠杆菌中的质粒,试验结果如图3所示,图中泳道“1”出现两条目的条带,说明成功提取重组质粒。对所提取的质粒用SacⅡ酶切,用普通DNA纯化试剂盒纯化后,产物进行琼脂糖凝胶电泳检测,试验结果如图4所示,在泳道“1”和“2”中分别出现相同的两条特异条带,片段大小接近10 kb和3 kb,说明目的基因成功构建在质粒pKLAC1中。

图3 重组表达载体pKLAC1-lacA的提取鉴定Fig.3 Extraction and identification of recombinant expression vector pKLAC1-lacA
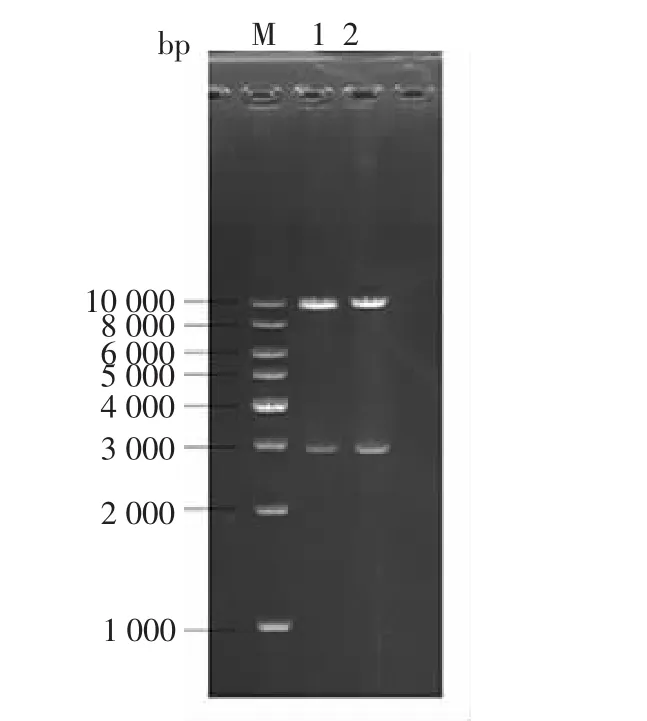
图4 重组表达质粒pKLAC1-lacA的SacⅡ酶切鉴定Fig.4 Identification of the recombinant plasmid pKLAC1-lacA by SacⅡdigestion
2.3 多拷贝整合重组菌株的鉴定
用SacⅡ对重组质粒pKLAC1-lacA进行线性化处理,以电转化方法将线性化质粒转入乳酸克鲁维酵母GG799,利用含5 mmol/L乙酰胺的YCB培养基富集筛选整合有表达框的阳性转化子。利用多个表达框插入鉴定整合引物进行全细胞PCR鉴定,分别扩增出了两条特异性条带,大小分别约1.9 kb和2.3 kb(图5),该试验结果进一步证实lacA基因片段已成功整合到乳酸克鲁维酵母GG799的基因组中,而且菌株lacA-1为多拷贝整合表达框的重组菌株。
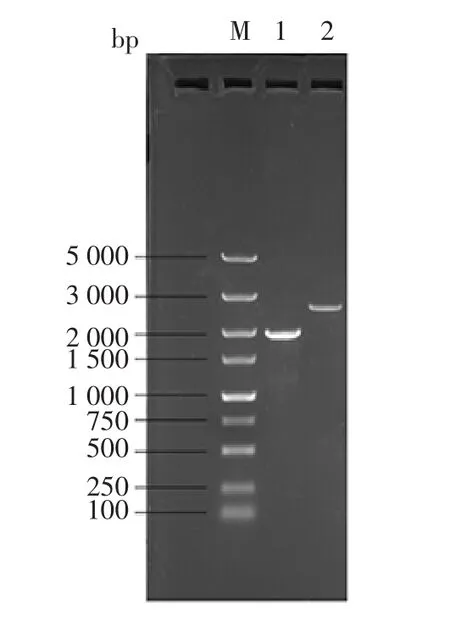
图5 重组工程菌株lacA-1多拷贝整合表达框的PCR鉴定Fig.5 Identification of multi-copy transformants by PCR
2.4 重组菌株生物量及产酶活性
重组菌株lacA-1进行摇瓶发酵,每隔12 h取样,测定生物量和乳糖酶活性。重组菌株lacA-1用发酵培养基培养发酵,96 h后进入稳定生长期,菌液OD600维持在80左右。产酶曲线滞后于生长曲线,在72 h后产酶量开始呈现明显上升,120 h进入稳定期,乳糖酶酶活为120.65 U/mL,如图6所示。
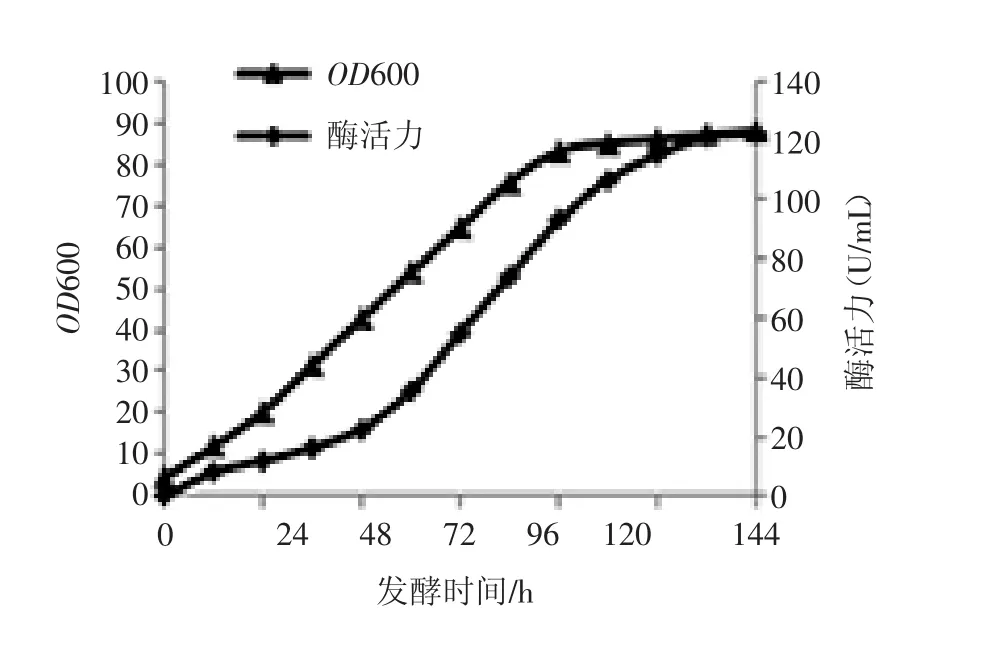
图6 重组菌株lacA-1生长曲线及产酶活力曲线Fig.6 Growth and activity curve of recombinant strain lacA-1
2.5 重组菌株表达产物的SDS-PAGE电泳分析
将乳酸克鲁维酵母GG799和经转化后筛选的重组菌株lacA-1在发酵培养基中每隔12 h取样,取样6次,离心、取上清,并对样品进行预处理,上样15 μL,进行SDS-PAGE电泳检测,结果如图7所示。与空载乳酸克鲁维酵母GG799相比,重组菌株lacA-1样品在分子量约在120 kDa~130 kDa处出现特异性条带,随着发酵时间的增加也呈现逐渐增加的趋势,而空载乳酸克鲁维酵母在此处没有特异性条带出现。该乳糖酶蛋白分子量略高于计算所得的米曲霉乳糖酶蛋白理论值。这应该是由于该基因片段存在多个糖基化位点,在分泌表达时发生了糖基化[25-26],导致该蛋白表观分子量略高于其理论值。
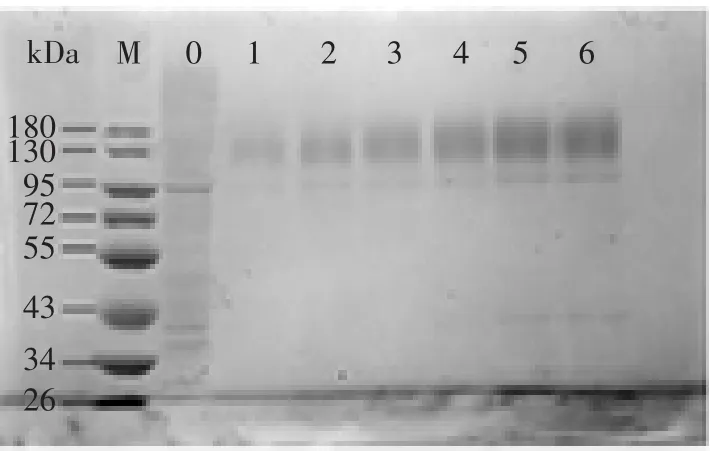
图7 不同时间重组工程菌株lacA-1发酵上清液SDS-PAGE分析Fig.7 SDS-PAGE analysis of recombinant K.lactis strain lacA-1 in different times
2.6 乳糖水解产物的TCL分析
以葡萄糖、半乳糖、及两者的混合物作为对照,处理后的乳糖水解产物分别点样,显色,检测发酵液的水解产物。由图8可知,标记为(1)的泳道可看出乳糖溶液被发酵液水解为葡糖糖和半乳糖,说明该重组菌株lacA-1胞外分泌了乳糖酶,并具有生物活性。

图8 重组工程菌株lacA-1发酵液水解乳糖产物的TCL分析Fig.8 TCL detection of hydrolysis lactose of recombinant strain lacA-1
3 结论
本研究中利用乳酸克鲁维酵母GG799为表达系统,将目的基因片段lacA在大肠杆菌中克隆至载体pKLAC1中,获得乳糖酶基因工程菌。该载体pKLAC1中的真菌乙酰胺酶基因(amdS)可高效筛选整合有表达框的酵母菌,不需要添加任何抗生素。与毕赤酵母表达系统相比,毕赤酵母表达系统在发酵过程中需要大量甲醇诱导,甲醇为有毒有机物,需要后期除杂,增加了生产流程[27]。该工程菌不仅安全性高,而且能够胞外分泌乳糖酶,在发酵过程中不需要添加任何诱导物,工业化生产中将发酵液进行超滤即可获得纯酶液,减少了后期处理工艺,能有效降低生产成本,提高酶的回收率。
米曲霉乳糖酶基因具有相对耐热、耐酸、稳定性高等优点,本研究首次将优化的米曲霉的乳糖酶基因片段lacA电转到乳酸克鲁维酵母GG799中,获得了高效胞外分泌表达乳糖酶的重组菌株lacA-1。利用薄层层析法检测该菌株分泌的乳糖酶具有生物活性。由SDS-PAGE电泳分析表达重组菌株lacA-1产物可知,该菌株所分泌的乳糖酶蛋白分子量略高于理论值,其原因在于该基因存在糖基化位点,在表达过程中发生了一定程度的糖基化,从而使其表观分子量大于理论值。由发酵液的SDS-PAGE电泳图像可知,该蛋白分泌表达量较高,通过后期培养基优化及发酵工艺优化有望实现乳糖酶的高效表达。综上所述,本研究通过基因工程手段成功构建一株可胞外分泌、安全性高的乳糖酶工程菌株,实现了米曲霉乳糖酶基因在乳酸克鲁维酵母表达体系中的胞外分泌表达,为乳糖酶在食品、医药等工业化上的应用奠定了基础。
