SVEP1 PKHD1 P53在原发性肝癌组织中的表达及其临床意义*
2019-03-25王雅蕾邱志强陈璐程润芬王靖怡孙保存
王雅蕾 邱志强 陈璐 程润芬 王靖怡 孙保存
在全世界范围内,原发性肝癌(primary liver can⁃cer,PLC,简称肝癌)是最常见的恶性肿瘤之一,同时也是世界范围内第二大恶性肿瘤相关的致死因素[1]。在我国,原发性肝癌的年发病率约占全球比例的51%,而死亡率则是仅次于胃癌、肺癌的第三大恶性肿瘤。患者多为中老年,男性居多。致病因素多为慢性肝炎感染、肝硬化、酒精以及黄曲霉素等[2]。
大部分肝癌患者在就诊时已进入中晚期,虽然肝切除术和肝移植提供了有效的治疗方法,但肝治愈性切除术后患者的复发率仍然很高。有研究显示肿瘤直径≤5 cm的肝癌5年生存率可达81%,然而其术后的复发仍较为常见,高达50%[3]。尽管许多研究已经找到了一些肝癌复发相关的标志物,但是临床上仍无有效的检测方法来评估根治性切除术后肝癌复发的危险因素,肝癌肝切除术后的复发情况至今依然困扰着临床医生。鉴于中晚期肝癌的不良预后,预测疾病进展、复发的快速可测量的生物标志物则显得至关重要。
SVEP1可以在心脏、肺、胃、肠、骨骼组织、基质成骨组织(骨膜和骨)、胎盘组织、骨髓间充质基质细胞中检测到,近年来研究者又在乳腺癌细胞等肿瘤细胞中检测到其表达。SVEP1功能类似于黏附蛋白选择家族,并且之前被证明是细胞表面蛋白参与细胞黏附过程,同时有研究证明SVEP1是整合素α9β1的配体并且可以介导细胞黏附[4]。肿瘤细胞的黏附作用又与其复发转移较为相关。PKHD1是人类常染色体隐性遗传多囊肾病的致病基因,而最新研究表明,PKHD1与结直肠癌等恶性肿瘤的发生发展相关[5]。P53是肝癌发生的高频突变,有研究表明,肝癌的发病机制与抑癌基因P53密切相关[6]。本研究通过免疫组织化学法检测SVEP1、PKHD1以及P53在经手术切除肝癌组织中的表达,使用免疫组织化学评分将不同指标的表达情况量化,进一步评估这三种指标是否对肝癌患者的术后复发具有预测价值。
1 材料与方法
1.1 一般特征
本研究入选2013年1月至2014年1月在天津医科大学肿瘤医院初诊并行手术治疗且临床及随访资料完整的103例原发性肝癌患者,术后病理选用SVEP1、PKHD1、P53三个指标,采用免疫组织化学评分的方式。所有患者病灶均被完全切除且切缘均为阴性。研究排除发生肝外转移及肝功能评分C级的患者。本研究经医院伦理委员会批准。所有患者均签署知情同意书。
1.2 方法
1.2.1 观察和随访指标 包括患者的性别、年龄、甲胎蛋白(AFP)、糖链蛋白19-9(CA19-9)水平,有乙型、丙型肝炎病史、肝硬化、腹水、肿瘤大小、肿瘤个数、卫星结节、微血管侵犯、大血管侵犯、癌栓等。术后定期复查血常规、肝肾功能、B超、血清标志物(AFP、CA19-9)及MRI检查等。分析患者无瘤生存期(disease free survival,DFS)。术后随访时间1.0~59.3个月,中位随访时间为10.7个月,无失访患者。
1.2.2 免疫组织化学法 利用二甲苯和浓度梯度的乙醇溶液连续浸润,对石蜡包埋的肝癌组织标本进行脱蜡;枸橼酸钠溶液进行抗原修复后用3%H2O2去除内源性过氧化物酶;3%BSA孵育降低非特异性着色;一抗孵育4℃过夜;二抗37℃孵育40 min;DAB显色,苏木素复染;梯度乙醇及二甲苯溶液进行脱水;封片后置于通风处晾干。
1.2.3 结果观察-免疫组织化学评分 SVEP1、PKHD1、P53的免疫染色强度评分:0,阴性;1,弱阳性;2,中等阳性;3,强阳性。SVEP1、PKHD1、P53阳性细胞的百分比以0至3的等级评分(0:无阳性细胞,1:<30%阳性细胞,2:30%~60%阳性细胞,3:>60%阳性细胞)。强度和百分比得分的乘积为最终染色得分。所有图像均由正置荧光显微镜(Olympus BX61,Tokyo,Japan)捕获(图1)。
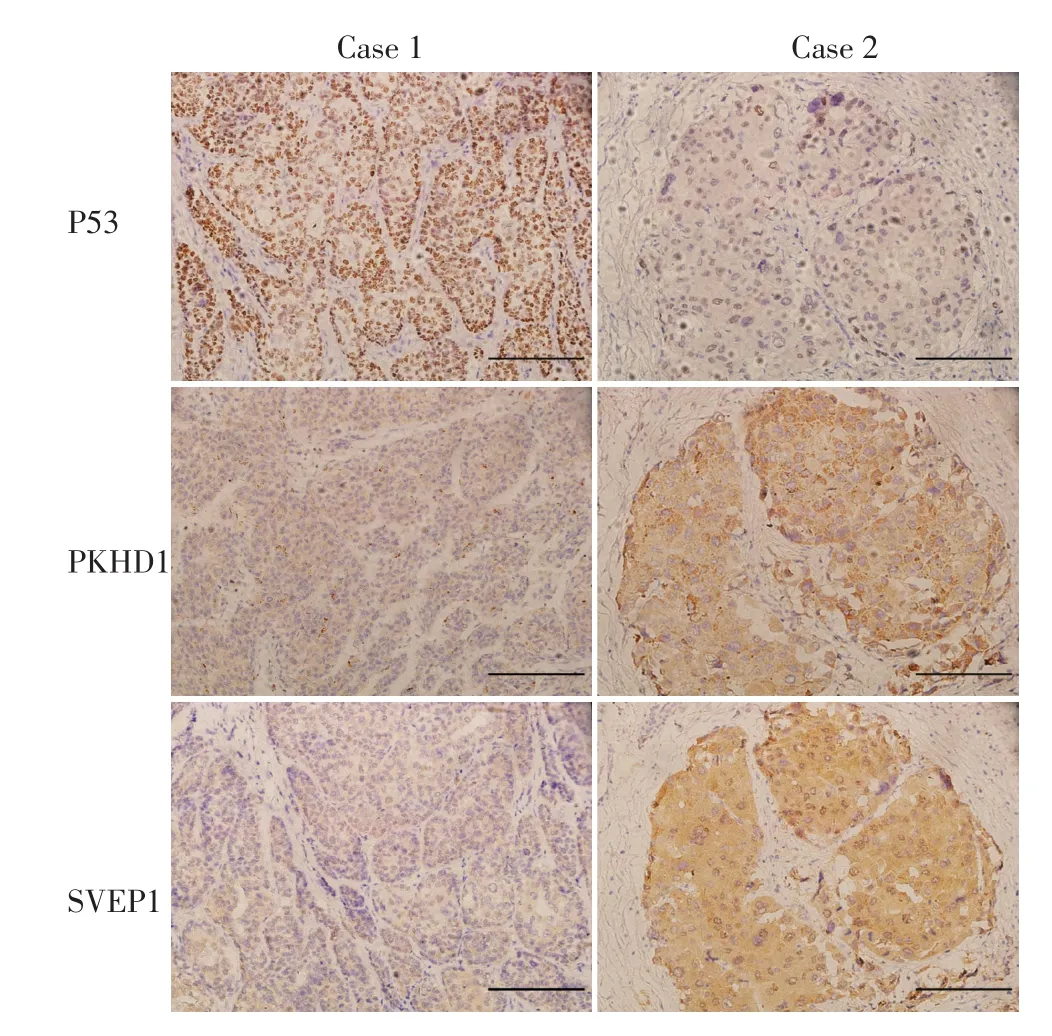
图1 免疫组织化学染色(SP染色法×200,标尺表示200 μm)
1.3 统计学分析
采用SPSS 25.0和Med Calc 18.2软件进行数据分析。DFS为自手术切除后首日开始计算,DFS截至肿瘤复发、进展或死亡或末次随访时间。采用Med Calc软件中ROC曲线分析不同指标免疫组织化学评分的临界值以及敏感度、特异度、ACU面积等指标。根据临界值重新定义SVEP1、PKHD1、P53危险度分组,采用Kaplan-Meier法比较SVEP1、PKHD1、P53免疫组织化学评分高危组、低危组间生存分析的差异。以P<0.05为差异具有统计学意义。
2 结果
2.1 SVEP1、PKHD1、P53免疫组化评分的ROC曲线分析
SVEP1免疫组化评分的AUC曲线面积为0.861(P<0.001),临界值为4分,敏感性、特异性分别为83.5%和83.3%,约登指数为0.6686;PKHD1免疫组化评分的AUC曲线面积为0.829(P<0.001),临界值为4分,敏感性、特异性分别为84.7%和77.8%,约登指数为0.6248;P53免疫组化评分的AUC曲线面积为0.716(P<0.001),临界值为1分,敏感性、特异性分别为52.9%和83.3%,约登指数为0.3627。SVEP1和PKHD1的AUC曲线面积均在0.7~0.9之间,作为生物学指标预测肝癌患者复发情况具有一定的准确性,P53的AUC曲线面积及约登指数较SVEP1及PKHD1均有一定差距,预测肝癌复发情况的准确性不足,不推荐首选使用(图2)。
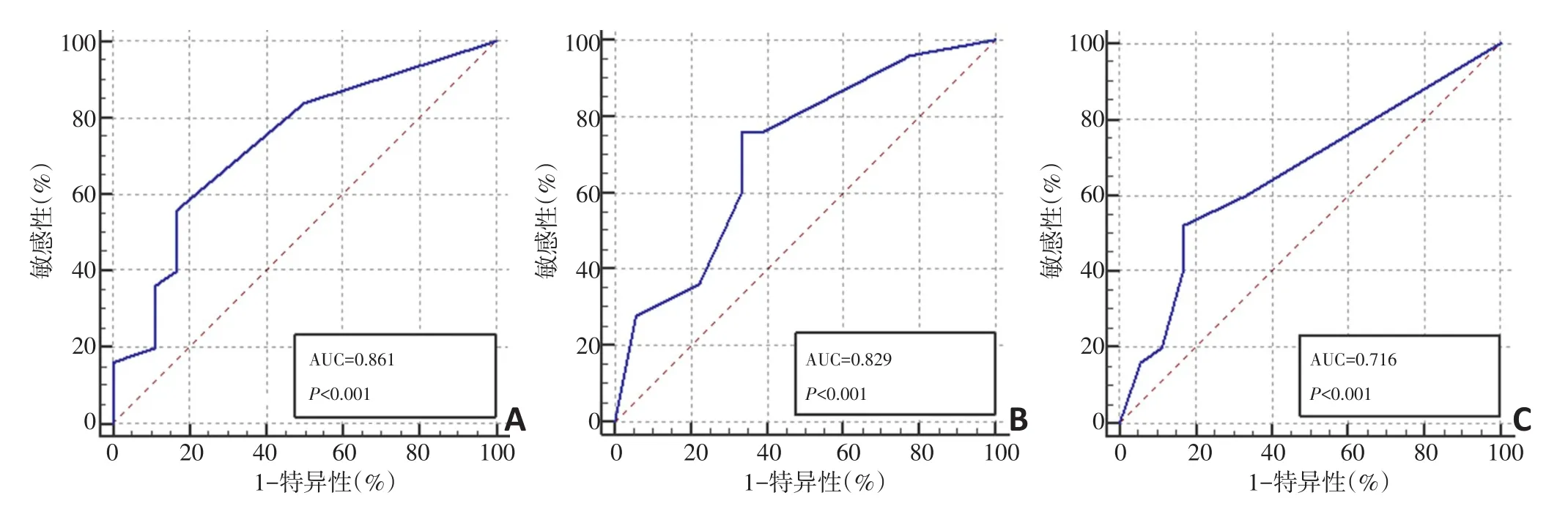
图2 SVEP1、PKHD1、P53免疫组化评分的ROC曲线分析
2.2 103例原发性肝癌患者的基线水平分析
103例原发性肝癌患者中,男性79例,女性24例;年龄21~88岁,中位年龄为55岁。单发肿瘤94例;肿瘤大小1.0~27.0 cm,中位值4.5 cm。103例患者中,伴肝硬化55例,卫星结节20例,大血管侵犯8例,微血管侵犯42例,癌栓46例。乙型病毒肝炎74例,丙型病毒肝炎5例。血清肿瘤标志物方面,中位AFP水平 70.6(1.03~718 840.0)μg/L,中位CA19-9水平22.89(0.6~1 000.0)kU/L中位分CA19-9水平22.89(0.6~1 000.0)kU/L(表1)。
2.3 生存分析
截至末次随访时间2018年8月30日,85例患者因疾病进展发生复发,其中79例患者因疾病进展死亡,其余6例患者均生存。全组患者随访时间1.0~59.3个月,中位随访时间为10.7个月,无失访患者。36个月总生存率和无瘤生存率分别为24.3%和17.5%。

表1 103例原发性肝癌患者的基线水平分析
2.4 SVEP1、PKHD1、P53免疫组化评分分组及相关生存分析
根据SVEP1、PKHD1、P53的免疫染色强度评分以及其阳性细胞的百分比的乘积确定最终染色得分。SVEP1高危组(≤4分)和低危组(>4分)分别为74例和29例,3年无瘤生存率分别为4.1%和51.7%(P<0.001);PKHD1高危组(≤4分)和低危组(>4分)分别为76例和27例,3年无瘤生存率分别为5.3%和51.9%(P<0.001);P53高危组(>1分)和低危组(≤1分)分别为48例和55例,3年无瘤生存率分别为6.3%和27.3%(P=0.003,图3)。
2.5 SVEP1、PKHD1免疫组化评分联合应用的ROC曲线分析
PKHD1与SVEP1联合应用时,其ROC曲线的AUC面积为0.897(P<0.001),敏感性为76.5%,特异性为94.4%,约登指数为0.7092,两者联用优于PKHD1与SVEP1单独应用(图4)。
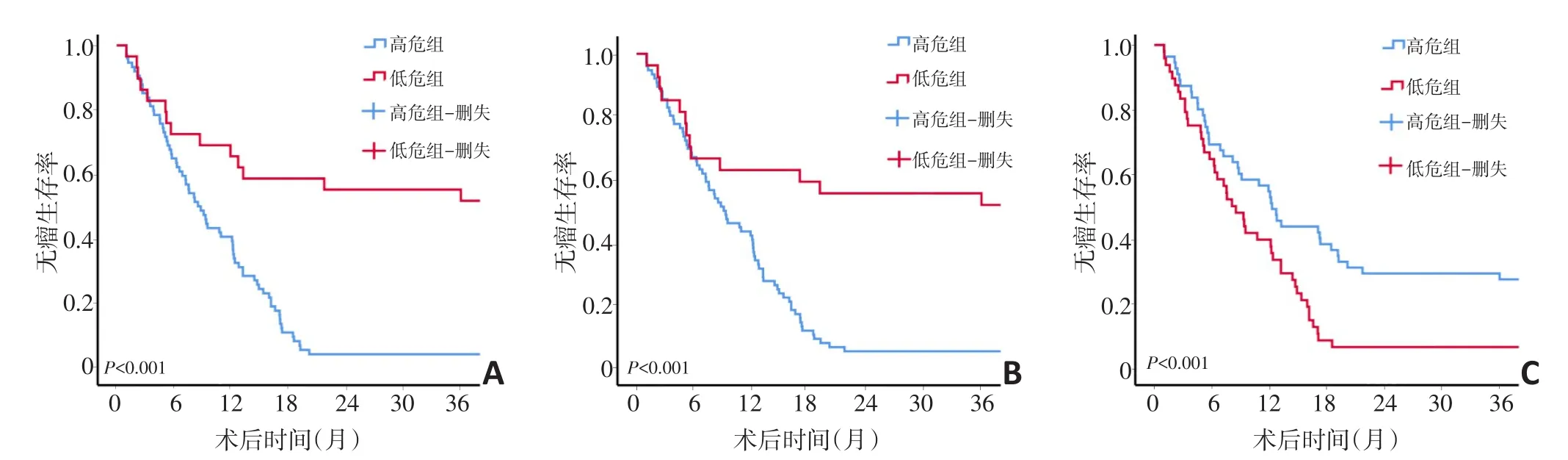
图3 SVEP1、PKHD1、P53免疫组化评分高危组与低危组的生存分析
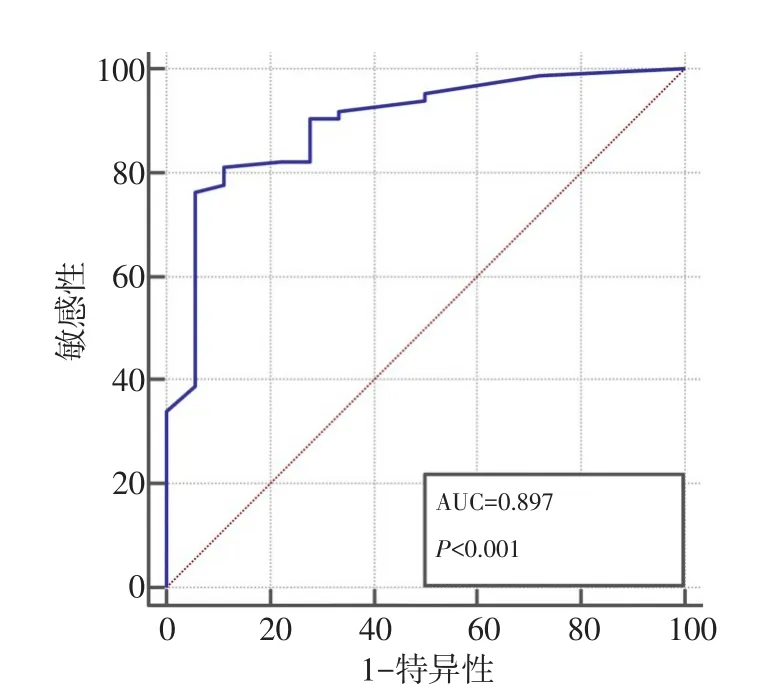
图4 SVEP1、PKHD1免疫组化评分联合应用的ROC曲线分析
3 讨论
原发性肝癌是常见恶性肿瘤,由于起病隐匿,早期无症状或症状不明显,进展迅速,确诊时大多数患者已经达到局部晚期或发生远处转移[2]。手术切除或肝移植是治疗原发性肝癌的根治性手段,但患者术后的复发转移较为常见[3]。其转移形式主要包括肝内转移、血行转移、淋巴转移以及种植转移,其中以肝内转移较为常见[7]。有研究表明,原发性肝癌患者术后1年内复发者中位生存时间为27个月,2年生存率为54%;1年内无复发的患者2年内生存率为100%[8]。因此,肝癌术后复发是影响肝癌远期疗效的关键,但目前有效预测、防治肝癌复发的方法尚无共识。
通过聚合酶链式反应(RT-PCR)扩增肿瘤血清标志物的mRNA来证明癌细胞的产生,是一种检测复发情况敏感度和特异度较强的方法,利用荧光定量PCR技术检测外周循环血及肿瘤旁组织中的甲胎蛋白mRNA的相关表达具有高敏感性,对肝癌复发的检测有一定的意义[9]。有研究发现,肿瘤组织中的CD151高表达预示着肝癌较差的预后(高复发转移率),说明肿瘤组织中CD151的相关表达状况可作为预测肝癌复发的重要标志物[10-11]。c-met蛋白是血清肝细胞生长因子(HGF)的受体,有研究报道肝癌患者行规则肝切除术后血清HGF水平增高及肿瘤本身cmet蛋白的高表达可能与术后早期复发有关,但尚无明确的定论[12-13]。与肝癌复发转移相关的基因、蛋白数量庞大,关于复发转移相关基因、蛋白的研究已成为目前肝癌预后研究中的热点和趋势,但肿瘤标记物若推广至临床还须具备特异性强、操作过程简便、适用人群广泛等关键条件。
SVEP1基因位于染色体9q32上,覆盖214kb的基因组DNA[14]。转录本由48个外显子(12 356 bp)组成。SVEP1蛋白质由3 571个氨基酸组,具有多个结构域,包括Sushi domain、von Willibrand factor type A domain、表皮生长因子结构域、透明重复结构域和五聚蛋白结构域[15-16]。因此,SVEP1 也被称为 Poly⁃dom。SVEP1是整合素α9β1的配体,参与细胞黏附过程[17]。整合素在肿瘤中的表达常有显著差异,有利于肿瘤细胞的浸润和转移,并在配体促肿瘤血管形成作用下,与转移瘤的形成和肿瘤复发有关[18]。因此,使用SVEP1的免疫组化评分预测肝癌的复发转移有一定的可行性。Huhn等[19]通过大规模的肿瘤细胞基因组测序,分析14 661个编码蛋白的突变情况,通过筛选共得到189个肿瘤相关基因。这些基因功能涉及细胞黏附、信号传导和转录调控等方面。其中PKHD1与结直肠癌细胞黏附和运动功能高度相关。Ward等[5]对PKHD1突变的结直肠癌患者进行研究,结果发现PKHD1有可能对结直肠癌的发生、发展起到一定的保护作用。目前PKHD1在肝癌中的研究较为广泛,但作为评估肝癌术后复发转移的指标尚未有较为明确的报道。P53作为一种抑癌基因,在许多肿瘤的进展过程中起到了一定的作用,与肿瘤的临床病理因素密切相关[6,20]。许多研究证实了P53基因的突变与肝癌的分化、进展及侵袭性相关[21-22]。同时,用免疫组化的方法检测P53蛋白能较好的反映P53基因的突变[23]。因此,本研究采用免疫组化法检测SVEP1、PKHD1、P53三种指标在原发性肝癌中的表达情况,通过免疫组化评分将其表达情况量化,同时预测肝癌的复发情况有一定的可行性及创新性。
在SVEP1、PKHD1、P53的免疫组化评分的ROC曲线中,三者的ACU面积分别为0.861、0.829、0.716,从侧面反映SVEP1、PKHD1预测肝癌复发有一定的准确性,而P53准确性则一般,不作为首选推荐指标预测肝癌的复发。三个指标的临界值分别为4、4、1分,将其重新按临界值分组后,进行生存分析,得出SVEP1、PKHD1均是免疫组化评分分值较低组为高危组,而P53则是分值较高(突变)组为高危组,且不同指标高危组与低危组的生存具有显著性差异。因此,SVEP1、PKHD1、P53均为肝癌复发的保护因素,而SVEP1、PKHD1可作为生物学指标预测肝癌复发。
