添加植物乳杆菌对低水分稻秸青贮微生物组成影响研究
2019-03-23司华哲李志鹏南韦肖金春爱李光玉刘晗璐
司华哲,李志鹏,南韦肖,金春爱,李光玉,刘晗璐
(中国农业科学院特产研究所,吉林 长春 130112)
青贮是一个包含复杂的微生物活动和营养物质变化的过程,其原理是首先通过创造无氧或少氧环境,抑制好氧微生物繁殖,然后促进原料上附着的厌氧微生物乳酸菌以其中的可溶性糖为底物发酵生成乳酸,降低青贮pH值,再抑制其他厌氧微生物生长,从而减少青贮营养成分的消耗,提高青贮发酵品质,达到长期保存并保留更多的原料营养价值的目的[1-2]。青贮过程中微生物组成变化与发酵产物,尤其是挥发性脂肪酸的生成息息相关。大量研究发现,优势微生物的种类将直接影响青贮的品质[3-5]。
高通量测序技术的不断发展和广泛应用,打破了以往变性梯度凝胶电泳(denaturing gradinent electrophoresis,DDGE),实时荧光定量PCR(quantitative real-time polymerase chain reaction,qPCR),末端限制性片段长度多样性(terminal-restriction fragment length polymorphism,T-RFLP)等分子技术只局限优势或已知微生物的缺点,全面呈现了青贮过程中复杂的微生物组成及变化[6-9]。陶莲等[10]应用高通量测序技术研究了原料附着及青贮后微生物组成变化;McGarvey等[3]应用高通量技术研究了青贮过程微生物动态变化;Ennahar等[5],Eikmeyer等[11]通过高通量技术研究了不同青贮原料微生物组成变化研究。较多应用高通量测序技术的青贮微生物组成研究均集中在常规青贮方法或较好的青贮材料中微生物组成变化[3,5,11],对于低水分青贮发酵过程微生物组成变化关注较少。因此,本试验以低水分粳稻秸秆为研究对象,以高通量测序为技术手段,以添加植物乳杆菌为试验组,以青贮过程中微生物组成变化及与挥发性脂肪酸间的关系为主要研究方向,对青贮过程中微生物变化及其代谢产物进行研究,为更好地了解青贮过程中微生物的重要作用提供更多科学依据。
1 材料与方法
1.1 试验材料与设计
以实验室前期分离鉴定的植物乳杆菌(Lactobacillusplantraum)S2406作为试验菌株。以吉林省长春市双阳区种植的粳稻(Oryzasativa)副产品秸为青贮材料(含水量47%)。使用半径4 cm,高20 cm,壁厚0.1 cm,容积为1 L的螺口树脂瓶作为青贮容器。
试验根据添加物质分为2个处理组:试验组(SS)喷洒植物乳杆菌S2406,添加量为5×106cfu·g-1FM;对照组(CS)喷洒等量的无菌水。
1.2 低水分青贮制作
2016年10月7日,将刈割脱粒后的粳稻秸秆切碎至1.0~1.5 cm长短,使用无菌水稀释植物乳杆菌培养液后,均匀喷洒于稻秸上,喷洒量为5×106cfu·g-1FM。取950~1000 g充分混合后稻秸快速压实填紧于树脂瓶中;对照组的制作喷洒等量的无菌水。青贮瓶放置于室温下,试验期60 d。每日检查瓶口封闭状态,如有松动及时旋紧瓶盖。
1.3 样品采集与分析
试验3、5、7、10、15、30、60 d后分别开瓶取青贮样品30 g,放入灭菌处理的500 mL锥形瓶中,加入270 mL无菌蒸馏水,搅拌均匀后放入4 ℃冰箱静置12 h,收集上清液后使用气相色谱仪(安捷伦 6890N,美国)测定该滤液挥发性脂肪酸(volatile fatty acid,VFA)含量。
另取青贮样品10 g进行青贮微生物组DNA提取,使用MP公司Fast DNA spin kit for feces试剂盒。每个样品分别提取3个DNA样本混合后进行PCR,将PCR产物送到上海生工生物公司使用Miseq测序平台对细菌基因组的16S rDNA进行测序。
1.4 数据分析
通过Flash软件(FLASH v1.2.7)融合双末端序列。采用prinseq软件(PRINSEQ-lite 0.19.5)截掉质量低的数据,按照97%相似性将序列聚类为不同的操作分类单元(operational taxonomic units,OTU)。OTU聚类采用的软件为uclust版本(uclust v1.1.579),采用软件RDP classifier进行物种分类[12]。通过 QIIME 1.9.0计算菌群α多样性指数(覆盖度指数,ACE,Chao1,Simpson,Shannon)。对所取得OTU数据使用Canoco 4.5进行主成分分析(principal components analysis, PCA)并绘图,采用SPSS 20.0软件中独立T检验分析差异性,P<0.05表示差异显著。使用spearman进行青贮微生物丰度与挥发性脂肪酸的相关性分析,取P<0.05,r>0.6分析结果使用Cytoscape 3.4.0绘制互作关系图。
2 结果与分析
2.1 添加乳杆菌对低水分稻秆青贮过程中VFA生成影响
青贮过程中VFA生成量如表1所示,5~60 d处理组乙酸生成显著高于对照组(P<0.05),10~60 d对照组的丙酸、正丁酸(除15 d处理)、异丁酸、正戊酸、异戊酸生成量显著高于处理组(P<0.05)。两组中乙酸的含量从5 d后随时间增加均逐渐增加。这表明,添加植物乳杆菌可以显著降低青贮过程中丙酸、正丁酸、异丁酸、正戊酸、异戊酸的生成并可提高乙酸的生成。
2.2 添加乳杆菌对低水分稻秸秆青贮微生物组成影响
由表2可知,青贮中所有样品Coverage指数均大于0.92,测序深度基本可代表青贮过程中微生物的核心组成。通过聚类分析,共获得4858个OTUs归类于15个菌门,496个属。OTU数量与Shannon指数上,对照组显著高于试验组(P<0.05),其他α多样性指数并未存在差异,这表明,添加植物乳杆菌可以减少青贮中细菌多样性,但对细菌的丰度及均匀度并无显著影响。
青贮过程中两组微生物(门水平)组成如图1a所示,两组在青贮过程中优势微生物菌门均为变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)。其他菌门中包括拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)和蓝菌门(Cyanobacteria)等。其中,对照组变形菌门占比较高为(72.8%~95.9%),其次为厚壁菌门(3.9%~26.8%),处理组则相反,其含量最高菌门为厚壁菌门(54.5%~93.9%),其次为变形菌门(5.4%~43.9%)。这说明添加植物乳杆菌可以提高青贮中厚壁菌门的丰度,极大抑制变形菌门所占比例。
青贮过程中两组微生物(属水平)组成如图1b所示,对照组的优势菌为肠杆菌属(Enterobacter)(丰度均>53%),其次为乳杆菌属(Lactobacillus),克雷伯氏杆菌属(Klebsiella),沙雷氏菌属(Serratia),乳球菌属(Lactococcus),泛菌属(Pantoea),柠檬酸杆菌属(Citrobacter),拉乌尔菌属(Raoultella),肠球菌属(Enterococcus),沙门氏菌属(Salmonella),梭菌属(Clostridium)。试验组优势微生物为乳杆菌属,其次为肠杆菌属,其他菌属含量均低于对照组,这表明添加乳杆菌可提高乳杆菌属的丰度,降低肠杆菌属及其他菌属的丰度。由图2可知,前两个主成分分别解释了总变量的97.9%和1.3%,两组间距离较远且组内相近,这表明两组间细菌组成有显著区别。添加植物乳杆菌可以显著的改变青贮微生物组成。

表1 低水分粳稻青贮发酵过程挥发性脂肪酸生成量 Table 1 Volatile fatty acids content in low moisture rice stalk ensiling (μmol·g-1 FM)
注:同列不同小写字母表示数值差异显著(P<0.05)。CS:对照组; SS:试验组; s.e.m:标准误。下同。
Note:The values within column with different letters indicate different significantly (P<0.05). CS: Control group; SS: Treatment group; s.e.m: Standard error of mean. The same below.
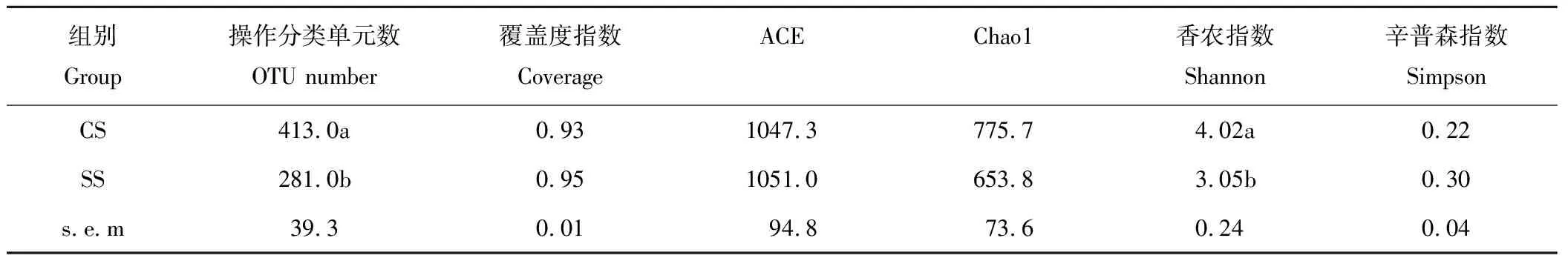
表2 低水分粳稻青贮过程中细菌的操作分类单元数和α多样性指数 Table 2 OTU number and α-diversity index in low moisture rice stalk ensiling
2.3 低水分稻秸青贮微生物与VFA互作关系
青贮过程中微生物与挥发性脂肪酸互作关系如图3所示,乳杆菌属表现出与乙酸正相关,戊酸负相关,同时与肠杆菌属、柠檬酸杆菌属、芽孢杆菌属(Bacillus)、日沟维肠杆菌属(Pluralibacter)、乳球菌属、魏斯氏菌属(Weissella)等6属微生物呈负相关,这些微生物均表现出与丙酸、正丁酸、异丁酸、正戊酸、异戊酸其中2或3种VFA正相关。乳球菌属、厌氧杆菌属(Anaerobacter)、肠球菌属、梭菌属均表现出与丙酸、正丁酸、异戊酸正相关;戊酸与气球菌属(Aerococcus)、芽孢杆菌属、柠檬酸杆菌属、梭菌属、肠杆菌属、欧文氏菌属(Erwinia)、哈夫尼菌属(Hafnia)、克雷伯氏菌属、欧美杨溃疡病菌属(Lonsdalea)、类诺卡菌属(Nocardioides)、泛菌属、日沟维肠杆菌属、沙门氏菌属、沙雷氏菌属、特布尔西氏菌属(Trabulsiella)等15种微生物菌属表现出正相关。肠杆菌属、芽孢杆菌属、柠檬酸杆菌属、勒克氏菌属(Leclercia)、日沟维肠杆菌属等5属微生物与乙酸表现出负相关;魏斯氏菌属表现出与丙酸、异丁酸正相关。

图1 低水分粳稻青贮过程中微生物组成丰度Fig.1 The relative abundance of bacterial community in low moisture rice stalk ensiling
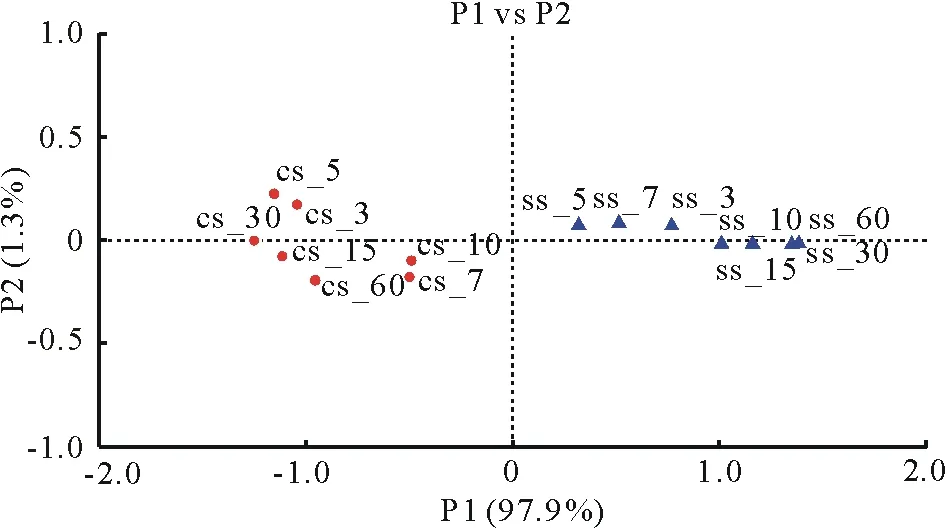
图2 CS,SS处理组微生物组成主成分分析(PCA)Fig.2 Microbial structure PCA analysis in CS and SS group P1代表第一主成分,P2代表第二主成分。P1 presents the first principal component,P2 presents the second principal component.
3 讨论
我国农副秸秆资源丰富,东北地区作为我国主要粮食种植区之一,其稻秸年产量约为1.89亿t[13],但对秸秆综合利用的不足导致大量秸秆被堆放在田间或随意焚烧,对空气造成严重污染。自然风干后的稻秸是一种劣质的粗饲料,即使反刍动物也很难加以分解利用,这也是制约稻秸作为动物粗饲料的主要因素,而经过加工处理后的秸秆,可提高反刍动物的采食量和消化率[14]。其中生物法加工秸秆饲料因其可较好的保留秸秆营养价值且延长其保存时间等优点已在我国畜牧生产中普遍推广使用[15]。秋收后,稻秸多经暴晒,水分含量较低,仅适宜制作低水分青贮。低水分青贮因其水分较低,糖分较少等原因多使用添加剂提高青贮效果,其中添加乳酸菌可克服原料本身附着乳酸菌少等缺点,加速青贮过程,提高发酵品质[16-17]。
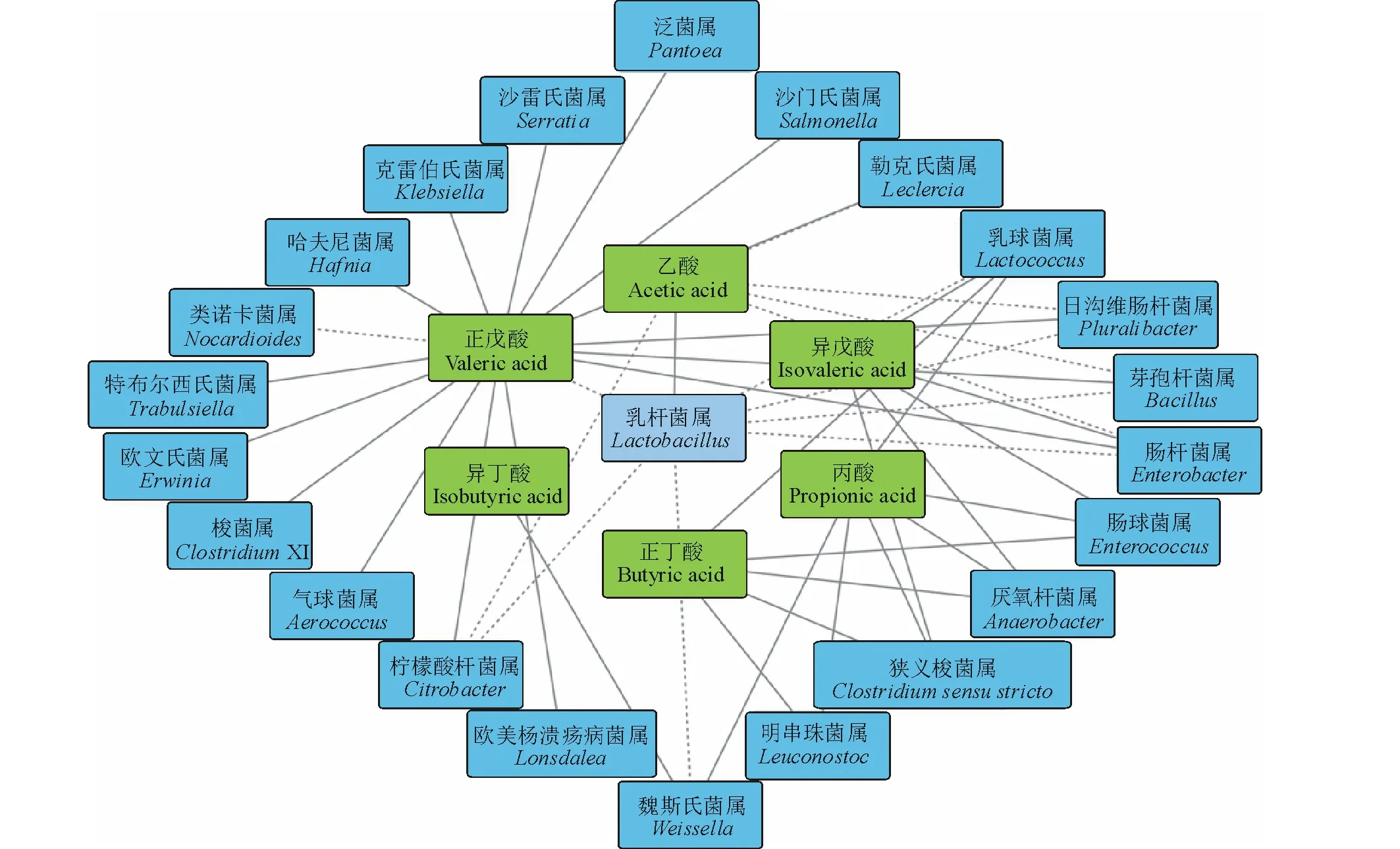
图3 低水分粳稻青贮微生物与VFA互作关系Fig.3 Co-occurrence network analysis among microbial populations and contents of VFA in low moisture rice stalk silage 图中蓝色方块代表微生物种属,绿色方块代表挥发性脂肪酸种类。每对互作关系(实线为正相关r>0.6,虚线为负相关r<0.6)P值均小于0.05。Colored nodes represent bacterial population (blue), VFAs (green). Each co-occurring pair has an absolute Spearman rank correlation above 0.6 [Solid line: Positive correlation (r>0.6); Dotted line: Negative correlation (r<0.6)] with significance level under 0.05 level.
本试验中,青贮60 d后植物乳杆菌添加组与对照组相比,处理组pH值显著低于对照组(P<0.05),且干物质、粗蛋白、水溶性碳水化合物含量均有显著提高(P<0.05),同时氨态氮含量显著降低(P<0.05),而中性洗涤纤维、酸性洗涤纤维、粗脂肪和粗灰分含量无显著差异(P>0.05)[18],这表明添加植物乳杆菌可以降低青贮干物质、粗蛋白和水溶性碳水化合物的损耗,直接提高低水分粳稻青贮的发酵品质。青贮过程中,挥发性脂肪酸的生成受微生物直接影响。微生物通过利用青贮原料中的水溶性碳水化合物生成挥发性脂肪酸。试验组各种挥发性脂肪酸生成量均低于对照组,这与前人的试验结果一致[19-20]。添加乳酸菌可以抑制青贮过程中各种好氧腐败菌,降低营养物质的损失。本试验中,两组乙酸含量均表现逐渐累积,这与刘晗璐[21]使用禾本科牧草青贮的试验结果一致,导致这种结果的原因可能是在青贮中可以分解利用乙酸的微生物种类较少,数量较低。挥发性脂肪酸虽然可作为反刍动物的直接供能物质,被瘤胃直接吸收利用,但从青贮窖到动物食槽的距离过长,或长期堆放在食槽内易损失,这浪费了青贮的营养价值,且好氧腐败菌在生成挥发性脂肪酸的过程往往伴随大量粗蛋白、水溶性碳水化合物的损失[12]。因此,添加乳酸菌降低挥发性脂肪酸的生成可保留更多的营养价值。
本试验中,添加植物乳杆菌降低了青贮过程中细菌的多样性且青贮过程中含量较高的菌门等结果与前人的试验结果是一致的[22],这说明低水分青贮的微生物在菌门组成上与普通青贮一样,多由厚壁菌门和变形菌门主导的,但对照组变形菌门所占丰度最高,变形菌门是革兰氏阴性细菌,是细菌中最大的一门,包括很多病原菌,如大肠杆菌(Escherichiacoli)、沙门氏菌、弧菌(Vibrio)和螺杆菌(Helicobacterpylori)等种类[10],因此常规手段制作的低水分粳稻青贮可能对饲喂动物的健康造成严重影响,而外源添加植物乳杆菌不仅可提高青贮的发酵品质,还可增加低水分青贮饲料的安全性。添加植物乳杆菌可以降低青贮pH值,抑制其他微生物繁殖从而降低青贮细菌的多样性。
Cai等[23]分析了不同时期水稻青贮中分离到的161株乳酸菌,将这些菌株主要分类为乳杆菌属、乳球菌属、明串珠菌属、肠球菌属、片球菌属(Pediococcus)和魏斯氏菌属。本研究测序结果中也分别检测到了这6属乳酸菌,本试验中优势乳酸菌属为乳杆菌属,乳杆菌属在青贮过程中起到的重要作用已被多次证明[11,24-25]。对照组与处理组均存在肠杆菌属,且对照组优势微生物为肠杆菌属,Redford等[26]研究发现在作物生长环境中,肠杆菌属均为优势微生物种类;McGarvey等[3]研究发现肠杆菌属在紫花苜蓿(Medicagosativa)青贮前期为优势微生物,但随着青贮时间的延长其丰度逐渐降低。本研究中,青贮原料为粳稻秸秆,中空,难以压实,为青贮好氧菌繁殖阶段提供了较多的氧气,利于原料附着的肠杆菌属的繁殖,并进入了以肠杆菌属为优势菌主导的稳定期,因为低水分青贮对原料糖分含量及最终的pH值高低要求不高,所以本试验对照组以肠杆菌为优势菌属的粳稻青贮并不能定义为失败;而试验组在青贮初期接种大量乳杆菌利用原料中的可溶性糖迅速繁殖,产生大量乳酸,抑制其他种属微生物的繁殖,进入了以乳杆菌属为主的发酵稳定期。青贮饲料中的肠杆菌尽管不被认为属于致病菌,但因其会与乳酸菌竞争性利用水溶性碳水化合物,并同时降解蛋白质,产生毒素生物胺,既影响青贮口味又阻碍青贮饲料pH的降低;另外在青贮环境下肠道细菌还能将硝酸盐转化为亚硝酸盐[10]。因此,添加乳杆菌对改善低水分粳稻秸秆青贮微生物组成,提高发酵品质有重要意义。
前人研究发现青贮中丰度占比前十的细菌属(种)主要有片球菌、类芽孢杆菌(Paenibacillus)、嗜菌属(Variovorax)、斯瓦米纳坦杆菌属(Swaminathania)、黄杆菌属(Flavobacterium)、鞘氨醇单胞菌属(Sphingomonas)、假单胞菌属微小杆菌(Pseudomonasexiguobacterium)、根瘤菌属(Rhizobium)、不动杆菌属鞘氨醇菌(Sphingomonaspaucimobilis)、布赫纳氏菌属(Buchnera)、魏斯氏菌、乳杆菌属、薄层菌属(Hymenobacter)和欧文氏菌属等[10,27]。在本研究中,丰度占前十的有肠杆菌属、乳杆菌属、克雷伯氏菌、沙雷氏菌、乳球菌属、泛菌属、柠檬酸杆菌属、拉乌尔菌属、片球菌属、沙门氏菌属。其中克雷伯氏菌和沙门氏菌属于致病菌[28-29],泛菌属、沙雷氏菌属和肠杆菌属可以产生对动物体有害的组胺[30],而处理组中以上菌属丰度均低于对照组,这表明添加乳杆菌可抑制其他微生物的繁殖,并提高青贮饲料的安全性。因此,添加外源乳杆菌可以改变低水分青贮的微生物组成,提高其发酵品质,使其达到常规青贮的水平。
大量国内外文献均报道了微生物与VFA互作关系,Wang等[31]发现瘤胃VFA浓度与反刍兽月形单胞菌(Selenomonasruminantium)和埃氏巨球形菌(Megasphaeraeldenii)的数量相关。Carberry等[32]基于变性梯度凝胶电泳发现普雷沃氏菌(Prevotellaspp.)与异丁酸和异戊酸的浓度呈负相关。Mao等[33]采用454测序平台分析了奶牛粪便中细菌区系和VFAs浓度,结果发现粪便中短链挥发性脂肪酸和支链挥发性脂肪酸分别与不同的菌群相关。但显有研究专注于青贮过程中,微生物与VFA互作联系。在之前结果中,添加乳杆菌可以减少挥发性脂肪酸的生成,而互作关系图中乳杆菌属与肠杆菌属、柠檬酸杆菌属、芽孢杆菌属、日沟维肠杆菌属、乳球菌属、魏斯氏菌属等微生物呈负相关,这些微生物均表现出与2或3种VFA正相关,这为试验中添加乳杆菌减少VFA的生成量的结果提供了新的解释思路,由于乳杆菌抑制了这6属微生物的数量,从而影响了青贮挥发性脂肪酸的生成,乳杆菌在青贮发酵过程中,可以利用底物生成乳酸,乳酸的大量生成降低了青贮pH值,从而抑制了一些产挥发性脂肪酸的微生物。乳酸菌分为同型发酵乳酸菌和异型发酵乳酸菌,其中同型发酵乳酸菌发酵产物为乳酸,而异型发酵乳酸菌可利用乳酸生成乙酸[34],如布氏乳杆菌(Lactobacillusbuchneri)等,这解释了乳杆菌属与乙酸正相关的结果。肠杆菌属、芽孢杆菌属、柠檬酸杆菌属、勒克氏菌属、日沟维肠杆菌属与乙酸分析为负相关,其原因可能是乙酸具有较强的抑菌效果[35];试验分析得出乳杆菌属与肠杆菌属、芽孢杆菌属、柠檬酸杆菌属、日沟维肠杆菌属负相关,这种结果的原因可能与乳酸菌生成乳酸导致pH值的降低有关,也可能与乳杆菌属与乙酸含量正相关,同时乙酸与这4属微生物负相关的结果有关,由于异型发酵乳杆菌对乙酸的生成有促进作用及乙酸的抑菌效果导致这样的互作关系。互作关系图中22属微生物都分析出与除乙酸外其他VFA的正相关,应与这些微生物利用水溶性碳水化合物后发酵产物有关,但在这些微生物中,气球菌属[36]、肠杆菌属[29]、欧文氏菌属[30]、哈夫尼菌属[30],克雷伯氏菌属[28]、欧美杨溃疡病菌属[37]、类诺卡氏属[38]、泛菌属[30]、日沟维肠杆菌属[39]、沙门氏菌属[29]、沙雷氏菌属[30]、特布尔西氏菌属均为致病菌、条件致病菌或可产生对动物体有害的物质[28-30,36-40]。明串珠菌属,魏斯氏菌属,芽孢杆菌属和乳酸球菌属等属于益生菌[41],但均表现与乳杆菌属负相关,其中明串珠菌属、魏斯氏菌属和乳酸球菌属均属于乳酸菌,耐酸性更强的乳酸菌在青贮过程中会逐渐成为优势乳酸菌,乳杆菌耐酸性更强,在pH值较低情况下,仍可繁殖,但其他种类乳酸菌因pH值过低受到抑制。乳杆菌属丰度与戊酸含量呈负相关,这也验证了本试验中外源添加乳杆菌通过各种直接或间接影响抑制产戊酸微生物数量的试验结果。
4 结论
添加植物乳杆菌后可以显著减少低水分青贮的丙酸、正丁酸、异丁酸、正戊酸和异戊酸的生成量,并提高乙酸生成量,并可抑制以肠杆菌属为主的多种青贮无益微生物,降低微生物多样性,增加厚壁菌门,乳杆菌属的丰度,抑制变形菌门,肠杆菌属的丰度。微生物组成变化直接影响青贮挥发性脂肪酸的生成,两者间的互作关系为以后揭示微生物在青贮过程中的重要作用提供了更多的基础。
