草甘膦抗性和磷高效吸收复合基因转化玉米的研究
2019-03-22曹智张晶晶张志恒王威石菁王朋宝张金文
曹智,张晶晶,张志恒,王威,石菁,王朋宝,张金文
(1.甘肃省干旱生境作物学重点实验室,甘肃农业大学农学院,甘肃 兰州 730070;2 甘肃农业大学资源与环境学院,甘肃 兰州 730070;3.甘肃天亿兴种业有限责任公司,甘肃 金昌 737205)
草甘膦是一种内吸传导型广谱灭生性除草剂,是目前世界上用量最大的除草剂[1],其杀草机理是竞争性抑制5-烯醇式丙酮酰莽草酸-3-磷酸合成酶(5-enolpyruvylshikimate-3-phosphate synthase,EP SPs)的活性,使芳香族氨基酸合成受阻,从而使植株死亡[2].EPSPs主要定位在叶绿体中[3],Rubisco叶绿体转运肽(chloroplast transit peptide,CTP)可以将其定位到叶绿体中[4],而细菌来源的EPSPs基因不含有叶绿体转运肽[5-6],在植物中应用须整合外源叶绿体转运肽.尽管在1978年Rubisco小亚基前体转运肽就已经被克隆,但到目前为止,被克隆且功能被确认的叶绿体转运肽并不多[7],因此,Rubisco小亚基叶绿体转运肽对培育抗草甘膦作物品种有着重要的意义.
众所周知,磷是作物生长所必需的大量元素之一,是提高作物产量、保持品种优良特性的重要元素[8].在我国约有2/3的耕地缺磷[9],特别是北方土壤偏碱性,许多土壤中的磷素呈固定态,难以被植物吸收利用,为此在作物生长期间需要施用大量的磷肥.但研究表明,磷肥施入土壤后,能很快地被吸附到土壤颗粒表面或与土壤一些物质(Fe2+、Al3+、Ca2+)等生成难溶的磷酸盐[10],从而影响磷肥利用率,只有不到20%的磷肥能被当季的作物利用[11].植酸酶即肌醇六磷酸水解酶,是一种磷酸酯酶,可以特异地催化植酸及将植酸盐水解成肌醇与磷酸(或磷酸盐)[12].一些植物在缺磷胁迫条件下可通过分泌大量植酸酶来有效利用土壤中的有机磷[13],研究人员已将植酸酶基因成功导入植物(烟草[14]、拟南芥[15]、油菜[16]、玉米[17]、水稻[18]等),转基因植株中表达的植酸酶可在信号肽引导下分泌到根外,可分解植酸态磷供其利用,增强对土壤中磷素的利用.
在玉米的转基因研究中,人们已经成功获得了具有抗虫[19]、抗病[20]、抗非生物逆境[21]以及抗除草剂[22]等种质,抗除草剂的转基因玉米品种更是被广泛种植.现如今转基因研究的重点已逐渐转向了抗逆与高产优质兼有的复合性状转基因作物研究上,并取得了阶段性成果[23].如果通过转基因技术,将来源于微生物的抗草甘膦基因和植酸酶基因导入玉米中,使其具备草甘膦抗性并且能在根系中高效表达植酸酶,促进根系对有机态磷的利用,更加有效地吸收利用磷资源,将会大大节约磷肥,降低玉米生产成本,提高玉米产量.
本研究构建由Ubiquitin1启动子驱动的含有两种叶绿体转运肽的CP4EPSPs基因和根部特异性启动子GLU1P驱动的植酸酶基因phyA2的植物表达载体,通过农杆菌介导转化玉米,以期为培育磷高效吸收且具有草甘膦抗性的优良复合性状玉米品种打下基础.
1 材料与方法
1.1 材料与试剂
玉米种质材料选用‘TY7-2’和‘TY4CV’,由甘肃天亿兴种业有限责任公司提供.其中,‘TY7-2’是从国内著名品种‘郑单958’的父本‘昌7-2’中选出的突变自交系,‘TY4CV’是从‘先玉335’父本‘PH4CV’中选出的稳定自交系,其穗轴为红色.
大肠杆菌DH5α(E.coliDH5α)、根癌农杆菌EHA105(AgrobacteriumtumefaciensEHA105)、植物表达载体pCEPSPS(pCMBIA1300的衍生载体,将原载体中的潮霉素抗性基因(hyg)替换为草甘膦抗性基因(epsps)) 和质粒pMDnos(含NOS终止子),均由甘肃省干旱生境作物学省部共建国家重点实验室培育基地提供, pTOPO-EPSPS(含EPSPs基因)由甘肃省农科院张建平研究员惠赠,植酸酶基因phyA2由中国农业科学院生物技术研究所陈茹梅研究员惠赠.pMD19-T Easy Vector、限制性内切酶、DNA聚合酶、琼脂糖凝胶DNA回收纯化试剂盒及实时定量PCR试剂,均购自宝生物工程(大连)有限公司;PCR引物合成及DNA序列测定由金唯智生物科技(苏州)有限公司完成;植物RNA 提取Trizol试剂盒购自Invitrogen;QuantScript RT Kit cDNA反转录试剂盒购自天根生化科技(北京)有限公司.其他试剂均为进口或国产分析纯.
1.2 PCR引物设计与合成
通过对EPSPs N端氨基酸序列进行预测分析,选择了叶绿体转运肽的核苷酸序列为CC基因序列(ID:X06535),序列长222 bp,编码74个氨基酸.根据载体pCE-NGC3(图1)和pCE-NGM3(图2)构建的酶切位点,并参照EPSPs基因序列(美国Monsanto公司专利:US5633435)、CM基因序列(美国Monsanto公司专利:US0056 33435A)、Ubiquitin启动子序列(ID:DQ141598.1)、根部特异性启动子(GLU1P)基因序列(ID:DQ333310.1)、植酸酶(phyA2)基因序列(ID:EU786167.1)、NOS终止子基因序列(ID:AF485783),采用Oligo7软件设计PCR引物(表1),提交苏州金唯智生物科技有限公司合成.

表1 目的基因的PCR扩增引物
下划线部分为酶切位点,黑体部分为重叠碱基.
The underline representatives restriction sites,the bold type representatives overlapping nucleotide.
1.3 玉米转运肽的检索与生物信息学分析
从GenBank(https:∥www.ncbi.nlm.nih.gov/)检索玉米Rubisco小亚基(rbcS)序列(ID:100279574),通过CBS Predition servers(http:∥www.cbs.dtu.dk/services/)中的和ChloroP 1.1预测rbcS的亚细胞定位及预测其剪切位点.
1.4 目的片段的克隆和合成
以玉米cDNA为模板,用特异引物C1/C2扩增选择的玉米rbcS转运肽(CC)片段;以质粒TOPO-EPSPs基因为模版,用特异引物E1/E2扩增EPSPs基因;CM基因由苏州金唯智生物科技有限公司合成;采用重叠延伸PCR技术[25],将转运肽(CC)片段与EPSPs基因、CM片段与EPSPs基因融合,分别回收目的片段后,连接到pMD19-T载体进行测序,测序正确的命名为pMD-CEPSPS和pMD-MEPSPS.
以玉米基因组DNA为模版,用特异引物U1/U2、G1/G2分别扩增Ubiquitin启动子和根特异性GLU1P启动子,分别回收目的片段,与pMD-19T载体连接并测序,测序正确的命名为pMD-UBI和pMD-GLU1P.
以pMDnos质粒为模版,用特异性引物N1/N2扩增NOS终止子;以pGA1611EAO质粒为模版,用特异性引物P1/P2扩增植酸酶基因(phyA2),分别回收目的片段与pMD-19T载体连接并测序,将其命名为pMD-NOS和pMD-phyA2.
1.5 植物表达载体的构建
通过双酶切[26]和In-Fusion同源重组方法[27],构建植物表达载体pCE-NGC3和pCE-NGM3.用PstⅠ和HindⅢ酶切pMD-NOS和pCEPSPS,回收目的片段,用T4 DNA连接酶连接,获得载体pCE-N; 然后用SacⅠ和XmaⅠ分别酶切pMD-GLU和pCE-N,回收目的片段,用T4 DNA连接酶连接,获得重组子pCE-NG; 再用EcoRⅠ和XhoⅠ分别酶切pMD-CEPSPS、pMD-MEPSPS和pCE-NG,回收目的片段,用T4 DNA连接酶连接,获得重组子pCE-NGC和pCE-NGM; 再用EcorRⅠ和SacⅠ分别酶切pMD-UBI、pCE-NGC和pCE-NGM,回收目的片段,用T4 DNA连接酶连接,获得重组子pCE-NGC2和pCE-NGM2; 最后用XmaⅠ分别酶切pCE-NGC2和pCE-NGM2,用In-Fusion无缝连接技术将phyA2基因连入,获得重组子pCE-NGC3和pCE-NGM3.

图1 pCE-NGC3表达载体结构Figure 1 Chematic diagram of pCE-NGC3 expressing vector structure
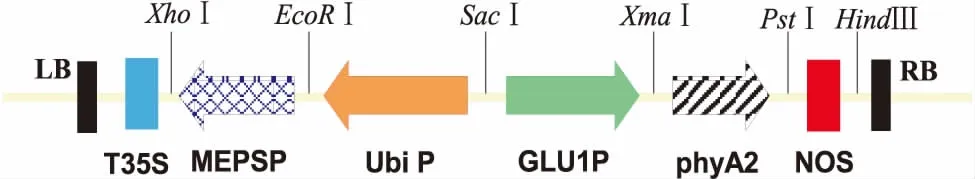
图2 pCE-NGM3表达载体结构Figure 2 Chematic diagram of pCE-NGM3 expressing vector structure
采用CaCl2冻融法[28]分别将2种重组植物表达载体pCE-NGC3和pCE-NGM3导入农杆菌EHA 105感受态细胞,将转化的细胞均匀涂布于含卡那霉素和利福平的YEP固体培养基,28 ℃暗培养28~30 h,挑取单菌落接种到含上述抗生素的YEP液体培养基,28 ℃震荡培养28 h 左右,提取质粒,用特异性引物U1/U2进行PCR鉴定,并保存农杆菌工程菌用于植物转化.
1.6 农杆菌介导的玉米转化及鉴定
挑选饱满的玉米自交系种子,用70%的乙醇浸泡8 min,然后用0.1%的升汞浸泡6 min,再用无菌水冲洗4次,然后用无菌水室温浸泡4~6 h,再用升汞消毒10 min,无菌水冲洗5次,28 ℃黑暗条件下萌发.发芽后转到萌发培养基上继续生长,待苗长至4 cm高时,剥去胚芽鞘和幼叶,暴露出茎尖生长点,用解剖针轻刺生长点,将茎尖浸泡在重悬液中,并在50 kPa压力下侵染7 min,用无菌滤纸吸净多余的菌液,置于萌发培养基上,28 ℃暗条件下继续培养,直至重新长出新叶片.将长出新叶片的幼苗用清水洗掉菌体,移栽到花盆中,2~3周后苗长至三叶期,用0.15%的草甘膦(农达)喷洒在叶片上进行筛选,将存活的植株移栽到温室,开花期套袋自交.收获的种子播种,提取基因组DNA作模板,以野生型植株基因组DNA作阴性对照,用引物E1/E2进行PCR扩增,转化植株预期扩增片段大小为1 368 bp.
1.7 目的基因表达水平分析
转化的目的基因表达分析采用实时定量PCR技术[29].根据实时荧光定量PCR引物设计原则,利用Primer Premier 5.0设计检测EPSPs的引物(上游引物:TTGGTTGCTGCCTTGCTTGT,下游:ATGTCGGCACCCATTTCCTG),内参为玉米Actin基因(上游引物:ATCACCATTGGGTCAGAA AGG,下游引物:GTGCTGAGAGAAGCCAAA ATAGAG).用植物总RNA提取试剂盒提取转基因株系和野生型植株的叶片总RNA,用QuantScript RT Kit cDNA试剂盒合成cDNA 第一链,采用SYBRR Premix ExTaqTMII实时定量PCR试剂盒进行定量分析.反应体系为(20 μL): SybrGreen qPCR Master Mix 10 μL,上、下游引物各0.4 μL,模板2 μL,ddH2O 7.2 μL.
1.8 转基因植株对草甘膦的反应
在2种表达载体(pCE-NGC3和pCE-NGM3)转化的玉米植株长至4~5片叶时,分别喷施0.3%、0.45%、0.6%、0.75% 4个浓度梯度的草甘膦溶液, 10 d后观察植株的受损程度及恢复情况.
1.9 植酸酶活性测定
采用丙酮-磷钼酸铵法[30]对转基因玉米中植酸酶的活性进行测定.配置浓度为0.156 25、0.312 5、0.625、1.25、2.5和5 mmol/L磷酸二氢钾溶液,各取2 mL加入编号的试管中,吸取2 mL蒸馏水做空白对照,每管分别加入8 mL显色液(丙酮∶钼酸铵∶硫酸=2∶1∶1)和1 mL的柠檬酸溶液,用力摇匀显色5 min,在420 nm波长下测定吸光度值.以无机磷浓度为横坐标,吸光度值为纵坐标,绘制标准曲线.提取玉米根组织分泌植酸酶粗提液,采用相同的方法测定D420值,然后按下列公式计算酶活力.
式中,50为反应液中酶液的稀释倍数;N为溶液反应前的总稀释倍数;P为反应液中总磷的浓度减去反应中底磷的浓度(对照标准曲线查得);t为反应时间(min);W为根系样品质量(g).
2 结果与分析
2.1 叶绿体转运肽生物信息学分析结果
利用TargetP1.1和ChloroP1.1预测发现全长170 aa的rbcS序列中含有叶绿体转运肽,切割位点可能位于第46个残基附近(表2).在此基础上确定rbcS的N端74个aa的编码序列为候选片段,碱基长度共222 bp,将其命名为CC.
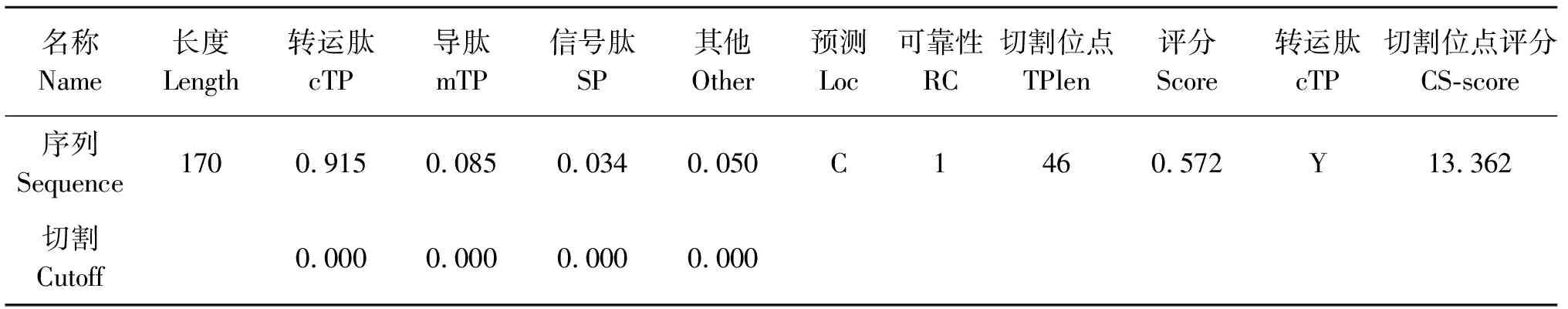
表2 TargetP和ChloroP预测分析结果
2.2 目的基因的克隆
以玉米cDNA为模版,用引物C1/C2扩增编码rbcS转运肽的片段(CC);以质粒TOPO-EPSPs基因为模版,用引物E1/E2扩增EPSPs基因;参照Barry 等[24]CTP序列由苏州金唯智生物科技有限公司合成CM片段;采用重叠延伸PCR技术(splicing-by-overlap extension PCR,SOE-PCR),分别将CC、CM片段与EPSPs基因融合,得到1 605 bp和1 603 bp的融合基因(图3),与克隆载体pMD19-T连接,酶切鉴定后测序,同源性达到了99%和99%.
以玉米基因组DNA为模版,用引物U1/U2、G1/G2分别扩增Ubiquitin启动子和GLU1P根部特异性启动子,得到1 992 bp和1 846 bp特异片段(图3),分别与克隆载体pMD19-T连接,酶切鉴定后测序,同源性达到98%和99%.
以pMDnos质粒为模版,用特异性引物N1/N2扩增NOS终止子;以PGA1611EAO质粒为模版,用特异性引物Z1/Z2扩增phyA2基因,得到253 bp和1 347 bp特异性条带(图3),分别与克隆载体pMD19-T连接,酶切鉴定后测序,同源性达到了100%和98%.

1:CEPSPS;2:MEPSPS;3:Ubi;4:GLU1P;5:NOS;6:phyA2.图3 PCR产物电泳结果Figure 3 Agarose gel electrophoresis to identify the PCR products
2.3 植物表达载体pCE-NGC3和pCE-NGM3的构建及检测
酶切和测序结果均证明成功构建了pCE-NGC3和pCE-NGM3载体,分别导入农杆菌菌株EHA105感受态细胞.提取质粒,用引物U1/U2进行PCR鉴定,目标条带大小与预期一致,证明目标载体已成功转入农杆菌.
2.4 转化再生苗的获得及检测
将转化苗用清水洗掉菌体,移栽到花盆中,2周后长至三叶期,经过0.15%的除草剂筛选后,共有23株幼苗存活(图4).提取抗性植株叶片的基因组DNA,进行PCR扩增检测,其中9株检测呈现阳性(图5),初步说明外源基因已整合到9株转化植的基因组中,其中‘TY7-2’4株(转CEPSP基因2株、转MEPSP基因2株)、‘TY4CV’5株(转CEPSP基因2株、转MEPSP基因3株).
2.5 EPSPs基因在转基因植株叶片中的表达水平
RT-qPCR检测结果显示(图6),与野生型植株(CK)相比,转基因植株叶片中EPSPs基因的表达量明显提高,但不同转化植株中的表达量存在一定的差异,这种差异不但在两种载体转化植株间存在,而且在同一转化载体的不同转化品种间也存在.总体上来看,在转化的转基因植株中,玉米叶绿体转运肽(CC)与EPSPs融合的基因(CEPSP)要比Barry 等[24]报道的融合转运肽(CM)基因的表达量平均提高了31%.由此说明,不同叶绿体转运肽对外源基因在叶片的表达量有一定的影响.

A:种子萌发;B:侵染前的茎尖;C:侵染;D:共培养;E:移栽成苗;F:筛选.A:seed germination;B:The stem apex before infection;C:Infection;D:co-culture;E:The seedlings were transplanted;F:The resistant seedlings after herbicide selection.图4 农杆菌介导玉米茎尖遗传转化Figure 4 Agrobacterium tumefaciens mediated genetic transformation of maize shoot apical meristem
2.6 转基因植株对草甘膦抗性的比较
在转基因植株长至4~5片叶时,分别喷施0.3%、0.45%、0.6%、0.75% 4个浓度梯度的草甘膦溶液,10 d后统计转基因植株的受损程度及恢复情况.随着喷洒浓度的增加,植株存活率下降(表3),在喷洒0.6%的草甘膦后,两种载体转化的植株都出现叶尖发黄干枯,但转MEPSP植株叶片萎蔫早且受损严重,开始表现出叶尖及下部叶片变黄,叶色变深发褐、植株逐渐萎蔫、最终绝大多数死亡,少量存活植株也表现出生长停滞和畸形,而转CEPSP植株的叶片受损程度轻且症状不明显,植株表现出更好的抗性,仍能正常生长存活.

N:野生型植株;1~7:转化植株.N:Untransformed plant;1~7:Transgenic plants.图5 部分玉米转基因植株的PCR检测Figure 5 PCR detection of partially transformed regenerated plants
2.7 转基因植株根系植酸酶基因表达及活性分析
以无机磷的浓度为横坐标,以吸光值为纵坐标,绘制磷标准曲线,直线回归方程为Y=0.19X+0.017 7,R2=0.999 6,R>0.99,说明该曲线有比较准确的线性关系.
由图7可知,转基因植株的植酸酶酶活力有很明显的提高,相比于CK植株,转化植株的植酸酶酶活力提高15.9~23.8倍,平均提高18.7倍.从而证明植酸酶基因已在转基因植株根部表达,并分泌能降解植酸盐的植酸酶.
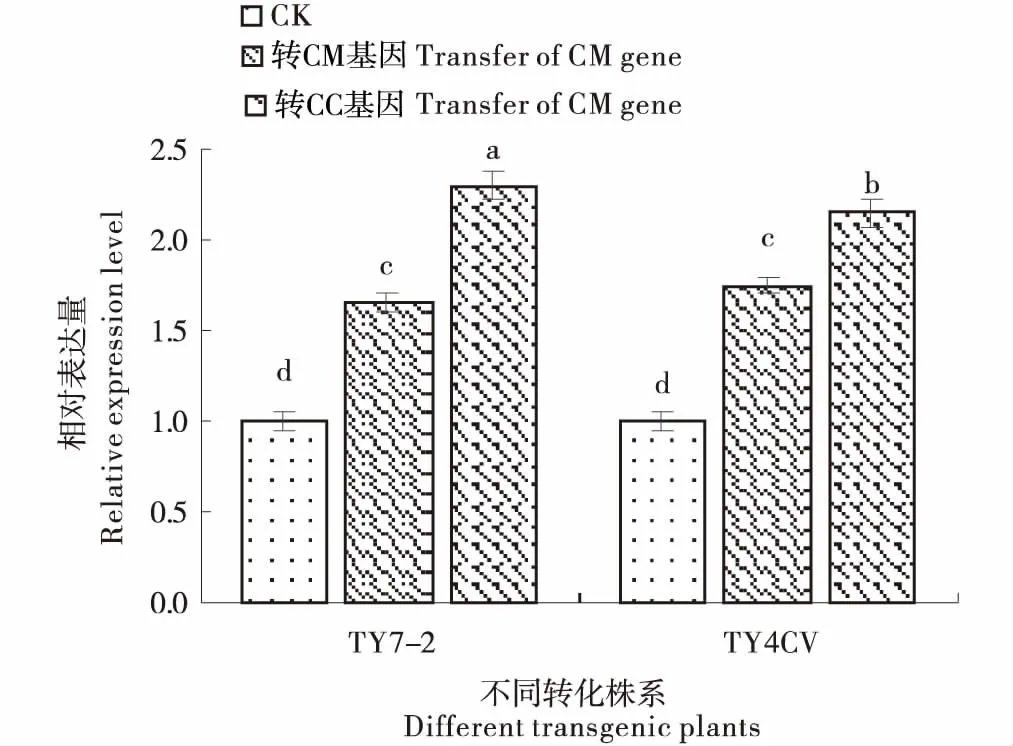
图6 不同转化株系中叶片EPSPS基因的相对表达量Figure 6 Relative expression of EPSPS gene in leaves of different transformed lines

草甘膦浓度/%Glyphosate concentration转MEPSP基因植株Transfer of MEPSP gene转CEPSP基因植株Transfer of CEPSP gene0.30正常生长正常生长0.45叶片局部变黄,数量极少正常生长0.60叶片片状干枯并向内卷曲,生长受到抑制叶尖、叶缘黄枯,其他部位良好0.75植株生长停滞,萎蔫死亡部分植株呈全株性萎蔫,叶片变褐,缓慢枯死

图7 不同植株根部的植酸酶活性分析Figure 7 Phytase activity analysis of different plant roots
3 讨论
随着世界农业生产向着机械化和集约化方向发展,抗除草剂转基因作物已成为一种普遍的种植需求.草甘膦抗性成为作物重要的农艺性状,从上世纪80年代,人们便开始寻找具有草甘膦抗性的EPSPs基因[31].EPSPs基因主要定位在叶绿体中[3],而具有草甘膦抗性的EPSPs基因大多来源于细菌,需要在其5’端整合可以将外源蛋白定位到叶绿体中的转运肽[32],不同植物中同一种蛋白质的转运肽虽具有相似的定位功能,但序列无明显的保守性[33],选择合适的叶绿体转运肽很可能提高转基因植物蛋白的表达量.本研究利用TargetP和ChloroP软件分析挑选玉米叶绿体转运肽,构建pCE-NGC3和pCE-NGM3载体,使用农杆菌EHA105对玉米茎尖进行侵染,获得转基因阳性植株.RT-qPCR检测结果表明,pCE-NGC3载体转化植株比pCE-NGM3载体转化植株的基因表达量平均提高了31%.可见该转运肽不仅具有将外源基因定位到叶绿体中的功能,还能提高外源基因的表达.叶绿体转运肽能提高转基因植株中外源基因表达的原因可能是叶绿体转运肽的核酸序列让外源基因的mRNA更稳定.比如DeAlmeida等[34]发现编码新霉素转磷酸酶Ⅱ和草丁膦乙酰转移酶的外源基因在整合叶绿体转运肽后在转基因植物的叶片中具有更高的mRNA稳定性.
转基因作物能否承受大剂量的除草剂,这是抗除草剂作物能否在田间应用的重要指标.Castle 等[35]将改造优化后的GAT转入玉米后,获得了具有6倍剂量草甘膦抗性的转基因玉米植株.余桂容等[36]将含有2 个耐草甘膦基因(2mG2-epsps和R79-epsps)的双价植物表达载体转入玉米中,获得的转基因玉米最高可耐受0.6%的草甘膦浓度,相当于田间使用浓度的3倍.本研究利用高浓度草甘膦喷洒转基因玉米植株,发现0.6%的除草剂浓度会使转基因玉米植株受到伤害,但受损的程度轻且症状不明显.因此,通过优化叶绿体转运肽对提高草甘膦抗性也有重要的实际意义.
1907年开始,Suzuki等[30]人首次在米糠中发现了植酸酶,并发现植酸酶有超强的降解植酸的能力,从此对植酸酶就进行深入而广泛的研究.迄今为止,100多年来已经从真菌、细菌以及植物中分离和鉴定了多个植酸酶基因.本研究将从黑曲霉中分离的phyA2基因在玉米根部特异性启动子ZmGLU1P的驱动下导入玉米中,获得转基因玉米植株,使植酸酶基因能够在转基因植株根部表达并分泌植酸酶.通过对根部植酸酶活性测定结果显示,转基因植株中植酸酶活性相比野生型植株平均提高18.7倍.表明根组织蛋白提取液中含有植酸酶成分,对植酸钠具有降解作用,这与刘强等[37]的研究结果一致.Richardson等[15]将植酸酶基因导入拟南芥,通过试验研究发现拟南芥分泌的外源植酸酶是提高土壤磷素利用率的主要因素.植物对土壤中植酸盐的利用主要是依靠根分泌植酸酶的能力,因此对根分泌的植酸酶能力和田间相关实验进行研究分析,创造高效磷吸收的玉米新种质将是本课题组进一步研究的方向.
本研究将草甘膦抗性基因和植酸酶基因一同转入玉米骨干自交系,赋予了植株抗除草剂草甘膦的特性,同时提高了植株对磷素的吸收利用效率,改善了玉米的生长状态,为培育磷高效吸收且具有草甘膦抗性的优良复合性状玉米品种具有重要的理论指导意义.
