花椒流胶病病原鉴定及其生物学特性
2019-03-22王秀娟何静王斌陈伟李毅刘姣姣
王秀娟,何静,王斌,陈伟,李毅,刘姣姣
(甘肃农业大学林学院,甘肃 兰州 730070)
花椒(ZanthoxylumbungeanumMaxim.)属芸香科花椒属植物,为有刺灌木或小乔木,是我国栽培历史悠久的食用调料、中药材、香料、油料、工业原料等多用途经济树种[1-2].在山东、山西、河北、河南、陕西、甘肃、四川、湖北、湖南、安徽、云南、贵州等省栽培面积较大,产量高[3].甘肃省陇南地区栽培的花椒‘大红袍’以其色泽丹红,粒大饱满,油重,纯麻可口在省内外享有盛誉,是当地群众致富的支柱产业[4].但是,伴随花椒流胶病的发生,使正处于挂椒盛期的大红袍大面积死亡,严重影响了广大椒农的生产积极性,制约了花椒生产的产量和质量,造成严重的经济损失[5-7].
关于此病的研究大多集中于发病规律和防治方面.袁忠林发现导致该病发生的主要因素是水[5].在病原菌研究方面,我国学者经研究发现,半知菌瘤座孢科的镰刀菌类(Fusariumsp.)和橘柑褐腐疫霉(Phytophthoracitrophthora)可以造成花椒流胶病的发生[8-9〗.本试验对造成花椒流胶病的病原菌进行了分离鉴定,通过致病性试验,确定了三线镰孢菌(Fusariumtricinctum)和小穴壳菌属(Dothiorellasp.)是甘肃陇南地区花椒流胶病的主要病原,并从病原生物学特性的角度出发,探究其菌丝生长的最适条件,为科学合理的防治花椒流胶病提供理论基础.
1 材料与方法
1.1 材料
采自甘肃省陇南市武都区花椒流胶病典型病株.
1.2 方法
1.2.1 花椒流胶病病原菌的鉴定
1.2.1.1 病原菌的分离和纯化 病原菌分离采用常规组织分离法[10-12],选取病健交界处组织剪成2~3 mm的小块,0.1%的升汞消毒30 s,用无菌水冲洗3次,接种在PDA培养基上进行分离培养,每皿按品字形接种3块,放于25 ℃人工气候箱中培养.后经菌种纯化,将纯培养物于25 ℃恒温培养,定时观察菌落形态,将待鉴定菌种置于0~4 ℃冷藏保存,备用.
1.2.1.2 致病性测定 采用茎皮刺伤接种法[13],将分离纯化所得的病原菌分别接种到大红袍茎干上.接种前,先将花椒苗木茎干消毒,待表面消毒干净后,用接种刀在茎干的上、中、下刺伤直径约为0.5 cm的接种面,在无菌条件下,分别挑取分离所得的不同病原菌菌丝单独接种在刺伤的接种面上,做好标记.待接种面发病后,从发病处再次分离病原菌进行鉴定,并与接种菌进行形态比较.
1.2.1.3 病原菌的鉴定 形态学鉴定[14-16]:将分离纯化后的菌株接种于PDA培养基上活化,挑取微量菌丝,制作水浸片在光学显微镜下镜检.根据病原菌在PDA培养基的培养性状、菌落特征、菌丝体的形态,分生孢子形态、大小、颜色等相关特征,对病原菌进行形态学鉴定.
分子生物学鉴定:使用抽提试剂盒:TIANamp Yeast DNA Kit或Plant Genomic DNA Kit严格按照说明书进行提取基因组DNA[17].将提取的基因组DNA进行PCR扩增并进行琼脂糖检测.PCR扩增采用通用引物ITS1和ITS4,引物序列为:ITS1(5′-TCCGTAGGTGAACCTGCGG-3′),ITS4(5′-TCCTCCGCTTATTGATATGC-3′).由广州赛哲生物科技股份有限公司进行测序,测序结果与NCBI已知的序列进行同源性比较,将未知菌鉴定到属或种.
1.3 病原生物学特性测定
1.3.1 光照对菌落生长的影响 采用全光照、全黑暗和光暗交替(12 h光照,12 h黑暗交替进行)3种光照处理,在PDA培养基上培养供试病原菌.
1.3.2 pH对菌落生长的影响 设置pH 3,4,5,6,7,8,9,10,11共9组处理,参照李智敏[18]等方法,用浓度均为0.1 mol/L的NaOH和HCl调节PDA培养基的酸碱度.
1.3.3 温度对菌落生长的影响 设置5,10,15,20,25,30,35,40 ℃共8组温度处理,在PDA培养基上培养供试病原菌.
1.3.4 不同培养基对菌落生长的影响 配制 PDA、PSA、玉米粉、燕麦片和牛肉膏蛋白胨共5种培养基[10],分装于三角瓶中,高压灭菌30 min后备用.
1.3.5 病原菌对碳源和氮源的利用 参照陈丹等方法[19],设置蔗糖、麦芽糖、乳糖、葡萄糖、淀粉5种碳源和蛋白胨、硝酸钠、硝酸铵、牛肉膏4种氮源处理.供试基础培养基成分为:KH2PO41.08 g,KCl 0.5 g,MgSO20.5 g,生物素 0.5 mg,VB21.5 mg,FeCl3少许,琼脂20 g,蒸馏水1 000 mL.
碳源试验:基础培养基中加KNO3作氮源,将供试碳源按20 g/L分别加入基础培养基中.
氮源试验:基础培养基中加葡萄糖(20 g/L)作碳源,将供试氮源按0.277 g/L折算配制,加入基础培养基.
以上生物学特性试验采用菌丝生长速率法[20],将供试菌种打成菌饼,每个菌饼取自4~5 d菌龄大小相同(直径8 mm)的菌落,将其按品字型接种在各培养基中.每处理重复3次,除温度处理外,均在25 ℃恒温箱中培养,培养一段时间后,用十字交叉法测量菌落直径.
1.4 数据分析
采用SPSS 13.0以及Excel 2007进行数据分析.
2 结果与分析
2.1 病原菌分离与致病性测定
从自然发病的花椒流胶病病样上共分离出6株
真菌,将分离得到的病原菌依照柯赫氏法则全部回接到正常的大红袍茎干上,其中4株不具致病性,2株导致了流胶病的发生.从发病的接种面上再次分离病原菌,获得了与接种病原菌相同的病原物.根据柯赫氏法则,确定这2株接种菌是导致花椒流胶病的主要致病菌.
2.2 病原菌鉴定
形态学鉴定:待鉴定菌1(图1)在PDA培养基上培养6 d,菌落直径达75 mm,菌丝丛卷毛状,培养基底部为粉红色,生长初期,菌丝白色;之后菌丝中央粉红色,边缘白色;随着生长天数的增加,中央菌丝变成淡黄色;分生孢子无色,镰状至弯曲、纺锤形,经形态学初步鉴定,确定该菌为三线镰孢菌[21](Fusariumtricinctum);待鉴定菌2(图2)在PDA培养基上培养6 d,菌落直径达53 mm,菌丝毛毡状,培养基底部为棕黑色,生长初期,菌丝白色;之后呈现淡黄色,中央咖啡色;随着生长天数的增加,菌丝中间深咖啡色,边缘白色;分生孢子单生或成链状产生,无色,球形或卵圆形,经形态学初步鉴定,确定该菌为小穴壳菌属(Dothiorellasp.).
分子生物学鉴定:使用通用引物ITS1/ITS4对菌株rDNA进行PCR扩增,将得到的PCR产物进行3730XL测序,并与NCBI中已知的序列进行同源性比较,结果显示,所测菌种的ITS与三线镰孢菌(Fusariumtricinctum)和小穴壳菌属(Dothiorellasp.)的序列相似性最高.结合形态学鉴定结果,确定造成花椒流胶病的主要致病菌为三线镰孢菌(Fusariumtricinctum)和小穴壳菌属(Dothiorellasp.).
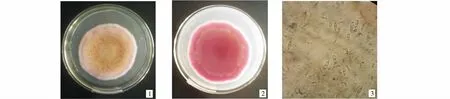
1~2为在PDA平板上正面和反面的菌落形态;3为光学显微镜下分生孢子形态.1~2:The colong morphology on the front and the opposite sides of the PAD plats;3:Conidia morphocogy undur optical microscope.图1 三线镰孢菌生物学形态Figure 1 The morphological characteristics of Fusarium tricinctum
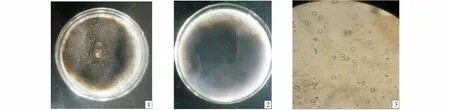
1~2为在PDA平板上正面和反面的菌落形态;3为光学显微镜下分生孢子形态.1~2:The colong morphology on the front and the opposite sides of the PAD plats;3:Conidia morphocogy undur optical microscope.图2 小穴壳菌属生物学形态Figure 2 The morphological characteristics of Dothiorella sp.
2.3 生物学特性
2.3.1 光照对菌落生长的影响 由图3可以看出,三线镰孢菌在黑暗条件下最适宜,在光照和光暗交替下菌丝生长差异不显著;小穴壳菌属在光暗交替条件下最适宜,在光照和黑暗条件下无显著差异.
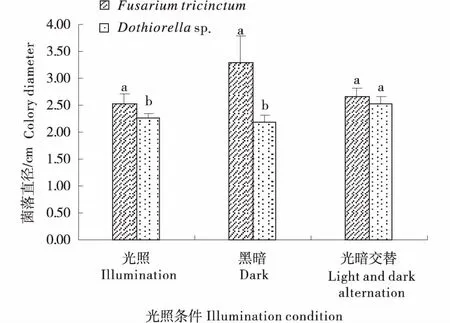
图3 不同光照条件对病原生长的影响Figure 3 The effect of different light conditions on the growth of the pathogens
2.3.2 pH值对菌落生长的影响 由图4可知,三线镰孢菌和小穴壳菌属对酸碱的适应范围较广,在供试pH范围内均可生长.其中,三线镰孢菌的菌丝生长最适pH值为6~8,且碱性条件优于酸性条件,当pH小于6时,生长较慢;小穴壳菌属的菌丝生长最适pH值为7~9,同样地,其在碱性条件下的菌丝生长速率明显高于酸性条件.
2.3.3 温度对菌落生长的影响 三线镰孢菌和小穴壳菌属对温度的适应范围较为一致.二者的菌丝生长适宜范围为 20~30 ℃,25 ℃是其菌丝生长的最适温度,在5 ℃时受到严重抑制,菌丝生长缓慢,当温度达40 ℃时,菌丝生长停滞(图5).
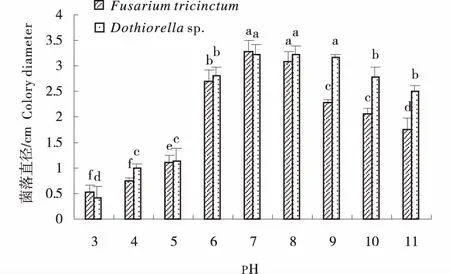
图4 不同pH对病原生长的影响Figure 4 The effect of different pH on the growth of the pathogens
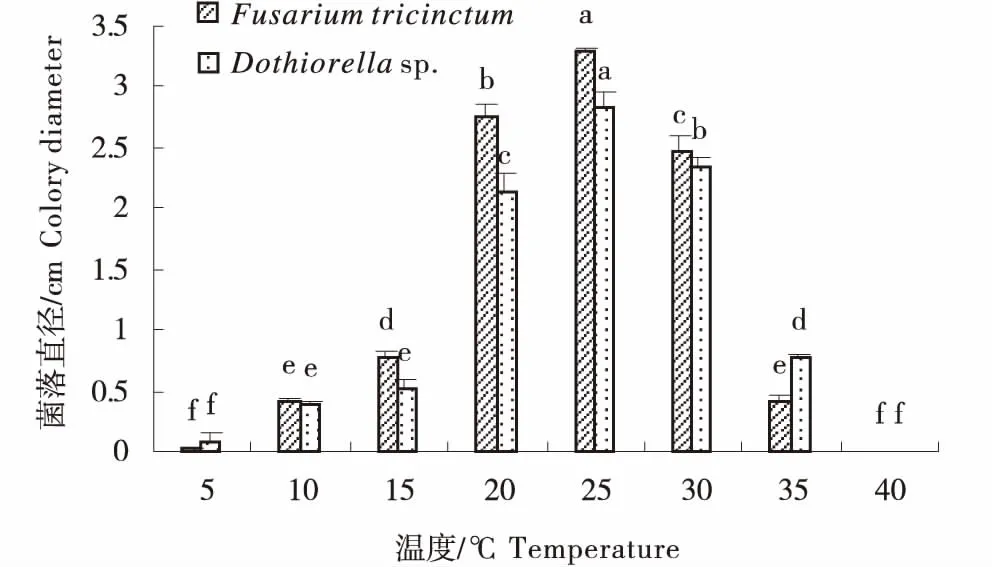
图5 不同温度对病原生长的影响Figure 5 The effect of different temperatures on the growth of the pathogens
2.3.4 不同培养基对菌落生长的影响 试验结果表明,三线镰孢菌和小穴壳菌属在供试5种培养基中均有生长.其中,三线镰孢菌在PDA培养基中生长最快;PDA和PSA培养基均是小穴壳菌属的生长较适宜培养基,但在牛肉膏蛋白胨培养基中小穴壳菌属生长较慢(图6).
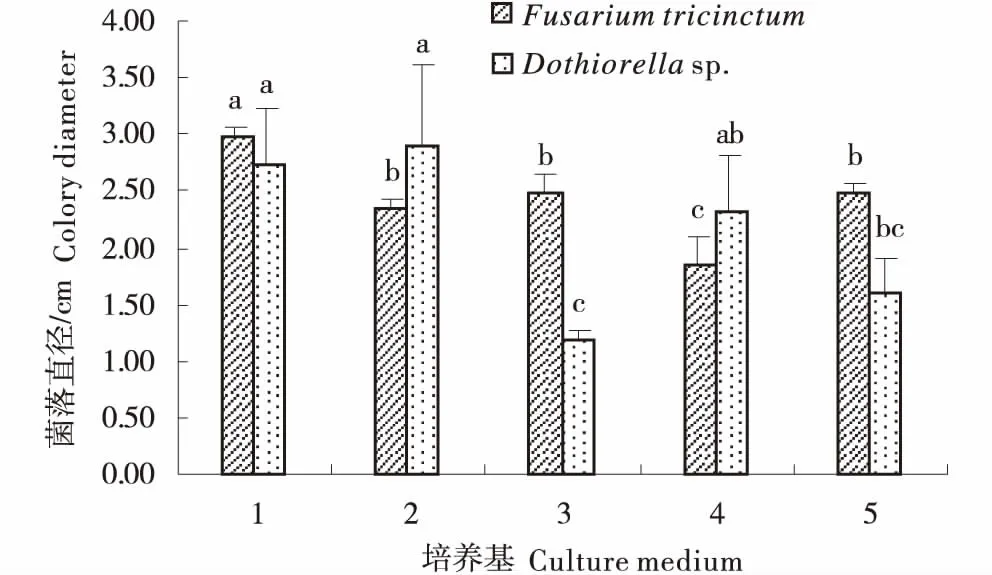
1:马铃薯葡萄糖琼脂培养基;2:马铃薯蔗糖琼脂培养基;3:牛肉膏蛋白胨;4:燕麦片;5:玉米粉.1:PAD mwdium;2:PSA medium;3:Beefpaste peptone medium;4:Oat-meal medium;5:Corn flour medium.图6 不同培养基对病原生长的影响Figure 6 The effect of different medium on the growth of the pathogens
2.3.5 病原菌对碳源和氮源的利用 试验表明,三线镰孢菌和小穴壳菌属在5种供试碳源物质下均可生长,其中,淀粉均是二者的最佳碳源物质,但处理间差异各不相同,五种供试碳源物质对三线镰孢菌的生长差异不显著,而对小穴壳菌属的生长差异较显著,小穴壳菌属在以葡萄糖和麦芽糖为碳源物质的条件下生长最差(图7).在对氮源物质的利用中,三线镰孢菌和小穴壳菌属表现较为一致,均表现出对硝酸钠的利用明显优于其他3种氮源物质,而在硝酸铵的生长条件下生长最差.
3 讨论与结论
本文结合形态学和分子生物学鉴定,明确陇南花椒流胶病的主要病原菌为三线镰孢菌(Fusariumtricinctum)和小穴壳菌属(Dothiorellasp.),就光照、温度、pH、不同培养基、碳源和氮源的利用对花椒流胶病主要病原菌生物特性进行了研究,为有效防治该病害提供了一定的理论依据.试验研究表明,三线镰孢菌在黑暗条件中生长最快,光暗交替次之,全光照下生长最慢,说明光照可抑制三线镰孢菌菌丝的生长;小穴壳菌属在光暗交替下生长最快,其它光照条件下不显著.说明花椒流胶病病菌的发病与光照有一定的关系,因此良好的光照对防治花椒流胶病有一定的效果,在生产实践中,做好椒树的整形修剪对流胶病的防治极为关键.三线镰孢菌和小穴壳菌属的pH生长范围均为3~11,两者皆适合在中性和弱碱性环境下生长,这与边小荣[22]三线镰孢菌最适pH为7的研究结果基本一致,但与高新明[23]小穴壳菌属以酸性生长条件较佳的研究结果相反,这可能与花椒适宜生长在呈弱碱性的土质环境中有关.三线镰孢菌和小穴壳菌属的耐受温度范围均为5~35 ℃,生长的最适温度均为25 ℃.这与傅锦婷[24]对山核桃干腐病病原菌小穴壳菌属的研究结果基本一致,但与陈慧[25]对马铃薯枯萎病病原菌三线镰孢菌的研究结果不一致,这可能与分离菌株的部位不同有关.本研究结果表明,三线镰孢菌和小穴壳菌属在所供试的8种培养基上均能生长,其中三线镰孢菌的最佳培养基为PDA,小穴壳菌属在PSA培养基上最适合生长.三线镰孢菌和小穴壳菌属对营养的需求极其广泛,适应能力极强.对碳源的要求不高,但对氮源的要求有所不同.试验研究中发现,病原可利用单糖形式的葡萄糖和多糖形式的淀粉,但最适宜的碳源为淀粉;可利用蛋白胨中的有机氮和硝酸铵中的无机氮,最适宜的氮源为硝酸钠.分析其原因,可能与三线镰孢菌和小穴壳菌属的寄主、寄主的环境(温度、光照、pH值等)因素不同有关,同时,花椒流胶病的发生往往伴随着高温多雨的天气.结果表明花椒流胶病病原菌具有碳氮源营养来源广泛、适宜偏碱环境生长、耐高温的特性.本研究明确了花椒流胶病病原菌的生物学特性,可为后期流胶病的田间监测、发病规律和综合防治提供科学依据.
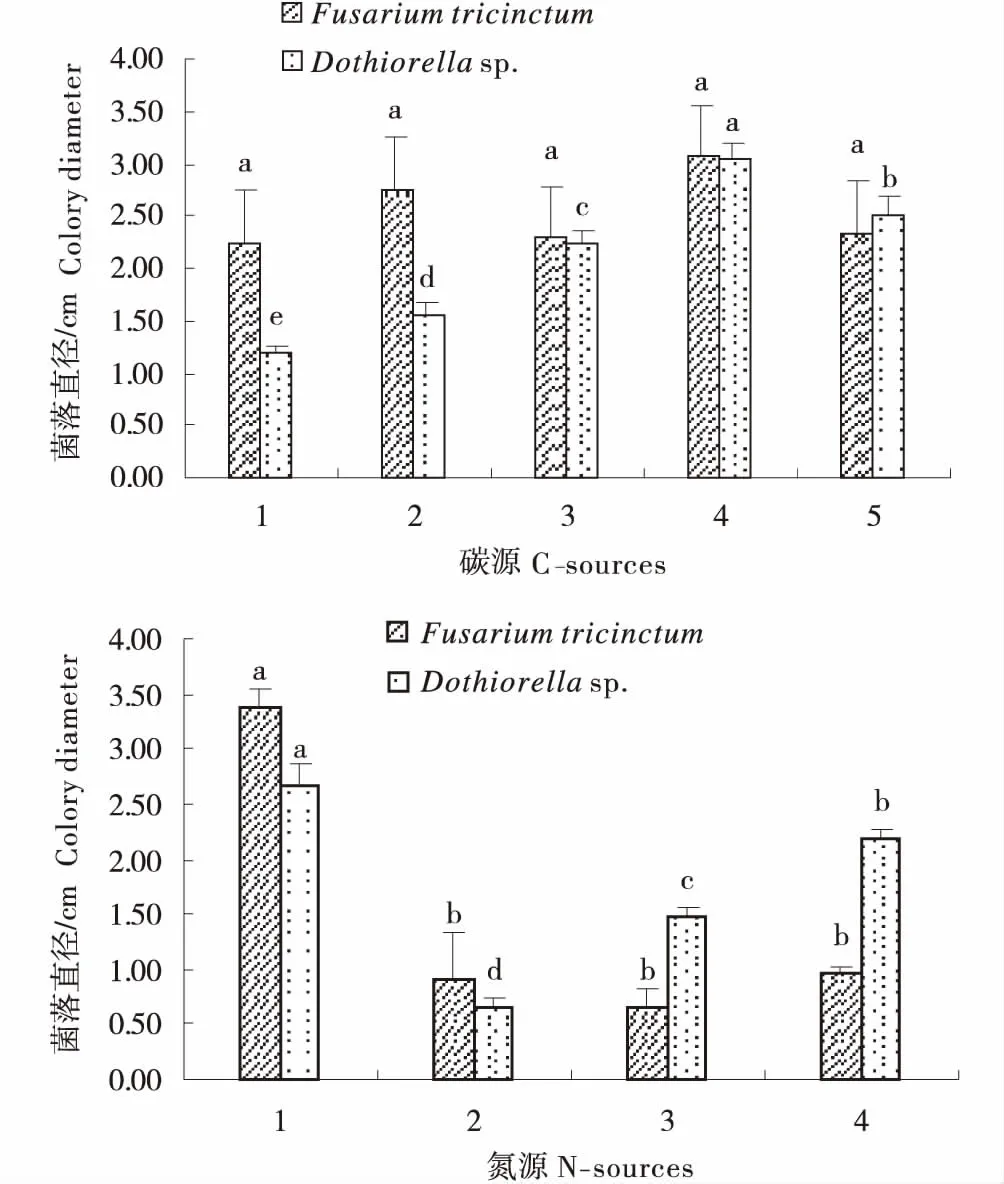
碳源:1:葡萄糖;2:麦芽糖;3:乳糖;4:淀粉;5:蔗糖.氮源:1:硝酸钠;2:硝酸铵;3:牛肉膏;4:蛋白胨.C-sources:1:Glucose;2:Maltose;3:Lactose;4:Starch;5:Sucrose;N-sources:1:Sodium nitrate;2:Ammonium nitrate;3:Beef paste;4:Peptone.图7 不同碳源和氮源对病原生物的影响Figure 7 Effects of different C-sources and N-sources on the growth of pathogens
