红鳍东方鲀(Takifugu rubripes)Vtg基因实时荧光定量PCR分析的引物设计与评估
2019-03-22仇雪梅王秀利
藏 林,封 岩,门 磊,仇雪梅,王秀利
(1.大连海洋大学 水产与生命学院,辽宁 大连 116023;2.大连民族大学 生命科学学院,辽宁 大连 116600)
红鳍东方鲀(Takifugurubripes)隶属于鲀形目(Telraodontiformes)、鲀科(Tetradontidae)、东方鲀属(Takifugu)。它是几种重要的海水养殖经济鱼类之一,由于其肉质细腻、肉味鲜美,鱼肉中有含量极高的蛋白质,鱼皮含有丰富的胶原蛋白,已在中国、韩国及日本等亚洲国家广泛培育[1]。
野生河豚常含有致命的毒性河豚毒素(TTX),尤其是在雌鱼的卵巢中[2]。河豚毒素是一种极为有效的神经毒素,它特异性地与肌肉和神经组织中的电压门控钠通道结合,并阻断钠离子通道进入神经元[3-5]。野生河豚通常通过食物链对毒素进行生物累积,在特定组织(如肝脏、卵巢和皮肤)中产生大量的河豚毒素[6]。当喂食含河豚毒素的食物时,无毒人工培养的河豚鱼的肝脏、卵巢和皮肤中都高水平积累了河豚毒素[7-8]。这种河豚毒素最有可能通过饮食口服,然后从肠道吸收,通过血液循环分配,并运输到肝脏[9-10]。在雌性河豚鱼的肝脏中有一部分河豚毒素在成熟期被转运到了卵巢中。有研究表明人工经静脉注入河豚毒素时,河豚毒素在肝脏中的含量明显随着河豚毒素注射量的增加而增加,这表明河豚毒素存储在肝脏中是毒化红鳍东方鲀的第一个步骤[11]。
卵黄蛋白原( Vitellogenin,Vtg)是卵黄蛋白(Yolk protein)的前体,存在于几乎所有卵生物种的雌性中,包括鱼类、两栖动物、爬行动物、鸟类,以及大多数无脊椎动物。Vtg主要是在肝脏中的雌激素17β-雌二醇的刺激下产生,通过体循环分布全身,并随血液循环系统进入到卵巢。在进入卵巢的过程中,特异性受体锚定在卵母细胞质膜并与卵黄蛋白原结合,并成为与他们的卵黄蛋白原内化的配体。 Ikeda在日本长崎县使用处于成熟期的野生河豚鱼,在测得促性腺激素指数(GSI)增加的情况下,卵巢中的毒性也随之增加,而同时肝脏毒性显著下降[12]。卵黄蛋白原储存在早期卵母细胞体内,然后裂解成脂质细胞(I和II),卵黄蛋白和vWF D型结构域[13-14]。卵黄蛋白原除了有卵黄蛋白的前体的作用外,卵黄生成素还可作为金属、无机磷酸盐、脂质和碳水化合物的载体蛋白[15-16]。
实时定量PCR(real-time fluorescence-quantitative PCR,qPCR)是一种具有高灵敏度、可重复性的基因表达谱分析技术。作为最灵敏、精确、可重复的定量特异RNA的技术之一,它现在被广泛应用于各个领域,并成为验证微阵列和RNA-seq数据的最常用方法[17-19]。
本文应用实时定量PCR的方法,拟获得红鳍东方鲀Vtg基因基于qPCR表达分析的相关引物,为今后分析红鳍东方鲀的 Vtg基因的表达谱、深入探讨河豚毒素在肝脏和卵巢中富集与分布奠定基础。
1 材料与方法
1.1 材料
实验用18月龄的红鳍东方鲀50尾,采自大连天正实业有限公司。麻醉后,采集新鲜的红鳍东方鲀肝脏和尾鳍组织,立即储存在液氮中,然后在-80 ℃的超低温冰箱中储存备用。
1.2 实验方法
1.2.1 性别鉴定 将上述50尾红鳍东方鲀解剖,根据性腺发育的程度、形状和颜色进行性别鉴定,具体鉴别方法按照参考文献20、21的方法进行。
1.2.2 总RNA的提取 随机取15尾雌性红鳍东方鲀等量大小的肝脏组织样品,置于有液氮的研钵中进行研磨,直至呈粉末状,混合后用于总RNA的提取。按照RNAiso plus(Takara Biotechnology (Dalian) Co.,Ltd.)的说明书进行总RNA提取,具体步骤如下:取研磨后的粉末状混合物50~100 mg于离心管中,加入1 mL的 RNAiso plus,室温静置10 min,12 000 r/ min,4 ℃离心15 min,取上清移至1.5 mL离心管中;加入200 μL氯仿,剧烈震荡混匀至呈乳白色,室温静置10 min,12 000 r/ min,4 ℃离心15 min,取约400 μL上清转移至新离心管中;加入等体积约400 μL异丙醇,缓慢颠倒混匀10次,于-20 ℃条件中静置20 min,12 000 r/min,4 ℃离心15 min,弃去上清留沉淀部分;加入1 mL的75%现配乙醇,于12 000 r/min,4 ℃离心5 min,弃乙醇保留沉淀,重复两次;得到的沉淀物在无酶环境下进行沉淀干燥2~5 min后,溶于 DEPC水中,暂存于4 ℃冰箱中使其充分溶解后,保存于-80 ℃超低温冰箱留用。用超微量分光光度计Aligent2000对溶解完全后的RNA进行波长长度为260 mm和280 mm的浓度及纯度分析;随后对其进行1%的普通琼脂糖凝胶、恒压电泳分离系统进行电泳,通过凝胶成像系统初步测定提取的总RNA完整性进行观察与拍照。
1.2.3 cDNA第一条链的合成 选取 OD260/OD280在1.8~2.0之间的 RNA作为反转录的模板,根据逆转录试剂盒(Takara Biotechnology (Dalian) Co.,Ltd.)的说明书进行逆转录反应。具体反应体系如下: 2 μL 5×PrimeScript Buffer、0.5 μL PrimeScript RT Enzyme Mix I、0.5 μL Oligo dT primer、0.5 μL Random6 mers、3 μL模板和3.5 μL RNase free H2O。 反应条件: 37 ℃ 15 min,85 ℃ 5 s,4 ℃保存。
1.2.4 引物设计及常规PCR的筛选 下载红鳍东方鲀卵黄蛋白原Vtg-1的基因序列(GenBank号:XM_011614929.1),利用Primer5.0设计引物,引物由生工生物工程(上海)股份有限公司合成。
取雌性红鳍东方鲀肝脏的cDNA 进行常规PCR扩增Vtg-1基因片段。扩增总体积为25 μ L,其中上下游引物各0.5 μL,dNTP 2 μL,10×Buffer 2.5 μL,Taq酶0.4 μL, ddH2O 18.1 μL,cDNA模板1 μL。扩增条件为:94 ℃,5 min预变性;94 ℃,30 s变性; 8 ℃,30 s退火; 72 ℃,30 s延伸,35个总循环。PCR产物经1%的普通琼脂糖凝胶和恒压电泳分离系统上进行电泳,通过凝胶成像系统初步测定提取的总RNA完整性进行观察与拍照。对得到的Vtg-1基因的单个扩增产物进行测序,并通过NCBI BLAST程序在线比较和验证测序结果。
1.2.5 qPCR引物的设计与评估 根据测序后获得的Vtg-1基因序列获得的qPCR扩增的引物设计原理,使用Primer5.0设计引物,并在常规PCR检测后进行qPCR扩增。
标准曲线的制备:以逆转录后的cDNA原液为模板,采用5点10倍稀释法进行实时定量PCR实验。 实验在ABI Step One Plus实时定量PCR仪上利用全式金TransStart®TopGreen qPCR SuperMix 的试剂盒进行qPCR反应。反应体系为 20 μL:其中包括 MIX Buffer 10 μL,Dye 0.4 μL,RNAse Free ddH2O 7.4 μL,正反向引物浓度为10 μm/ L各0.6 μL和模板1 μL,每个样品3次重复,反应条件为:94 ℃,30 s;94 ℃,5 s;58 ℃,15 s;72 ℃,25 s;40个循环。 观察熔解曲线及标准曲线,确定Ct值。扩增体系条件与标准曲线的制备条件相同,取上述 cDNA 为模板,进行qPCR定量实验。
2 结果与分析
2.1 总RNA的提取及检测
红鳍东方鲀肝组织的总RNA显示28 s rRNA和18 s rRNA的条带亮度比在1和2之间(图1), OD260/OD280均在1.8~2.0之间。
2.2 常规PCR引物设计、筛选及验证
根据红鳍东方鲀卵黄蛋白原 Vtg-1的基因序列( XM_011614929.1),利用软件 Primer5.0设计引物,筛选出了两对适宜进行PCR扩增的引物(表1)。

图1 红鳍东方鲀肝脏组织的总RNA电泳图

引物名称引物序列(5’-3’)扩增产物大小(理论值)/bpTm/℃扩增产物名称Vtg-1F1TTGGCAGCTCTGGAGTTCCT31859.7VtgF1-VtgR1Vtg-1R1GGGCATCGGGTATTTCGTTC61.7Vtg-1F2 ATGGACAAACCCACGAACAG23457.9VtgF2-VtgR2Vtg-1R2AAGGGCATCGGGTATTTCGT61.0

图2 常规PCR扩增产物的电泳结果注:泳道M:DNA分子标量;泳道1~2:由引物对VtgF1-VtgR1扩增的Vtg基因的PCR产物;泳道3~4:由引物对VtgF2-VtgR2扩增的Vtg基因的PCR产物
将红鳍东方鲀肝脏组织的cDNA用作模板,对表1中所示的两对引物进行常规PCR扩增筛选。如图2所示,引物VtgF1-VtgR1的扩增产物仅具有约320 bp的一条扩增条带(泳道1、2);引物 VtgF2- VtgR2的扩增产物在240 bp处有清晰的一个扩增条,但在小于100 pb处有较为明显引物带,根据引物设计原则,判断为引物二聚体,不适合表达分析(泳道3、4)。
对上述扩增后所得到的产物Vtg-1进行测序,得到长度为316 bp的序列。将获得的序列进行GenBank BLAST在线比对,结果显示:与已报报道的红鳍东方鲀Vtg-1基因(序列号: XM_011614929.1)相比,本研究测序所得的由引物对VtgF1-VtgR1扩增的PCR产物序列的与Vtg-1基因的源性可达99%(图3)。

图3 由引物对VtgF1-VtgR1扩增的PCR产物序列与Vtg-1基因序列的BLAST对比结果
2.3 qPCR引物的设计与评估
2.3.1 qPCR引物的设计 在常规PCR扩增引物的筛选中,由引物对VtgF1-VtgR1的扩增产物仅具有一个扩增条带,没有非特异性扩增。但在测序后,扩增条带大小为316 bp。该对引物不太适用于 qPCR扩增实验。 根据得到的由引物对VtgF1-VtgR1扩增的PCR产物序列再设计一对较适于qPCR扩增反应的引物:VtgF-VtgR,扩增片段大小约133 bp(表2)。

表2 拟用于qPCR扩增的引物序列信息
2.3.2 引物的qPCR评估 根据qPCR扩增反应的引物对VtgF-VtgR的Tm值,进行退火温度为55 ℃、58 ℃和60 ℃这3个温度下的qPCR扩增。结果显示qPCR扩增的Ct值在58 ℃的退火温度下最小(表3)。 因此在退火温度为58 ℃时,进行引物VtgF-VtgR的qPCR扩增最为适宜。
采用引物对VtgF-VtgR在58 ℃作为退火温度,应用10倍稀释法进行cDNA模板样品的实时定量PCR扩增。根据结果显示:在指数扩增区域中彼此相邻的扩增曲线均匀隔开(图4-A),并且每个反应的熔解曲线在Tm处为82.72是单个尖峰(图4-B),并且该引物标准曲线的扩增效率为105.32%,标准曲线的相关系数R2值为0.999(图4-C)。

表3 引物VtgF-VtgR在不同退火温度下进行qPCR扩增时得到的Ct值
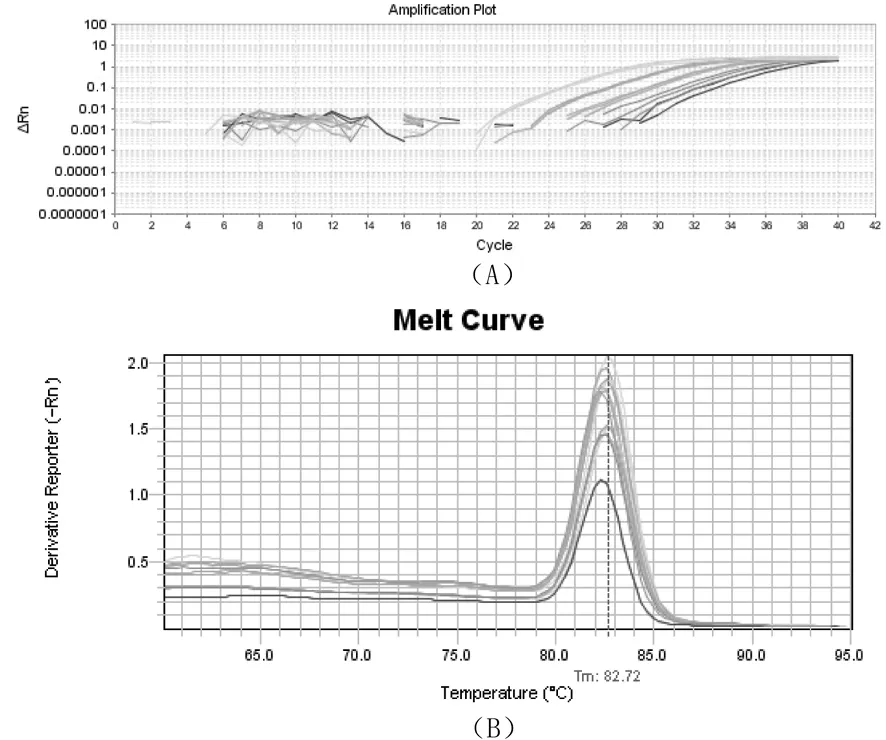

图4 引物对VtgF-VtgR qPCR的扩增曲线
3 讨论
当使用实时定量qPCR通过基因表达谱分析技术对靶基因表达时,提取的总RNA的完整性和纯度是影响扩增效率的最基本因素。如果提取的总RNA质量差或被污染,则产生的数据会有偏差,导致结果不准确。当提取的RNA样本通过琼脂糖电泳分析时,电泳图上有明显的两条带28 s和18 s带,并且28 s/18 s rRNA的带亮度比在1和2之间,表明其具有良好的完整性。通过测定,本研究得到的总RNA的OD260/OD280比值在1.8和2.0之间,表示RNA样品纯度高,不含蛋白质和其他杂质,满足实时定量PCR对总RNA的要求。
所设计引物的序列对PCR扩增反应的特异性以及扩增效率至关重要。普通 PCR扩增的引物一般长度在15~30个碱基之间最好,GC含量为50%~60%。此外,上游和下游引物的GC含量不应太大,Tm为55~65 ℃之间,引物自身和引物间不应存在互补序列,从而避免产生发夹结构和引物二聚体。对于qPCR扩增,扩增片段的长度优选为80~250 bp,最合适的长度约在150 bp左右。 本研究基于已公布的红鳍东方鲀卵黄蛋白原Vtg-1的基因序列信息(GenBank号: XM_011614929.1),设计出两对引物,即:VtgF1-VtgR1和VtgF2-VtgR2,所得到扩增出的序列大小分别为320 bp和240 bp。在常规PCR中,引物对VtgF1-VtgR1的扩增片段大小约为320 bp,这与理论值一致,并且扩增产物没有杂质带。与第一对引物相比,引物对VtgF2-VtgR2的扩增产物除了主带之外还具有一条引物带。第一对引物具有很强的扩增特异性,但其扩增片段的大小不符合qPCR扩增的最佳要求。因此,本研究对引物对VtgF1-VtgR1扩增出的产物序列进行重新设计得到适用于实时定量PCR的引物:VtgF-VtgR,扩增片段大小约为133 bp,与理论值大小相一致,因此可以通过实时定量PCR对引物对VtgF-VtgR进行进一步评估。
在进行实时定量PCR的过程中,设置了阴性对照,且阴性对照无扩增信号;对于每个扩增样品浓度设定三个生物学重复,并且这些重复样品的Ct值的标准偏差应小于0.5,否则结果将是不可靠的并且需要重新扩增。在该实验中,阴性对照显示没有扩增信号,并且扩增样品值的标准偏差小于0.5,这证明了测试数据的可靠性。
退火温度的高低直接影响 PCR结果的好坏,不适宜的退火温度会导致引物非特异性的扩增或者会形成引物二聚体,因此在实验中,要对退火温度进行优化[22]。引物扩增的特异性在进行实时定量PCR实验中起关键性作用,在进行退火温度优化的同时要进行熔解曲线的分析,以此判断引物扩增的特异性[23]。如果获得的熔解曲线是单峰,则表明引物扩增具有特异性;相反,如果在熔解曲线上不仅存在一个波峰,则表明该引物有非特异性的扩增。依据本实验引物的 Tm值的结果显示,当退火温度为58 ℃时,该引物扩增的 Ct值最小,有且只有一个波峰。因此,58 ℃的退火温度是本实验较适合于qPCR分析的。
除扩增特异性外,引物应具有良好的扩增效率,以便最终用于实验样本的实时定量PCR的分析。扩增效率一般可通过对按照十倍比稀释的c DNA模板进行定量分析建立的标准曲线来确定。优化后的结果有以下特点:1、标准曲线的决定系数R2>0.980;2、高扩增效率,即扩增效率在90%~105%;3、具有一致的重复反应。递减的直线关系等式和标准曲线的决定系数R2常常被用来判断反应条件是否优化。扩增效率接近100%是优化的重复性好的实验的最好标志,在实际操作时,反应扩增效率应在90%~105%之间[24],如果扩增效率低,可能的原因是引物设计的不当,或者是反应条件未优化;扩增效率过高,可能的原因是系列稀释样品加样错误,或者有非特异性扩增,如引物二聚体[25]。此次实验引物 VtgF-VtgR的标准曲线分析显示:引物的扩增效率为105.32%,R2值为 0.999;定量结果表明,当进行扩增时,熔解曲线是单峰值。上述结果说明,该对引物具有良好的扩增特异性和扩增效率,满足了实时定量PCR扩增的要求。
通过引物对 VtgF-VtgR的退火温度优化和标准曲线的建立,结果表明,该对引物适用于红鳍东方鲀 Vtg基因的实时定量PCR分析。本研究结果为红鳍东方鲀Vtg基因的组织表达谱分析及不同发育阶段的定量表达分析奠定了基础。
