不同光照周期对鸡睾酮合成的影响
2019-03-19苑志宇董杨云逸吕文发
苑志宇,董杨云逸,李 锰,吕文发,王 军
(吉林农业大学动物科学技术学院,吉林省反刍动物繁育生物技术与健康养殖工程实验室,吉林长春130118)
光照是重要的生态因子,它不仅为生物提供生存所必需的能量,还以波长、光照强度和光照周期等属性影响生物生长、发育和繁殖等生命活动[1]。光照可对禽类性成熟和后续繁殖性能进行调控。1921年Rowman首次通过试验证实了光周期对禽类繁殖的影响,此后国内外学者开展了大量研究关于光照对禽类(家鸡、鸽子、鹌鹑等)繁殖的影响,但研究多集中于光照对母禽生产和繁殖的影响[2]。随着禽类人工授精技术的发展,光照对公禽繁殖性能影响的研究日益增多[3]。研究光照对公禽繁殖性能的作用规律、公禽繁殖系统对光信号的生物应答机制,以及在相关研究成果基础上制定合理的光照制度,均为现代禽类养殖业的高效生产奠定了基础[4]。本试验旨在探究不同光照周期对肉种鸡睾酮合成的影响,以期为公禽光照调控技术的改进提供参考。
1 材料与方法
1.1 试验设计 将120只20周龄父母代AA种公鸡随机分配到3个隔间,每个隔间分为10个鸡笼,每笼4只鸡,3个隔间分别采用不同光照周期(SD、CTR 、LD组分别为8L:16D、12.5L:11.5D、16L:8D),饲喂全价日粮,自由采食和饮水饲喂4周,每笼随机选取1只鸡进行采样,每组共10个重复,翅下采集血液,颈动脉放血致死,每只鸡左侧睾丸用于组织切片,右侧睾丸置于-80 冰箱保存用于分子试验。
1.2 睾丸组织切片HE染色 采集不同光照组鸡睾丸,置于4%多聚甲醛中固定48 h后,将组织样修饰到大小约为0.5 cm×0.5 cm×0.3 cm的立体组织块。放置于包埋盒中,流水冲洗12 h。经酒精梯度脱水后浸入二甲苯中透明15 min 2次,浸入软蜡中30 min 2次,浸入硬蜡中30 min 2次。利用包埋机对组织进行包埋,修成凸起的组织样本进行切片,制成5 μm的组织切片后进行HE染色。普通光学显微镜下观察睾丸组织切片,评价曲细精管横截面积及精子发生情况。
1.3 睾酮含量测定 采集翅下静脉血液,3 000 r/min 离心15 min,析出血清,用ELISA睾酮检测试剂盒(上海江莱生物科技有限公司)分别测定3个光照组鸡血液中睾酮含量。
1.4 RNA提取及反转录 将睾丸组织样品于液氮中磨取,后加入1 mL Trizol中进行裂解,按照RNA提取方法进行试验,并测定RNA样品OD值,有效值在1.9~2.0的样本进行下一步试验。统一RNA浓度后,进行反转录试验,按照反转录试剂盒(TaKaRa)说明书步骤进行cDNA合成。

表1 荧光定量PCR引物信息
1.5 实时荧光定量PCR 利用Oligo7软件设计鸡StAR、Cyp11a1及3β-HSD基因荧光定量PCR引物(表1),β-actin引物购自上海生工生物工程股份有限公司。试验采用 20 μL 体系:SYBR 10 μL,cDNA 2 μL,水 6 μL,上、下游引物(10 μmol/L)各 0.5 μL,ROX 1 μL。所有反应设置3个副孔,重复3次,试验结果采用相对定量法进行分析。
1.6 Western blot 使用RIPA缓冲液提取总蛋白质。通过BCA蛋白质测定试剂盒(Beyotime)测定蛋白质浓度。将每个样品的蛋白质(20 μg)点样到12% SDS-PAGE凝胶电泳中,通过电泳分离并转移到硝酸纤维素膜(NC膜)上。用5%脱脂牛奶封闭2 h后,一级抗体(表2)4 孵育过夜。TBST 3次重复洗涤步骤后,将膜与二抗(表3)在室温下孵育1 h。用ECL发光液显影,用Tanon Gis 软件进行灰度值分析。
1.7 统计分析 用SPSS 17.5 软件进行单因素方差分析比较组间差异性,用LSD法进行多重比较,结果以平均值±标准差表示,用GraphPad Prism 5 作图软件制图,不同大写字母表示差异极显著(P<0.01)。
2 结果与分析
2.1 不同光照周期对鸡睾丸形态功能的影响 通过镜下观察不同光照周期睾丸切片,结果显示(图1和图2),随着光照周期延长曲细精管横截面积极显著增大(P<0.01),SD组曲细精管内出现各级生精细胞,但未见有精子,而CTR与LD组曲细精管内出现大量精子。
2.2 不同光照周期对公鸡血液中睾酮含量的影响 如图3所示,随着光照时间延长睾酮含量极显著升高(P<0.01),与SD组相比, CTR组和LD组睾酮含量均极显著升高(P<0.01)。
表2 Western blot一抗、二抗信息

图1 不同光照组鸡睾丸组织切片图

图2 不同光照组鸡曲细精管横截面积对比
2.3 不同光照周期对鸡睾丸睾酮合成关键酶mRNA表达量的影响 qRT-PCR检测结果显示(图4),鸡睾丸组织中StAR、Cyp11a1和3β-HSDmRNA表达量随光照周期增加极显著升高(P<0.01)。与SD组相比, CTR和LD组睾酮合成关键酶mRNA表达量均极显著升高(P<0.01)。

图3 不同光照对公鸡血清中睾酮含量的影响
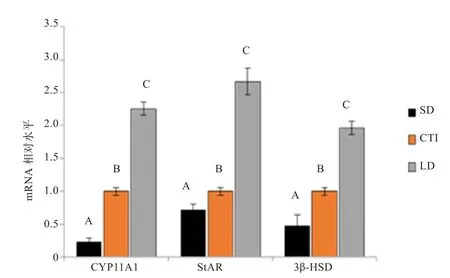
图4 不同光照组鸡睾丸StAR、Cyp11a1及3β-HSD mRNA表达
2.4 不同光照周期对鸡睾丸睾酮合成关键酶蛋白表达量的影响 如图5所示,鸡睾丸组织中StAR、Cyp11a1和3β-HSD 蛋白表达量随光照周期增加极显著升高(P<0.01)。与SD组相比,CTR组和LD组睾酮合成关键酶蛋白表达量依次显著升高(P<0.01)。
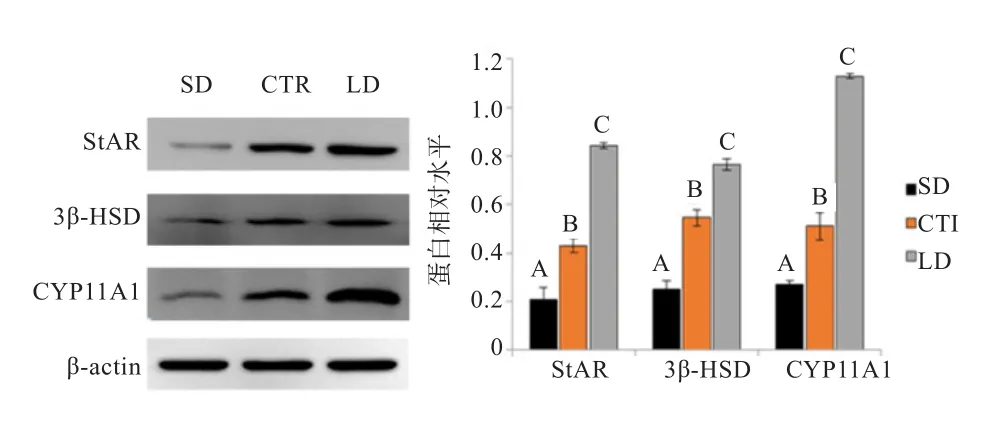
图5 不同光照组鸡睾丸StAR、Cyp11a1及3β-HSD蛋白表达
3 讨 论
光照周期作为繁殖性能主要影响因素之一,其作用在于改变下丘脑-垂体-性腺轴活动。生精能力是评价雄性动物性腺发育的重要指标,睾丸体积和曲细精管横截面积均影响生精能力。张振汉等[5]研究表明,对照组小鼠睾丸的重量、曲细精管管径大小及管壁厚度均大于光照缺乏组,睾丸内相同发育阶段的生精细胞数量也明显高于光照缺乏组,光照缺乏对性腺发育影响极大。本试验发现,随着光照周期延长曲细精管横截面积显著增大,SD组曲细精管内出现各级生精细胞,但未见有精子,而CTR与LD组曲细精管内出现大量精子。李琴等[6]也发现延长光照周期能增强公鸡性腺发育。
睾酮分泌水平是评价雄性动物性腺发育的重要指标,95%的睾酮在睾丸中分泌[7]。金宝栋[8]测定了不同光照周期对东北籽鹅睾酮等生殖激素水平的影响,发现长光照(15L:9D)饲养后睾酮分泌量显著升高,籽鹅生殖激素水平变化受光照时间影响,不同光照周期呈不同的变化规律。本试验中,给予不同光照处理后,公鸡血清中睾酮含量随光照时长呈梯度上升趋势。AA公鸡在20~24周龄为性成熟发育高峰期[9],受光照周期影响更大,本试验中长光照组肉髯鸡冠等第二性征整体较其他2组发育更好,解剖时睾丸体积更大。
实验室前期结果表明,在不同光照周期饲养条件下,鸡睾丸中褪黑素合成酶和褪黑素受体表达量随光照周期延长而显著下调,且有规律地延长光照时间能降低松果腺分泌的褪黑素含量[11]。据报道,持续光照使幼年小鼠生殖激素水平提高,延长光照抑制松果体细胞增殖和褪黑素的分泌,可促进下丘脑—垂体—睾丸轴的调控,使睾酮分泌量增加,导致性发育提前[12]。
睾丸间质细胞是主要的睾酮分泌细胞。有研究表明,褪黑素通过下调睾酮合成关键调节因子Mel1a、GATA-4、StAR和3β-HSD抑制小鼠睾丸间质细胞睾酮分泌[13]。本试验通过荧光定量PCR和Western blot进一步验证,睾酮分泌3个关键酶(StAR、Cyp11a1、3β-HSD)随光照周期延长呈梯度上升趋势,LD组表达量最高。光照对公鸡睾酮分泌的刺激作用主要影响睾丸间质细胞的新陈代谢实现。随着家禽繁育技术的发展,现阶段提高种公鸡繁殖率势在必行[14]。光照条件对家禽繁育至关重要,延长光照周期有利于提高公鸡繁殖性能,具体机制仍需进一步通过细胞生物学试验验证。
4 结 论
本研究发现,延长光照周期能有效提高公鸡睾酮合成水平,其作用可能通过上调睾酮合成关键酶(StAR、Cyp11a1、3β-HSD)表达而实现,且延长光照周期有利于提高睾丸生精能力。
