造血干细胞移植术后急性肾损伤的研究进展
2019-03-16甘钊萍凌国兴赖永榕
甘钊萍,凌国兴,林 雨,赖永榕
(广西医科大学第一附属医院血液内科,南宁 530021)
急性肾损伤(acute kidney injury,AKI)是造血干细胞移植(hematopoietic stem cell transplantation,HSCT)术后常见的并发症之一,HSCT术后急性肾功能损害的发生率为20%~73%,其发生中位时间为31 d,约4.8%的患者需要肾脏替代治疗(renal replacement therapy,RRT)[1-3]。研究发现,HSCT术后 5年内发生慢性肾脏病的比例高达4.5%,其中7%进展为肾衰竭终末期,需要RRT[4]。随着肾衰竭严重程度的增加,AKI患者病死率亦升高,占需要RRT患者的80%以上[5]。AKI的病因和危险因素复杂,不仅受移植患者基础疾病(如慢性肾脏病、糖尿病、高血压等)的影响,还与移植前后使用的药物、放射线以及移植相关并发症[如骨髓输注毒性、移植物抗宿主病(graft versus host disease,GVHD)、肝窦梗阻综合征(hepatic sinus obstruction syndrome,SOS)、血栓性微血管病、脓毒症、骨髓输注毒性等]相关[6]。对HSCT术后AKI的管理强调积极预防、早期识别并干预治疗,从而改善预后。同时,深入了解AKI的诊断标准、危险因素、发病机制和早期生物学标志物,对AKI的预防和管理具有重要意义。现就HSCT术后AKI的研究进展予以综述。
1 AKI的定义和诊断标准
目前,对HSCT术后AKI的定义尚无统一标准。应用较多的诊断标准主要是急性透析质量倡议工作组提出的RIFLE(R:risk,肾功能不全的危险;I:injury,肾脏损伤;F:failure,肾衰竭;L:loss,肾功能丧失;E:end stage kidney disease,终末期肾脏病)诊断标准和急性肾损伤网络工作小组(Acute Kidney Injury Network,AKIN)提出的AKIN诊断标准,见表1[7-9]。以上标准的确立为AKI提供了明确统一的识别诊断标准,有利于对AKI相关流行病学临床和试验的调查研究,同时对识别和诊断AKI具有更高的敏感性和特异性。Ando等[10]研究发现,HSCT术后AKI患者,特别是严重程度级别较低的AKI患者,AKIN诊断标准的敏感性低于RIFLE诊断标准。改善全球肾脏疾病预后组织提出,结合RIFLE和AKIN诊断标准的优点,用于AKI临床实践、研究和公共卫生的肾脏疾病预后组织诊断标准,见表1[7-9]。一项纳入2 034例重症监护病房患者的回顾性分析研究发现,按RIFLE、AKIN和肾脏疾病预后组织诊断标准,AKI的发生率分别为69.7%、72.2%和74.2%[11]。
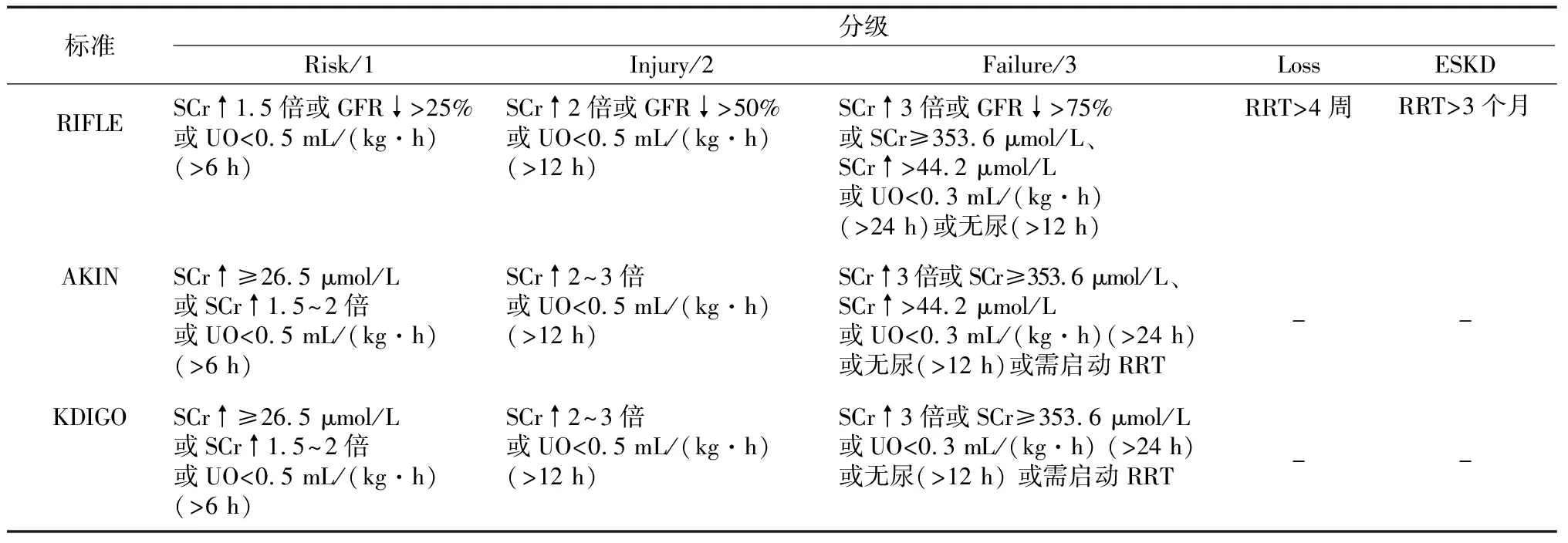
表1 RIFLE、AKIN与KDIGO诊断标准
RIFLE:R(肾功能不全的危险),I(肾脏损伤),F(肾衰竭),L(肾功能丧失),E(终末期肾脏病);AKIN:急性肾损伤网络工作小组;KDIGO:全球肾脏病预后组织;SCr:血清肌酐;GFR:肾小球滤过率;UO:尿排出量;RRT:肾脏替代治疗;Loss:肾功能丧失;ESKD:终末期肾脏病;↑:升高;↓:降低;-:无数据
2 AKI的发病机制
HSCT术后AKI的发病机制复杂,受多种因素影响。肾前性氮质血症是HSCT患者发生AKI的常见病因,常见的化疗不良反应包括恶心、呕吐、腹泻和黏膜炎等,常引起液体经胃肠道丢失过多或经口摄入不足导致循环血容量减少,最终导致肾前性肾损伤[12-13]。此外,急性肾小管坏死也是HSCT术后AKI的常见病因,低血容量性休克、脓毒性休克或肾毒性药物[如抗菌药物(两性霉素B、万古霉素、甲氨蝶呤)和用于防治GVHD的药物(如阿糖胞苷、氟达拉滨)等]可引起急性肾小管坏死致肾性AKI,可单独或与肾前性病因协同作用导致AKI的发生[12-14]。泌尿系梗阻也可能是HSCT患者AKI的病因,静脉输注阿昔洛韦等抗病毒药物可在尿液中沉淀,并在肾小管中形成晶体造成梗阻,出血性膀胱炎形成的血凝块也可导致泌尿系梗阻,造成梗阻性肾后性AKI[15]。研究发现,AKI肾脏病理表现多样,其中常见的异常病理表现为肾小球病变(如血栓性微血管病变、膜性肾病、微小病变以及局灶节段性肾小球硬化等),此外,亦可见到急性肾小管损伤、间质纤维化、动脉硬化,甚至白血病和淀粉样蛋白(复发性)、糖尿病肾病、细菌感染、真菌侵袭以及沿肾小球和肾小管基膜分布的沉积物等改变[16]。肝脏SOS引起AKI是肝脏损伤引起肝内小静脉闭塞、肝静脉窦血栓形成而导致肝静脉窦充血、坏死和纤维化致门静脉高压,从而降低肾脏血流灌注引起肾前性AKI。研究表明,肝脏SOS是所有阶段AKI以及需要RRT的AKI患者的独立预测因子,超过90%的SOS患者出现不同程度的AKI,其中54%的患者发生严重的 3期AKI,肾损伤严重程度是影响SOS患者生存的最重要的预后因素[17]。急性GVHD引起AKI的主要原因是细胞因子的释放、免疫损伤(如所致的肾病综合征和肾小球肾炎等)以及预防和治疗GVHD所用具有肾毒性的药物(如环孢素、糖皮质激素等),此外,严重GVHD可伴腹泻、脱水,造成循环血容量减少,从而导致肾前性AKI,最终导致AKI的发生[18]。
3 AKI的早期标志物
目前采用的AKI相关诊断标准多基于血清肌酐水平和尿量的变化,但临床对于尿量的监测常较困难,而血清肌酐水平也不能反映肾小球功能下降前早期肾小管损伤或缺血性组织损伤的改变,血清肌酐水平升高的变化滞后于肾损伤2~3 d,且血清肌酐水平易受性别、种族、肌肉、代谢等因素影响[19]。可见,应用传统血清肌酐和尿量的变化诊断AKI的方法无法在移植后早期识别AKI,因此新型和早期AKI相关的生物学标志物在早期识别AKI中受到越来越多的重视与关注。近年来,一些新型早期生物学标志物的出现为早期识别AKI带来可能。
3.1胱抑素C 胱抑素C是一种低分子量蛋白酶抑制剂,肾脏是其唯一的排泄器官,胱抑素C血中浓度的高低受肾小球滤过率影响,由肾小球滤过后在近端肾小管几乎被完全吸收,不受性别、年龄、饮食因素等外在因素的影响,正常机体状况下尿液中胱抑素C水平处于极低水平状态,但在近端小管细胞的重吸收功能受损时,尿液中胱抑素C水平升高[20]。胱抑素C是肾小球滤过的生物标志物,可为不同部位早期肾损伤提供很好的预测。Haase等[21]研究发现,AKI持续时间与血胱抑素C浓度呈正相关,血胱抑素C水平的升高也是预测AKI严重程度的独立因素,对判断肾损伤的预后转归情况具有重要作用。一项前瞻性研究显示,血清胱抑素C是强大的AKI独立预测指标,当血清胱抑素C≥1.255 mg/L时,其2年病死率、再住院次数以及再发肾衰竭的风险明显增加[22]。Deger等[23]通过前瞻性研究发现,异基因HSCT术后第13天、第20天和第27天血清胱抑素C>0.9 mg/L是AKI的显著预测因素,胱抑素C升高较血清肌酐升高变化早,可见,通过密切测定胱抑素C对HSCT术后早期识别和及时治疗AKI具有重要的临床意义,是早期识别AKI的有效血清学标志物。
3.2中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL) NGAL是由178个氨基酸组成的蛋白质,存在于肾小管,被认为是敏感性肾脏损伤标志物,正常情况下在肾、胃、肺等不同类型的器官细胞处于极低表达水平状态,但在脓毒症、缺血或肾毒性损伤时肾脏远端小管细胞可高水平表达[24]。一项纳入1 478例患者的Meta分析发现[25],NGAL在脓毒症的情况下高表达,对AKI诊断的灵敏度和特异度分别为0.83和0.57。一项回顾性研究发现,HSCT术后AKI患者尿NGAL的变化较血清肌酐变化提前近2 d,HSCT术后第9天尿NGAL/基线尿NGAL值为2.62时,预测AKI的灵敏度和特异度分别为0.85和0.83;同时还发现,尿NGAL(μg/L)每增加一个单位,患AKI的风险升高4%[26]。Bellos等[27]研究发现,血NGAL和尿NGAL对诊断AKI均有较好的敏感性和特异性。当NGAL>0.6 mg/L时,对AKI患者需要RRT还有预测作用[28]。Haase等[29]在进一步研究中发现,NGAL还可以预测处于亚临床状态AKI患者的不良预后风险。因此,NGAL可作为HSCT术后预测AKI的早期生物学指标。
3.3肝型脂肪酸结合蛋白(liver fatty acid binding protein,L-FABP) 尿L-FABP是一种在人肾小管近端细胞表达的15 000蛋白,为肾小管缺血或损伤的生物标志物,尿L-FABP在肾脏组织缺血或氧化应激作用下进入尿液[30]。尿L-FABP被认为是衡量HSCT术后AKI的指标。尿L-FABP高于参考值上限,反映可能存在亚临床肾病状态。有研究证实,2型糖尿病患者尿L-FABP的变化可发展为显性糖尿病肾病[31]。Shingai等[32]的一项前瞻性研究发现,高基线水平尿L-FABP是AKI发生的独立危险因素(RR=2.77,95%CI1.24~6.22,P=0.01),当尿L-FABP水平超过正常标准时,AKI的发生风险增加2.8倍;以尿L-FABP 8.4 μg/(g·Cr)为界分为高低两组时,高尿L-FABP水平组HSCT术后30 d累积AKI发生率显著高于低水平组(55.0%比26.6%,P=0.005)。Bai等[33]进行的前瞻性研究发现,尿L-FABP水平对严重的AKI具有较好的预测作用,其曲线下面积(area under curve,AUC)为0.79(P<0.001),较血清肌酐(AUC为0.89,P<0.001)和尿胱抑素C(AUC为0.88,P<0.001)的预测能力稍弱。总之,基线尿L-FABP水平的升高可能预示着早期肾损伤,与HSCT术后AKI高风险有关,但特异性不高,故仍需进一步研究其用于早期识别HSCT患者AKI的价值。
3.4肾损伤因子1(kidney injury molecule 1,KIM-1) KIM-1是肾脏近曲小管肾脏损伤的标志物,在正常肾脏和其他器官中低表达,但在缺血或中毒性损伤后,近端小管表达明显上调,可在基质金属蛋白酶的作用下裂解为可溶性片段随尿液排出,故在尿液中可被检测,尿液中KIM-1水平的升高较血肌酐提前[34]。Shao等[34]研究发现,KIM-1对早期(24 h内)AKI的诊断具有重要提示意义,尤其对年龄较小(婴儿和儿童)的患者。KIM-1结合其他肾损伤早期生物学标志物评估预测AKI具有较好的敏感性和特异性。一项前瞻性研究显示,较高的尿液KIM-1排泄与AKI的相对风险有关,单核细胞趋化蛋白1单项指标增高时,AKI相对风险增加2.3倍;当尿液KIM-1和单核细胞趋化蛋白1同时增高时,AKI风险增加3.4倍[35]。KIM-1与L-FABP联合预测AKI 3期(AKIN诊断标准)以及AKI相关病死患者时,其AUC值为0.93,灵敏度和特异度分别为77%和63%,故认为KIM-1可作为早期AKI的预测生物学标志物[36]。
3.5白细胞介素18(interleukin-18,IL-18) IL-18是巨噬细胞和肾小管细胞产生的促炎细胞因子。研究发现,IL-18在急性缺血性肾损伤时具有较高的特异性,且不受肾毒素、尿路感染和慢性肾脏病等因素的影响[37]。Parikh等[38]研究发现,IL-18水平较血肌酐水平增高提前1~2 d,且尿液IL-18对于AKI诊断具有较好的特异度及灵敏度,均大于90%。前瞻性研究发现,IL-18不仅可预测AKI患者的恶化情况,还与AKI患者的透析风险、住院时间以及病死率密切相关[39-40]。另有研究发现,IL-18联合α1抗胰蛋白酶、β2微球蛋白等形成的组合性标志物可较血清肌酐水平变化提前5 d预测HSCT术后AKI的发生[41]。由此可见,IL-18有望成为HSCT术后预测AKI的早期生物学标志物,但仍需进一步研究。
3.6其他标志物 生物学标志物组织金属蛋白酶抑制物2(tissue inhibitor of metalloproteinase 2,TIMP-2)和胰岛素样生长因子结合蛋白7(insulin like growth factor binding protein 7,IGFBP-7)均涉及G1期阻滞,在肾脏缺血或炎症情况下,可阻滞细胞损伤的早期阶段(G1期)。研究发现,患有败血症的AKI患者TIMP-2的敏感性高于IGFBP-7,而外科AKI患者IGFBP-7则优于TIMP-2[42]。还有研究发现,TIMP-2、IGFBP-7联合尿NGAL(尿TIMP-2×IGFBP-7>0.3,尿NGAL>0.15 mg/L)预测肾小管功能障碍和严重AKI具有较高的敏感性,AUC>0.8,并在肾脏损伤12 h后的预测能力逐渐提高[43-44]。目前,TIMP-2和IGFBP-7在相关心脏手术后AKI的研究较多,HSCT患者的研究较少,尚有待进一步评估。
上皮细胞和巨噬细胞等对损伤性刺激反应产生弹力素,可抑制蛋白水解酶。Hingorani等[45]的研究发现,尿弹力素水平的升高与HSCT术后60 d内AKI的发生有关,弹力素水平每增高0.5 μg/L,持续性蛋白尿的风险增加10%,总病死率也增加7%,并可在肾功能受损患者肾组织病理中发现肾远端肾小管存在弹力素,提示弹力素与HSCT患者蛋白尿、慢性肾病进展和死亡有关。因此,HSCT术后连续监测尿弹力素水平可能有助于早期识别AKI的发生。
尿α1微球蛋白是一种分子量为26 000~33 000的糖基化蛋白质,是肾脏近端肾小管功能的尿生物学标志物。Morito等[46]的一项前瞻性研究发现,HSCT术后第7天较高水平的尿α1微球蛋白对预测AKI的灵敏度为0.807(95%CI0.647~0.956),提示连续监测HSCT术后尿α1微球蛋白有助于早期发现严重AKI患者。因此,尿α1微球蛋白有望成为预测AKI尿生物学标志物。神经生长因子、成纤维细胞生长因子23也可作为AKI诊断的潜在早期生物学标志物,但其在HSCT中的敏感性和特异性资料尚欠缺,有待进一步研究评估[33,47]。此外,Klotho基因和尿调蛋白、富含半胱氨酸蛋白61等目前处于初始研究阶段。
4 AKI的预防和治疗
HSCT术后AKI与病死率升高和总存活率下降有关。目前,对HSCT术后AKI发病机制和危险因素的研究较多,但防治方案尚无统一标准,避免和管理治疗AKI发生、发展的相关危险因素仍是HSCT术后AKI防治的核心。常用的防治措施如下:①严格控制液体电解质平衡是预防的关键,可严密观察体重、液体平衡、血压、电解质、肌酐等变化情况;②尽量使用低强度预处理方案;③严密监测肾毒性药物,严格两性霉素B及其脂质体制剂的使用,允许的情况下可使用氟康唑或伏立康唑等替代两性霉素B预防感染;④及早发现和处理危险因素,如脓毒症、GVHD、肝脏SOS等;⑤在肿瘤溶解综合征或骨髓输注毒性发生时注意利尿和碱化尿液处理;⑥在病程早期干预相关肾脏病有助于预防AKI和相关并发症;⑦肾组织活检有出血风险,故临床上较少应用,因此无法准确评估HSCT术后AKI的病因,但仔细评估出血风险和组织学诊断结果对治疗的影响后可考虑肾组织活检[1,48-49]。此外,国家临床指导中心指南提倡使用早期预警评分早期识别和诊断AKI,评分指标包括体重、生命体征、尿量、肌酐、尿素氮、乳酸、血糖、血气和电解质等,同时提出可适当对少尿患者进行补液管理,并建议对存在体液丢失(如呕吐、腹泻)的患者停用血管紧张素转换酶抑制剂和血管紧张素转换酶受体抑制剂类药物,必要时行RRT[50]。随着AKI早期损伤标志物的不断发现,可应用相关肾脏损伤生物学标志物早期识别和诊断AKI,并为发现亚临床肾脏功能障碍做出贡献。
5 小 结
随着HSCT技术的不断提高,行HSCT术治疗的患者数量逐渐增多,关于HSCT术后相关并发症的研究越来越受到重视。AKI是HSCT术后常见的并发症,深入了解其发病机制和危险因素对HSCT术后AKI的预防和管理具有重要意义,早期发现AKI生物学标志物可早期识别和诊断AKI,指导临床治疗、改善患者预后。但目前HSCT术后利用血液或尿液早期生物学标志物对肾脏进行危险分层尚未形成统一的认识,需要相关科室以及HSCT专家和血液内科、肾脏病科等临床工作者的共同努力,通过不断实践研究,对HSCT术后AKI的诊疗和管理有更深的认识。
