基因枪介导的转 TaGAPDH8基因小麦的获得与鉴定
2019-03-15雷代丽雷瑛彤张阳璞邓西平杨淑慎
雷代丽,雷瑛彤,张 琳,张阳璞,邓西平,杨淑慎
(1.西北农林科技大学生命科学学院,陕西杨凌 712100; 2.中国科学院水利部水土保持研究所,陕西杨凌 712100)
小麦(TriticumaestivumL.)是世界范围内种植最广的粮食作物之一,它为人类提供了超过20%的热量和蛋白质,以及丰富的矿质元素等。但近年来温室效应及土地盐碱化问题越来越严重,小麦的品质和产量受到了严重的威胁[1],现有小麦品种已经难以满足人们对高品质小麦日益增长的客观需求。培养高抗的优良作物品种一直是育种专家们研究的重点。但传统的杂交育种方法无法避免育种周期长、杂交困难及无法获得优良性状的小麦品种等难题[2]。目前,小麦抗逆新品种的培育也因基因库的匮乏和方法的局限而落后于其他农作物。随着科学技术的发展,深入探索小麦生理生化特点,在分子水平上挖掘小麦抗逆基因、了解其抗逆机制,借助基因工程手段将抗性基因导入小麦,培育具有优良性状的抗旱、高产、高营养价值的品种是解决当今粮食短缺的根本途径之一[3]。
目前基因枪介导法是应用最广的植物转化方法之一,其原理是利用金属微粒将其上携带的外源基因高速射入受体细胞,外源基因随机插入受体细胞基因组并整合,最终得以表达。Vasil等[4]首次利用基因枪介导法将草丁膦乙酰转移酶基因(bar)导入小麦品种Pavon,获得了世界上第一批转基因小麦植株,为开展小麦分子育种奠定了基础。随后,Weeks等[5]利用基因枪介导法分别将β-葡萄糖苷酸标记基因(gus)、bar基因导入了小麦,初步建立了基因枪法转化小麦的技术体系。据统计,随着基因枪法在单子叶植物方面的转化技术越来越成熟,该法已占到小麦遗传转化的68.8%[6]。
甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH) 是一种高度保守的结构蛋白,几乎在所有组织和器官中均能稳定表达。它在真核生物和原核生物的细胞中占有10%~20%的蛋白总量,因其表达的稳定性,它常被人们选作内参进行研究[7]。然而越来越多的研究表明,GAPDH在植物生长发育及抗逆性等诸多方面都发挥着多元化的功能。在植物基础代谢方面,GAPDH参与植物碳水化合物(如糖类[8]和油脂[9])的积累,以及种子成熟和细胞程序性死亡过程[10];在植物生长和形态学方面,gapc1和gapc2的缺失会造成植物根系发育受阻、植株矮小和雄性不育等症状[11];在植物抗逆方面,过表达GAPDH能够增强植物对干旱环境的适应能力[12]。此外,GAPDH能通过降低过氧化物的方式减轻高盐对植物的毒害[13],这种抗盐功能可能与GAPDH能和参与盐胁迫的第二信使磷脂酸(phosphatidic acid,PA)相互作用有关[14]。
同时,有研究发现,用PEG处理抗旱小麦品种长武134后,植株大量表达分子量约为39.5 kD的GAPDH蛋白[15]。随着小麦基因组数据库日趋完整,Zeng等[16]在小麦基因组中共发现22个TaGAPDH基因亚型,除去其中3个编码非磷酸化蛋白的TaGAPN,共有13个基因亚型能够编码具有完整结构域的蛋白。TaGAPDH8基因便是其中特殊的一个,该基因长1 690 bp,含有11个外显子和10个内含子,其开放阅读框(Open Reading Frame,ORF)编码一个由337个氨基酸组成、分子量为36.61 kD、pI为 6.67的磷酸化蛋白(http://au.expasy.org/tools/protparam.html)。张 琳[17]研究发现,小麦中的TaGAPDH8基因会被某些胁迫大量诱导表达。本研究选择广泛种植于陕西和甘肃地区的抗旱小麦品种长武134和干旱敏感小麦品种郑引1号为材料,采用基因枪法建立这两个品种的转基因体系,并获得稳定表达目的基因的T3代株系,以期为进一步研究TaGAPDH8基因的生物学功能提供技术支撑和基础材料。
1 材料与方法
1.1 材 料
供试材料为抗旱品种长武134(CW134)和干旱敏感品种郑引1号(ZY1),由中国科学院水利部水土保持研究所提供。干扰表达载体pTCK303-RNAi由张 琳[17]提供,该载体中正义片段(Fragment1)和反义片段(Fragment2)之间由水稻内含子(rice intron)隔开。过表达载体pTCK303-TaGAPDH8由张阳璞[18]提供,该载体中SacI和SpeI两酶切位点之间的序列由TaGAPDH8基因编码序列代替。
1.2 培养基
本研究所用培养基类型及配方如下:诱导/恢复培养基:MS+2 mg·L-12,4-D+500 mg·L-1水解酪蛋白+30 g·L-1蔗糖;高渗培养基:诱导/恢复培养基+0.2 mol·L-1甘露醇+0.2 mol·L-1山梨醇;分化培养基:MS+2 mg·L-1玉米素+0.5 mg·L-1激动素+25 mg·L-1潮霉素+30 g·L-1蔗糖;生根培养基:1/2 MS+25 mg·L-1潮霉素+15 g·L-1蔗糖。在每种培养基中加入7 g·L-1琼脂粉,pH 调节为5.8,高温高压灭菌。其中水解酪蛋白、玉米素(solarbio)、潮霉素(solarbio)经过滤除菌,再加入灭菌后温度降至50 ℃左右的培养基中。
1.3 小麦愈伤组织的诱导和基因枪转化
参考池青等[19]的方法对小麦进行愈伤组织诱导和转化。转化后的愈伤组织转入恢复培养基培养14~21 d,再于分化培养基中培养28~35 d。将分化出的幼苗转入生根壮苗培养基中,在幼苗根长2~3 cm时转入4 ℃培养箱春化30 d,再移栽入花盆中培养。
1.4 再生植株的PCR鉴定与后代种植
待T0代再生植株长至三叶一心期,利用CTAB法提取潮霉素抗性小麦的基因组DNA,以检测载体序列上的潮霉素抗性基因(491 bp),引物序列为Fhyg:5′- TACTCTACACAGCCAT CGGGTCCAG,Rhyg:5′-ACTGGCAAA CTGT GATGGACGAC,由北京奥科鼎盛生物科技有限公司合成。PCR体系和程序参考2×TaqMasterMix(近岸蛋白,上海)说明书进行,其中退火温度为57 ℃,循环数为35,扩增产物用1%琼脂糖凝胶电泳检测。
选择PCR阳性植株单穗收取种子并做好标记,晾干后播种,将T1和T2代小麦种植后分别进行PCR检测,检测方法同T0代植株,收获T3代小麦种子。
1.5 转基因植株的生长情况比较
随机挑取大田T2代转基因小麦和普通小麦植株,于乳熟期测量株高和穗长,收获期测量穗粒数和千粒重。测量方法参照李立会[20]的标准,株高为地上部分长度(不包括芒),每组测5株;穗长为穗基部至顶部(不包括芒),每组测5穗;随机挑出1 000粒种子并称重计算千粒重,重复3次。
1.6 转基因植株的qRT-PCR鉴定
选取大小一致的T3代转基因小麦和对照组小麦种子,用0.1%的HgCl2消毒15 min,无菌水冲洗数次后浸泡16~20 h,腹沟向下平铺在铺有一层滤纸的培养皿中,加蒸馏水室温中黑暗萌发1 d,10 h光照/14 h黑暗条件下培养14 d后取样。将样品于液氮中速冻后放入-80 ℃冰箱中保存。用Trizol(TaKaRa,日本)提取植株总RNA,并按照PrimeScriptTMRT Reagent Kit with gDNA Eraser(TaKaRa,日本)试剂盒说明书进行cDNA第一链的合成。根据TaGAPDH8基因序列设计特异性引物(FGAPDH8:5′-CCACC AGCCGTCCCACAATA,RGAPDH8:5′-GAACC AATCTCCCAATCCGTC,扩增产物长度为207 bp),以小麦β-Actin基因(GenBank 注册号:AB181991)为内参(引物为Factin:5′-CGACTCTG GTGATGGTGTGAG,Ractin:5′-AGCAAGGTCC AAACGAAGGA,扩增片段长度为85 bp),使用CFX 96 Touch Real-time PCR Dectection System(Bio-Rad,美国),按照SYBR○RPremix Ex TaqTMⅡ试剂盒(TaKaRa,日本)说明书进行qRT-PCR。试验设置3次生物学重复,用2-ΔΔCt法分析目的基因的相对表达水平。用Excel 2010软件进行数据处理,用SPSS 22软件进行差异显著性分析。
2 结果与分析
2.1 基因枪法转化小麦愈伤组织及再生植株的结果
用含有目的基因和筛选标记基因Hyg的干扰载体和过表达载体分别转化1 000个CW134愈伤组织和1 000个ZY1愈伤组织,经潮霉素筛选,最终移栽成活15株CW134幼苗(图1A),植株再生率为1.5%,经PCR鉴定阳性植株为9株(图2A),阳性植株转化率为0.9%;获得ZY1再生苗23株(图1B),植株再生率为4.6%,经PCR鉴定阳性植株为13株(图2B),阳性植株转化率为2.6%。
2.2 T1代转基因小麦鉴定
对长武134和郑引1号T1代植株进行PCR鉴定,分别获得5株和9株阳性植株(图3),最终将收获种子的4个长武134株系和8个郑引1号株系分别命名为CW134-3、CW134-6、CW134-12、CW134-13以及ZY1-1、ZY1-3、ZY1-4、ZY1-9、ZY1-10、ZY1-14、ZY1-15、ZY1-17。
2.3 T2代转基因小麦在大田的生长状况比较
将T1代转基因小麦种子种植到大田,测量乳熟期小麦的株高、穗长、千粒重和穗粒数。在RNA干扰株系中,与对照相比,CW134-6和CW134-12的千粒重极显著(P<0.01)提高,株高显著(P<0.05)降低;CW134-13的穗长显著(P<0.05)降低。在过表达株系中,与对照相比,ZY1-10的穗长、千粒重和穗粒数极显著(P<0.01)提高,株高显著(P<0.05)降低;ZY1-1和ZY1-3的穗长、千粒重和穗粒数极显著(P<0.01)或显著(P<0.05)提高,株高显著(P<0.05)增加;其余5个株系也都至少有2个性状与对照的差异达到了显著水平。

A:转基因CW134;B:转基因ZY1。 A:Transgenic plants of CW134;B:Transgenic plants of ZY1.
图1转基因小麦植株
Fig.1Wheattransgenicplant
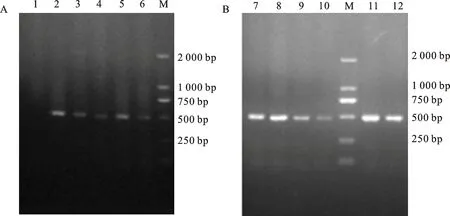
1:长武134的阴性植株;2~6:长武134的阳性植株;7~12:郑引1号的阳性植株;M:DL2000 DNA marker。
1:Negative plant of CW134;2-6:Positive plants of CW134;7-12:Positive plants of ZY1;M:DL2000 DNA marker.
图2长武134(A)和郑引1号(B)部分T0代转基因植株的PCR结果
Fig.2PCRdetectionresultsofT0generationplantsofCW134(A)andZY1(B)
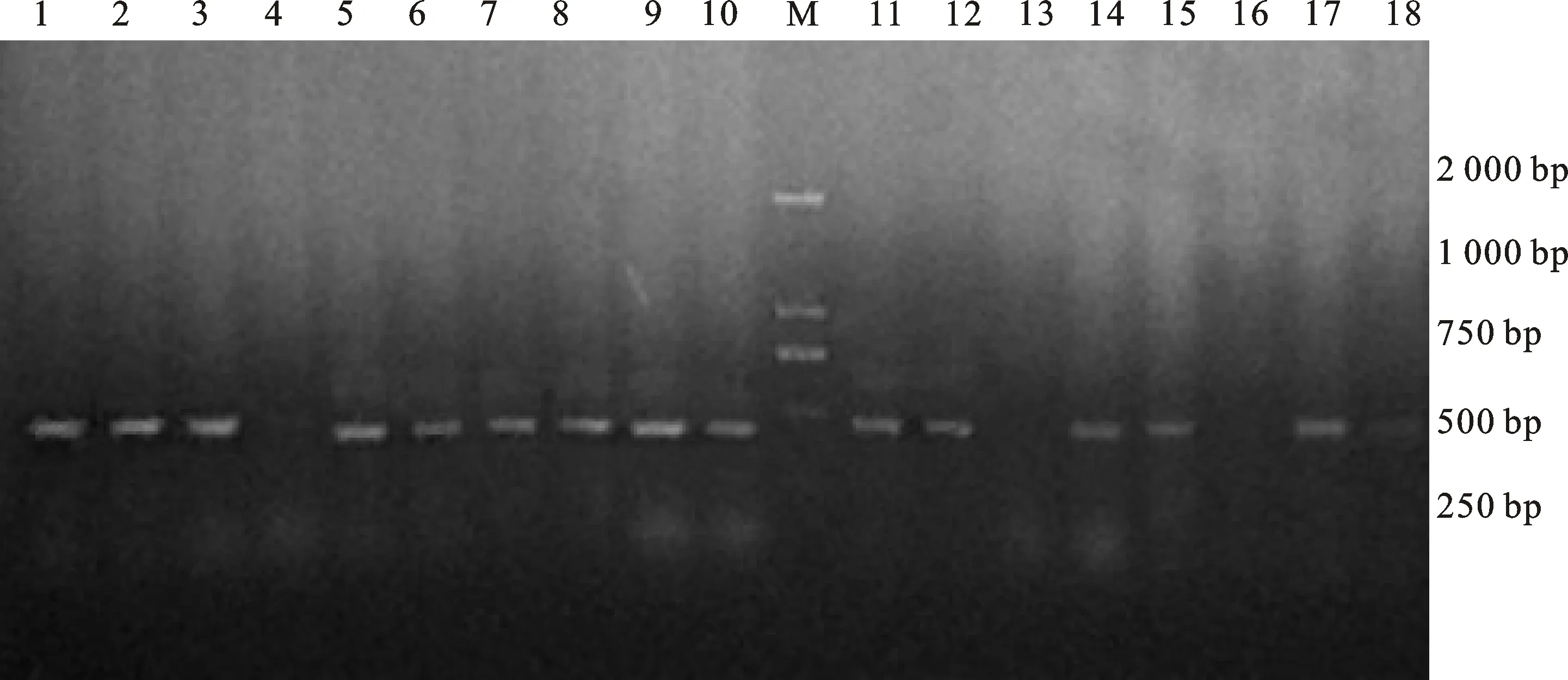
1~3和5~10:郑引1号的阳性植株;4:郑引1号的阴性植株;11、12、14、15、17:长武134的阳性植株;13、16、18:长武134的阴性植株;M:DL2000 marker。
1-3 and 5-10:Positive plants of ZY1;4:Negative plant of ZY1;11,12,14,15 and 17:Positive plants of CW134;13,16 and 18:Negative plants of CW134; M:DL2000 DNA marker.
图3T1代转基因植株的PCR结果
Fig.3PCRdetectionresultsofT1generationplants

表1 T2代转基因小麦株系的主要农艺性状Table 1 Major agronomic traits of T2 transgenic ZY1 and CW134 lines
*和**分别表示与CK的差异达到了显著(P<0.05)和极显著(P<0.01)水平。
* and** indicate significant differences between transgenic lines and CK at 0.05 and 0.01 levels,respectively.
2.4 TaGAPDH8基因的表达分析
以T3代转基因小麦的株系为材料提取RNA并反转录为cDNA。qRT-PCR鉴定结果表明,正常生长条件下株系间TaGPDH8基因的表达水平存在差异。4个长武134株系均表现出较低的表达量(图4A),尤其是CW134-12和CW134-3,TaGAPDH8基因的表达量仅为对照的21%和53%,表明在这两个株系中目的基因的表达受到了较大程度的抑制。在郑引1号的8个株系中,TaGAPDH8基因的表达量均高于对照(图4B),其中ZY1-10的表达量最高,ZY1-1次之,分别为对照的3.02和4.02倍。

A:4个干扰表达株系中TaGPDH8基因的表达量;B:8个过表达株系中TaGPDH8基因的表达量。
A:Relative expression levels ofTaGAPDH8in four RNAi lines;B:Relative expression levels ofTaGAPDH8in eight overexpression lines.
图4正常生长条件下TaGPDH8基因在小麦株系中的表达分析
Fig.4TaGAPDH8geneexpressioninwheatlinesundernormalgrowthconditions
3 讨 论
转基因技术可以快速、定向获得植物新品种,但目标基因的稳定遗传和表达却难以控制。作为六倍体(AABBDD)单子叶植物,小麦具有庞大的基因组和大量的重复序列,遗传背景复杂,转化难度大。研究发现,外植体的选择成为小麦遗传转化成果与否与的关键,小麦材料的再生效率成为首要的考虑因素。虽然可以进行遗传转化的组织有根、成熟胚、花药、幼穗、幼胚和茎分生组织等多种类型,但幼胚再生性能最好[21],因此本试验以幼胚诱导的愈伤组织为材料进行遗传转化。
本试验以长武134和郑引1号小麦为材料成功获得遗传外源基因的转化植株,其T0代植株转化效率分别为0.9%和2.6%,说明转化效率过低的问题仍然存在。这与外植体的基因型、培养基成分、受体预处理方式和处理时间、受体轰击后培养及筛选,以及转化条件如微弹种类、直径大小和用量、轰击距离和压力等[22]多种因素相关。基因枪转化法操作步骤繁琐,过低的转化率一直是限制其广泛应用的关键因素之一。
本实验对T2代小麦株系进行了形态指标测量和基因表达分析。长武134株系中变化比较明显的是千粒重,既有显著降低(P<0.01,CW134-6),也有显著升高(P<0.01,CW134-12);而由于郑引1号株系比较多,其植株的农艺性状差异也更大。造成这种结果的原因可能与各株系间目的基因的表达量有所差异,如转化了RNAi载体的株系CW134-12的TaGAPDH8基因的表达量只有对照的0.21倍,而CW134-13却高达0.78倍;转化了过表达载体的ZY1-1、ZY1-4和ZY1-10的表达量提高到了2倍以上。造成植株农艺性状和基因表达量差异的原因有很多,如株系间外源基因拷贝数、插入位点、大田复杂的环境等。基因枪法转化的植株外源基因拷贝数多,其随机整合的特点使每个株系的基因表达各有不同,还容易导致外源基因沉默和丢失的情况。如ZY1-3和ZY1-10中TaGAPDH基因的表达量相差了3.29倍,原因可能是在ZY1-3中外源基因插入的位点在非编码区,导致外源基因无法翻译。因此在以后的试验中需要从这些株系中挑选出具有优良性状的株系进一步研究。
本试验研究了小麦转化体系以及T2代转基因小麦在大田的性状,得到了与对照植株相比具有明显差异的株系(表1)。此外,本试验还探究了T3代小麦中TaGAPDH基因的表达量,证明确实获得了转基因株系,如下调基因表达的CW134-3和CW134-6及上调基因表达的ZY1-1和ZY1-10(图4)。综上所述,本试验采用基因枪转化小麦幼胚的方法成功获得TaGAPDH8的转基因株系,为进一步研究该基因的功能奠定了基础。
