不同类型细胞在Oct4和Nanog基因启动子区域的甲基化水平▲
2019-03-14苏远婷项倩彤张汝芝
苏远婷 项倩彤 崔 伟 张 慧 张汝芝
(1 安徽省合肥市第二人民医院皮肤科,合肥市 233000,电子邮箱:suyuanting12345@163.com;2 苏州大学第三附属医院皮肤性病科,江苏省常州市 213003)
DNA甲基化是一种稳定的表观遗传修饰[1],在基因表达调控、细胞增殖、细胞分化、细胞发育、基因组印记和DNA突变等方面都起着重要的作用。甲基化程度可调控组织专一性基因的表达,基因的转录水平与其甲基化程度呈负相关。因此,多能性相关基因启动子的DNA甲基化程度降低是细胞重编程达到多能状态所必需的[2]。Oct4和Nanog是维持干细胞多能性和自我更新的转录因子,可通过结合靶基因调控区选择性地抑制分化基因表达或促进多能性基因表达[3]。在分化的细胞中,Oct-4、Nanog基因启动子区域高度甲基化且处于失活状态,而在胚胎干细胞(embryonic stem cell,ESC)中这些启动子区域处于去甲基化活化状态。有学者在诱导多能干细胞(induced pluripotent stem cells,iPSCs)的重编程过程中检测到这些区域完全去甲基化[4]。本研究采用重亚硫酸氢盐测序PCR,对比分析表皮细胞和其诱导产生的iPSCs在Oct4和Nanog基因启动子区域的甲基化程度。
1 材料和方法
1.1 材料
1.1.1 标本来源:包皮和毛囊标本来源于苏州大学第三附属医院泌尿外科的包皮环切术和皮肤科小手术切除组织。
1.1.2 主要试剂及仪器:人黑素细胞培养基(M254)、人黑素细胞生长添加成分(human melanocyte growth supplement,HMGS)、人表皮细胞培养基、人角质形成细胞生长添加成分(human keratinocyte growth supplement,HKGS)、杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)、0.25%/0.05%胰酶、胎牛血清、干细胞完全培养基和条件培养基均购自美国Gibaco公司,DNA提取试剂盒购自德国Qiagen公司(批号:51306),293T饲养层细胞、慢病毒载体[Lenti-Oct4-GFP(批号:Ab27449)、Lenti-Sox2-GFP(批号:Ab27655)、Lenti-Klf4-GFP和Lenti-c-myc-GFP]购自上海斯丹赛公司,pUC18-T载体、TaqDNA聚合酶、PCR产物纯化回收试剂盒(批号:SK8141)、质粒抽提试剂盒(批号:SK8161)、感受态细胞制备试剂盒(批号:SK9307)购自生工生物工程(上海)股份有限公司。PCR反应扩增仪购自加拿大BBI公司,3730型测序列分析仪购自美国ABI。
1.2 方法
1.2.1 获取细胞:(1)表皮黑色素细胞(epidermal melanocytes,EMC):0.25%中性酶消化包皮组织2 h以分离表皮及真皮,再用0.25%胰酶消化表皮10 min,吹打、中和,获取细胞悬液,种植于培养瓶中,待细胞生长密度达80%~90%时,进行差别胰酶纯化,得到纯化的EMC,用M254培养基(含HMGS)培养、传代、扩增;(2)表皮角质形成细胞(epidermis keratinocytes,EKC):获取方法同EMC,获取纯化的EKC后用含HKGS的人表皮细胞培养基培养、传代、扩增;(3)耐受胰酶消化的黑色素细胞(trypsinization-enduring epidermal melanocytes,TE-EMC):将EMC细胞悬液在0.25%胰酶中处理4 h,中和,更换M254培养基培养(含HMGS)、传代、扩增;(4)毛囊角质形成细胞(follicular keratinocytes,FKC):0.25%胶原酶处理成年患者头皮的毛囊组织2 h,分离毛囊,0.25%胰酶消化15 min,中和、吹打,获取细胞悬液,用人表皮细胞培养基培养(含HKGS)、传代、扩增; (5)iPSCs:将携带有Oct4、Klf-4和C-myc 3因子或Oct4、Klf-4、C-myc和Sox-2 4因子的慢病毒载体,按照感染复数值(转染时病毒与细胞数量的比值)为15 ∶1、细胞数为4×104/ml、聚凝胺浓度为10 μg/ml,维生素C浓度为10 μg/ml加入M254培养基,终体积为2 ml,然后转染第3代的EMC,24 h后去除病毒接种于铺满滋养层细胞(293T细胞)的鼠尾胶原包被板中,用干细胞完全培养基培养,接种第12天更换培养基(1/2完全培养基和1/2条件培养基),在荧光显微镜下观察,约20 d即可见明显的3因子转染iPSCs(3F-iPSCs)和4因子转染iPSCs(4F-iPSCs)克隆,挑选克隆,扩增培养。
1.2.2 DNA提取和重亚硫酸盐修饰:用胰酶消化呈对数期生长的6种细胞(EMC、EKC、TE-EMC、FKC、3F-iPSCs及4F-iPSCs),用全基因组DNA提取试剂盒抽提细胞的DNA,溶于200 μl AE液中,用紫外分光光度计测量核酸吸光度A260和A280值,纯度为1.6~2.1为合格DNA。再用亚硫酸氢盐处理,使未甲基化的胞嘧啶转化为尿嘧啶,而甲基化的胞嘧啶保持不变,亚硫酸盐修饰主要步骤:(1)碱变性:取2 μg DNA稀释至50 μl,加入5.5 μl的3M氢氧化钠(NaOH),置于42℃水浴30 min;(2)硫化和脱氢:加入30 μl的10 mM对苯二酚和520 μl的3.6 M NaOH至上述溶液,混匀,200 μl液状石蜡防止氧化,50℃避光水浴16 h;(3)纯化和脱硫:用纯化试剂盒纯化修饰后的DNA,再加入5.5 μl的3 M NaOH,室温放置15 min;(4)沉淀回收:加8 μl的3 M乙酸钠、4 μl的10 mg/ml糖原和270 μl冰无水乙醇,置于-20℃,过夜沉淀,室温下12 000 r/min离心10 min,倒去上清液,加500 μl 70%乙醇,室温下12 000 r/min,离心5 min,去上清;重复以上操作1次,洗涤、室温干燥5 min,加入20~30 μl 双蒸水,溶解沉淀。
1.2.3 PCR扩增:以修饰后的DNA为模板进行PCR扩增,引物序列[由生工生物工程(上海)股份有限公司提供]见表1。PCR反应体系:模板3 μl、上下游引物各1 μl、dNTP 1 μl、Tap缓冲液5 μl、Taq酶0.8 μl、去离子水38.2 μl,共50 μl。采用PCR反应扩增仪扩增、3%糖凝胶电泳分离观察、凝胶成像系统成像。
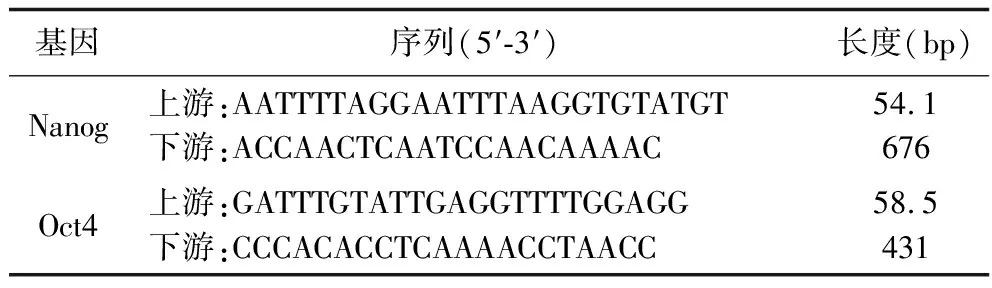
表1 Oct4和nanog基因上下游引物序列
1.2.4 克隆测序:从电泳板上切割出含目的DNA片段的凝胶块,将PCR产物纯化、回收,再将产物连接到pUC18-T载体,连接反应体系包括1 μl 10×连接缓冲液、1 μl 50%聚乙二醇、50 ng pUC18-T载体、0.2 pmol PCR产物、2.5 U T4DNA连接酶,加入相应体积的H2O使反应终体积为10 μl,18℃连接过夜。制备感受态细胞转化连接产物,取大肠杆菌DH5α(上海生物工程股份有限公司)涂布在预先用20 μl的100 mM异丙基硫代半乳糖苷和100 μl的20 mg/ml 5-溴-4-氯-3-吲哚-β-D-半乳糖苷涂布的氨苄西林平板上,倒置培养过夜。选择在IPTG/X-gal平板上生长的白色菌落,用牙签挑至含氨苄西林的液体培养基,37℃培养过夜。用质粒抽提试剂盒提取质粒,测序由上海生工生物工程有限公司完成。
1.3 统计学分析 采用SPSS 17.0软件进行分析,计数资料用χ2检验。以P<0.05差异有统计学意义。
2 结 果
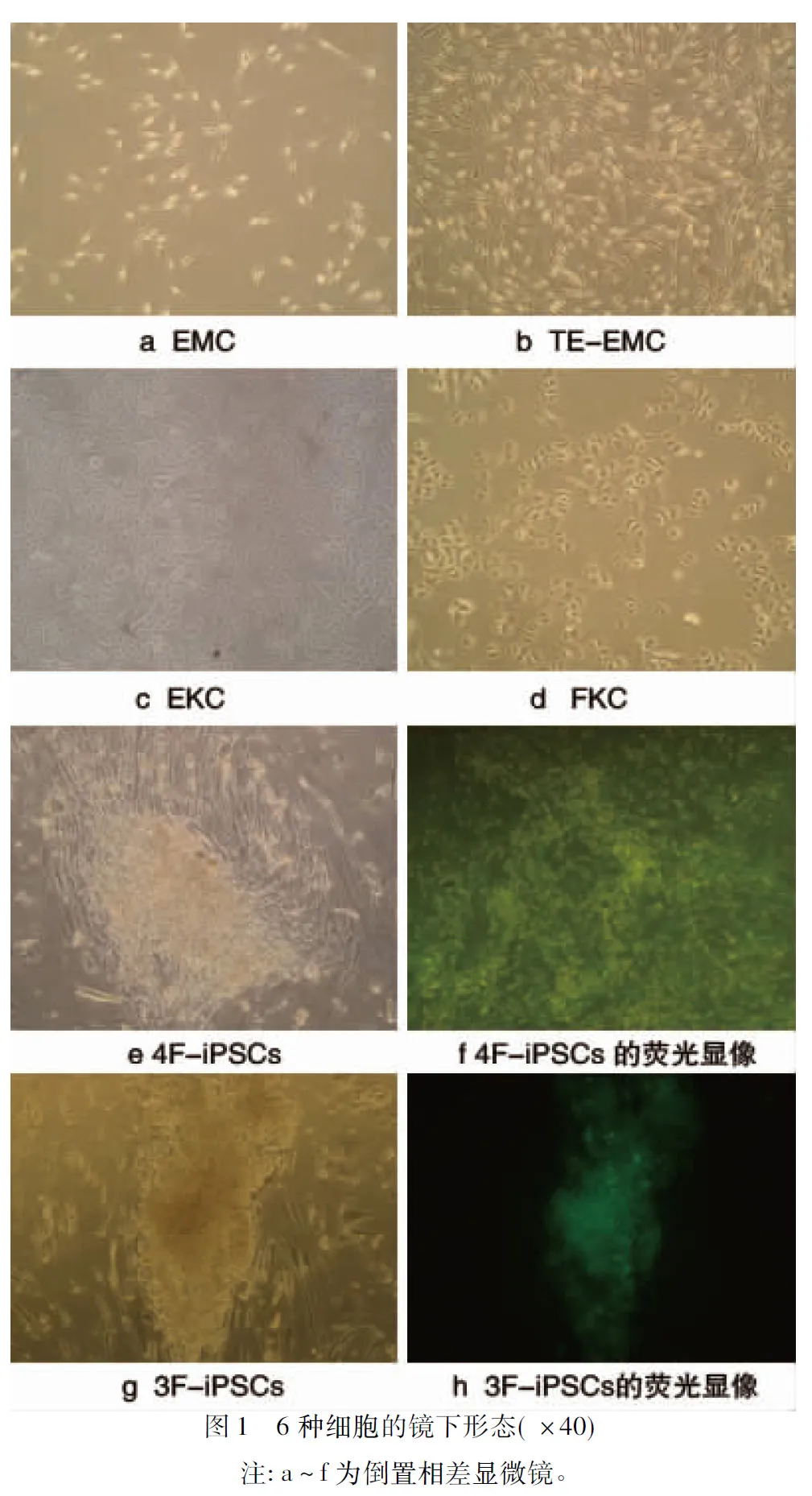
2.1 6种细胞的形态 (1)第3代的EMC呈树根状,有2~5个树突(见图1a),但第3代TE-EMC多为2个树突,部分细胞聚集、排列规整(见图1b);(2)第3代的EKC和FKC,均呈圆形、多角形,铺路石样排列,两者细胞形态差异性较小(见图1c、1d);(3)用慢病毒载体将4种因子导入EMC,转染培养第3天黑色素细胞从短棒状转变为类圆形,部分细胞聚集成团,第10天滋养层细胞的培养层出现类似于胚胎样细胞克隆增生(见图1e),体积较小且边缘较规整,随着培养时间延长,胚胎样克隆数量不断增多、体积逐渐增大,在荧光显微镜下,可见较强的荧光(见图1f);经3种转录因子转导分化的EMC也获得类似ESC的克隆(见图1g),且可见免疫荧光(见图1h)。
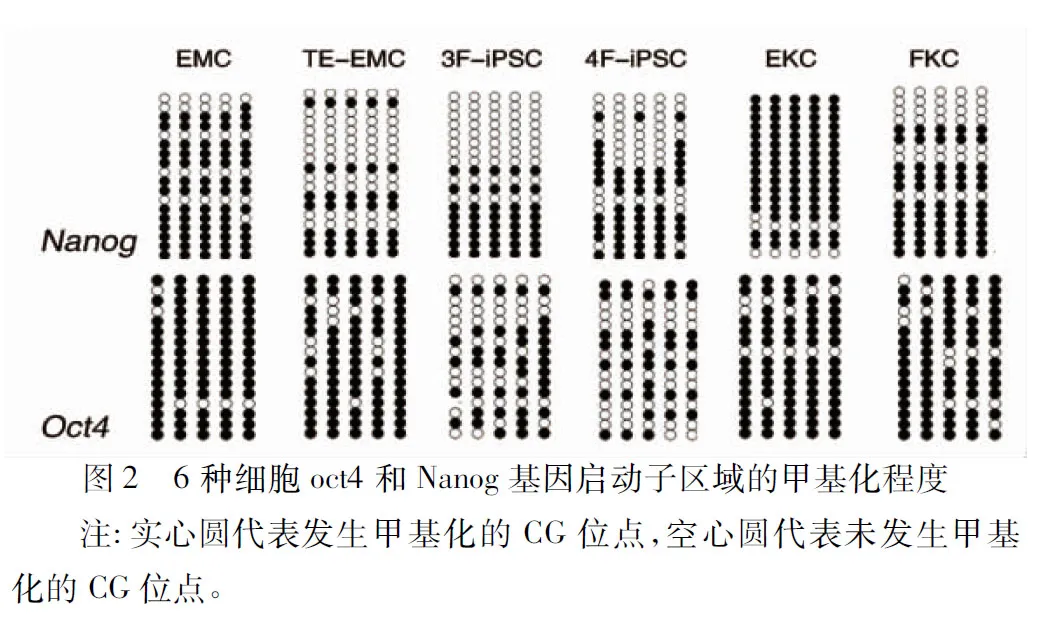
2.2 6种细胞的甲基化率比较 在Oct4位点,EMC的甲基化率高于3F-iPSCs和4F-iPSCs(均P<0.05),其他细胞与EMC的甲基化率比较差异均无统计学意义(均P>0.05);在Nanog位点,EMC的甲基化率高于 TE-EMC、FKC、3F-iPSCs和4F-iPSCs(P<0.05),EKC的甲基化率高于FKC(P<0.05)。 见表2及图2。
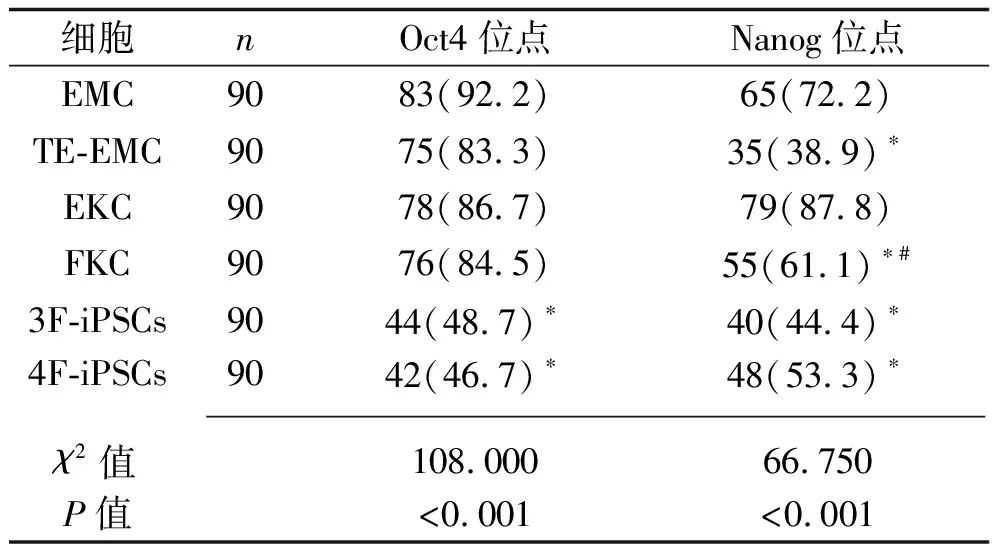
表2 6种细胞的甲基化程度[n(%)]
注:与EMC比较,*P<0.05;与EKC比较,#P<0.05。
3 讨 论
目前研究表明DNA甲基化水平和体细胞基因沉默促成重编程,评估体细胞基因启动子DNA甲基化状态可验证新iPSCs系[5]。有学者发现iPSCs 和ESC 间存在差异性[6],低代iPSCs保留着起始细胞的转录记忆,持续性传代,会缩小差异,提示iPSCs逐渐丢失从母细胞遗传的特性,而启动子DNA不完全甲基化部分解释了母细胞基因的持续性表达。DNA去甲基化引导细胞转化沿着正确轨道进行[7]:首先,脱甲基化建立DNA甲基化新模型,为胚胎通过卵合子重编程获得多能性,或通过原生殖细胞卵合子恢复全能性铺路;其次,低甲基化的启动子是关键性分化因子,在发育阶段,种系特异性基因打开谱系特异性转录循环,导致有效地分化。因此,DNA去甲基化充当细胞分化的监视角色,是干细胞发育过程中的垫脚石[8]。
Oct4是人类基因组6号染色体中POU5F1基因所编码,属于POU家族中八聚体结合亚组的成员,是多潜能细胞转录调控网络中的核心部分,通过单独识别或与其他转录因子相互协作,结合DNA调控域起作用,可募集不同功能的因子以建立基因调控网络,且决定细胞的早期命运,在原胚形成阶段促进细胞系的形成[9]。Nanog是Chambers等[10]在囊胚内细胞群、原始生殖细胞以及胚胎干细胞中发现的转录因子,是维持ESC自我更新和多潜能性的重要调控因子,在胚胎发育过程中能调控多能性内细胞团的命运,在维持外胚层多能性和阻止向原始内胚层分化中起着关键性的作用。
Yamanaka和Takahashi首次用4种转录因子(Klf4、Sox2、Oct4和C-myc)将鼠成纤维细胞重编程为iPSCs[11]。重编程的效率或与细胞代数、类型和起源有关,而相对于成纤维细胞,黑色素细胞和角质形成细胞较易诱导为iPSCs,这是因为它们与ESC一样都起源于外胚层,而成纤维细胞源于中胚层[12]。Wakao等[13]曾用胰酶处理表皮成纤维细胞,获取一种能够发育成人体各种组织和脏器的新型干细胞,即多系分化持续应激细胞。本实验得到的TE-EMC多以双极为主,部分树突较短,呈棒槌样,有些聚集成“鱼群”状,从形态学推测,比胰酶消化得到的黑色素细胞更接近原始态。此外,这两种细胞在Nanog基因启动子的甲基化程度有差异性,其中TE-EMC未甲基化位点多于EMC(P<0.05),表明其甲基化程度低,具有较强的干性,且其获取方法比差别胰酶消化法获得EMC的方法简单,可作为一种新型的实验方法。但TE-EMC是否与多系分化持续应激细胞有相似的作用,还需进一步研究。EKC和FKC的形态相似,但FKC在Nanog启动子区域未甲基化位点多于EKC(P<0.05),表示其分化程度较低。
我们用携带4因子(Oct4、Klf-4、C-myc、Sox-2)的慢病毒转染EMC重编程为iPSCs,另外利用黑色素细胞自分泌Sox-2的优势[14],我们将3因子(Oct4、Klf-4、C-myc)导入黑色素细胞,同样在培养10d左右,显微镜下可观察到立体生长的克隆。两种iPSCs的形态与ESC一样,且两者在启动子Oct4和Nanog基因的甲基化程度相似,说明干性程度相似,但与起始EMC比较,甲基化程度降低(P<0.05),表明重编程的iPSCs在Oct4和Nanog基因位点上处于低甲基化状态。此外,在表皮黑色素细胞转导的iPSCs中Sox-2是可忽略的[15],因此本实验也进一步表明了表达其中一个内源性转录因子的黑色素细胞,比角质形成细胞和成纤维细胞更适合诱导重编程,且黑色素细胞在临床也更易获取。
目前,对于iPSCs表观遗传的理解主要来自分析个别位点的途径,集中单个基因或单个表观遗传标记物。将来或许可以通过监测全基因组的方法,发现新的表观遗传修饰原理,进一步的理解其调节机制,从而利于我们操纵细胞命运的转变,例如分化、重编程和分化转换,即基本的表观遗传过程。现在已经存在一系列表观遗传抑制剂,能提升iPSCs的产量。随着表观遗传机制新观点的提出[16],我们能够设计出更多的方法,诱导细胞向我们所需的方向转变。而这些新观点为在细胞命运转化过程中研究动态的表观遗传提供更好的工具。
综上所述,细胞甲基化程度可能与其来源、形态、分化程度有关,与起始EMC比较,Nanog位点上TE-EMC、FKC、3F-iPSCs和4F-iPSCs的甲基化程度降低,两种iPSCs的甲基化程度相似。细胞甲基化程度可能与其来源、形态和分化程度有关。
