弱碱金属氧化物酸溶出率测算方法与应用的研究
2019-03-14
(成都大学生物工程学院,四川成都,610106)
每个活性一元弱碱金属氧化物都有自已确定的酸溶-水解-碱式化-桥连聚合反应式[1~3]。定义活性一元弱碱金属氧化物酸溶-水解-碱式化至氢氧化物开始沉淀时能测算生成聚合碱式该元素盐的最高pHh值、最高碱化度(Bh%)和酸溶出率(wh%)[4,5]。
类铝土矿指化学成分类似于铝土矿[6],如铝土矿、氢氧化铝(三水铝石)、煤矸石、油页岩灰渣、人工合成铝酸钙粉(具有活性)、赤泥(氧化铝生产废弃物/具有活性)等。类铝土矿含有多元弱碱金属氧化物,主要成分为氧化铝,次要成分有少量的氧化铁、氧化钛、氧化钙、氧化镁等,以及二氧化硅和少量的氧化钾、氧化钠等,统称高铝多元氧化物矿粉。
高铝多元氧化物矿粉的含量虽然各不相同,但它们和氧化铝一样一经活化,一样参与酸溶-水解-碱式化-桥连聚合反应,同在反应液中形成相同的pH值和相同的碱化度(B%)[5]。由此定义高铝多元氧化物矿粉经活化(焙烧)-酸溶-水解-碱式化至氢氧化物开始共同沉淀时能测算生成聚合碱式铝多元盐的最高pHh值、最高碱化度(Bh%)和酸溶出率(wh%)。
根据弱碱金属氧化物酸溶出率(w%)和pH值的测算值,制作w%─pH值变化线,在w%─pH值变化线上选择液体(liquid)产品的最佳生产条件,如酸溶出率(wl%)和pHl值。
1 弱碱金属氧化物酸溶出率和碱化度的测算方法
活性弱碱金属氧化物酸溶-水解-碱式化-桥连聚合生成聚合碱式盐,有三个表述量,如pH值/[H+]、溶出率/w%、碱化度/B%等,彼此相关联。通过测定pH值,能计算相应活性氧化物的酸溶出率(在反应液中为氧化物的含量)和碱化度。
定义⑴:在生产实践中发现,弱碱金属氧化物酸溶-水解-碱式化至氢氧化物开始沉淀的最高pHh值<7时,升高(△)1个pH值单位{[H+]/10-1}相当于[H+]摩尔浓度数(mol数m/L≈mol数m/kg)减少至原有值的10%(10-1)[7]。
推论①:与H+作用的弱碱金属[Mn+/n]摩尔浓度数(mol数m/L≈mol数m/kg)同样减少至原有值的10%(10-1),即该弱碱金属氧化物生成聚合碱式盐的溶出率减少至原有值的10%。导出弱碱金属氧化物升高(△)pH值后溶出率(w△pH%)和碱化度(B△pH%)的计算式:
w△pH%=溶出率原有值(w0%)—溶出率原有值(w0%)×△pH(值数)×m(氧化物中金属mol数)×10%= w0%×[1-△pH×m×10%]。
式中溶出率原有值(w0%):定义为在pH0值≤0时弱碱金属氧化物1mol溶于1 kg反应液的质量百分数。
推论②:由测定升高的pH值计算弱碱金属氧化物生成聚合碱式盐的碱化度(B△pH%)计算式:
B△pH%=△pH×m×10%
定义⑵:在生产实践中发现,弱碱金属氧化物酸溶-水解-碱式化至氢氧化物开始沉淀的最高pHh值>7时,升高(△)1个pH值单位相当于[H+]摩尔浓度数(mol数m/L≈mol数m/kg)减少至原有值的1%(10-2)。
推论①:与H+作用的弱碱金属[Mn+/n]摩尔浓度数(mol数m/L≈mol数m/kg)同样减少至原有值的1%(10-2),即该弱碱金属氧化物生成聚合碱式盐的溶出率减少至原有值的1%。导出弱碱金属氧化物升高(△)pH值后溶出率(w△pH%)和碱化度(B△pH%)的计算式:
w△pH%=溶出率原有值(w0%)—溶出率原有值(w0%)×△pH(值数)×m(氧化物中金属mol数)×1%= w0%×[1-△pH×m×1%]。
式中溶出率原有值(w0%):定义为在pH0值≤0时弱碱金属氧化物1mol溶于1 kg反应液的质量百分数。
推论②:由测定升高的pH值计算弱碱金属氧化物生成聚合碱式盐的碱化度(B△pH%)计算式:
B△pH%=△pH×m×1%
2 一元弱碱金属氧化物酸溶出率和碱化度的测算
活性一元弱碱金属氧化物酸溶-水解-碱式化-桥连聚合生成聚合碱式盐,通过测定pH值,能计算相应氧化物的溶出率/w%和碱化度/B%。
例1,配制活性氧化铝1mol 溶于1kg反应液:1mol活性Al2O3(102g)和6mol的HCl(6×36.5g)溶于1kg反应液,转换为质量百分数浓度为10.2%,开始沉淀的pHh值=3.3[4]<7。根据定义⑴推论①计算:由pH值≤0升高1个pH值、2个pH值,升高至开始沉淀的pHh值为3.3时Al2O3的溶出率/w%。
在pH值≤0,w0%=10.2%,Al2O3中Al-mol数为2;
△1个pH值,w△1%=10.2%[1-△1×2×10%]=8.2%;
△2个pH值,w△2%=10.2%[1-△2×2×10%]=6.1%;
△3.3个pH值,wh%=10.2%[1-△3.3×2×10%]=3.5%。
通过制作氧化铝w%─pH值变化线(见图1),证明升高不同的pH值按定义计算的结果值都落点在溶出率/w0%与wh%的连线上(见图1)。
根据定义⑴推论②,计算开始沉淀时的最高碱化度/Bh%=3.3×2×10%=66%。
例2,配制活性氧化铁1mol 溶于1kg反应液:1mol活性Fe2O3(160g)和6mol的HCl(6×36.5g)溶于1kg反应液,转换为质量百分数浓度为16.0%,开始沉淀的pHh值=1.6[4]<7。根据定义⑴推论①计算:由pH值≤0升高0.6个pH值、1个pH值,升高至开始沉淀的1.6个pH值时Fe2O3的溶出率/w%。
在pH值≤0,w0%=16.0%,Fe2O3中Fe-mol数为2;
举例:基于特征b33a589d3627bc6f2e5bd0e6b42f 53b6,探测到URL http://198.98.122.172/cunty.sh,进而截取获得IP 198.98.122.172,针对这个IP进行端口探测和协议识别198.98.122.172:50
△0.6个pH值,w△0.6%=16.0%[1-△0.6×2×10%]=14.1%;
△1个pH值,w△1%=16.0%[1-△1×2×10%]=12.8%;
△1.6个pH值,wh%=16.0%[1-△1.6×2×10%]=10.9%。
通过制作氧化铁w%─pH值变化线(见图1),证明升高不同的pH值按定义计算的结果值都落点在溶出率/w0%与wh%的连线上(见图1)。
根据定义⑴推论②,计算开始沉淀的最高碱化度/Bh%=1.6×2×10%=32%。
例3,配制活性氧化钙1mol 溶于1kg反应液:1mol活性CaO(56g)和2mol的HCl(2×36.5g)溶于1kg反应液,转换为质量百分数浓度为5.6%,开始沉淀的pHh值=10.7[8]>7。根据定义⑵推论①计算:由pH值≤0升高1个pH值、8个pH值,升高至开始沉淀的pHh值为10.7时CaO的溶出率/w%。
在pH值≤0,w0%=5.6%,CaO中Ca-mol数为1;
△8个pH值,w△8%=5.6%[1-△8×1×1%]=5.2%;
△10.7个pH值,wh%=5.6%[1-△10.7×1×1%]=5.0%。
通过制作氧化钙w%─pH值变化线(见图1),证明升高不同的pH值按定义计算的结果值都落点在溶出率/w0%与wh%的连线上(见图1)。
根据定义⑵推论②,计算开始沉淀的最高碱化度/Bh%=10.7×1×1%=10.7%。
例4,配制活性氧化镁1mol 溶于1kg反应液:1mol活性MgO(40g)和2mol的HCl(2×36.5g)溶于1kg反应液,转换为质量百分数浓度为4.0%,开始沉淀的pHh值=9.4[4]>7。根据定义⑵推论①计算:由pH值≤0升高1个pH值、8个pH值,升高至开始沉淀的pHh值为9.4时MgO的溶出率/w%。
在pH值≤0,w0%=4.0%,MgO中Mg-mol数为1;
△1个pH值,w△1%=4.0%[1-△1×1×1%]=3.9%;
△8个pH值,w△8%=4.0%[1-△8×1×1%]=3.7%;
△9.4个pH值,wh%=4.0%[1-△9.4×1×1%]=3.6%。
通过制作氧化镁w%─pH值变化线(见图1),证明升高不同的pH值按定义计算的结果值都落点在溶出率/w0%与wh%的连线上(见图1)。
根据定义⑵推论②,计算开始沉淀的最高碱化度/Bh%=9.4×1×1%=9.4%。
总结:铝铁钙镁氧化物不同pH值的溶出率(w%)测算值,见表1和图1。

表1 一元弱碱金属氧化物不同pH值的不同溶出率(w%)

图1 一元弱碱金属氧化物w%─pH值线
3 活性高铝(铁)多元氧化物矿粉酸溶出率和碱化度的测算
活性高铝(或高铁)多元弱碱金属氧化物矿粉,如青川活性铝土矿粉或云阳硫铁矿烧渣,由主料氧化铝(Al2O3)或氧化铁(Fe2O3)和次料铁(铝)钛钙镁氧化物两部分组成,溶于酸-水解-碱式化-桥连聚合生成聚铝(或聚铁)多元碱式盐,可做净水剂。每种新原料生产之前需要进行小试[2],测定活性高铝(或高铁)多元弱碱金属氧化物矿粉酸溶-水解-碱式化至开始氢氧化物共同沉淀的pH值为最高pHh值、测定或计算最高pHh值时高铝(或高铁)多元氧化物的溶出率(wh%)和碱化度(Bh%)[9,10]。
制作多元弱碱金属氧化物酸溶出率w0%─wh%连结线:以活性高铝(或高铁)多元氧化物为原料,白云石矿粉为辅料,通过计量配方保证在pH值≤0的反应液中原辅料中活性高铝(或高铁)多元氧化物总含量≥10%,即保证原辅料的溶出率(w0%)达到10%。再测定或计算经酸溶-水解-碱式化至开始氢氧化物共同沉淀的最高pHh值时的溶出率(wh%)。之后应用溶出率(w%)与pH值的变化关系制作w%─pH值变化线,在w%─pH值变化线上选择液体(liquid)产品的最佳生产条件,如酸溶出率(wl%)即液体产品含量(wl%)和pHl值可换算为液体产品碱化度(Bl%)[9,10]。
例1,青川活性铝土矿粉酸溶出率和碱化度的测算
青川活性铝土矿粉为原料[5],文献[5]已确认活性铝土矿粉酸溶-水解-碱式化至开始氢氧化物共同沉淀的最高pHh值测得=2.7[5]<7,根据定义⑴推论①计算,由pH值≤0,升高1个pH值、2个pH值、2.7个pH值时青川活性铝土矿粉的溶出率/w%。
在pH值≤0,w0%=10.0%,主料Al2O3中Al-mol数为2;
△1个pH值,w△1%=10.0%[1-△1×2×10%]=8.0%;
△2个pH值,w△2%=10.0%[1-△2×2×10%]=6.0%;
△2.7个pH值,wh%=10.0%[1-△2.7×2×10%]=4.6%。
通过制作高铝多元氧化物w%─pH值变化线(见图2),证明升高不同的pH值按定义计算的结果值都落点在溶出率/w0%与wh%的连线上(见图2)。
根据定义⑴推论②,计算开始共同沉淀的最高碱化度/Bh%=2.7×2×10%=54%,与文献[9]测试结果相符合。
例2,云阳硫铁矿烧渣酸溶出率和碱化度的测算
云阳硫铁矿烧渣为原料[11],文献[11]已确认硫铁矿烧渣矿粉酸溶-水解-碱式化至开始氢氧化物共同沉淀的最高pHh值测得=1.8<7,根据定义⑴推论①计算,由pH值≤0,升高0.6个pH值、升高1个pH值、升高1.8个pH值时云阳硫铁矿烧渣的溶出率/w%。
在pH值≤0,w0%=10.0%,主料Fe2O3中Fe-mol数为2;
△0.6个pH值,w△0.6%=10.0%[1-△0.6×2×10%]=9.9%;
△1个pH值,w△1%=10.0%[1-△1×2×10%]=8.0%;
△1.8个pH值,wh%=10.0%[1-△1.8×2×10%]=6.4%;
通过制作高铁多元氧化物w%─pH值变化线(见图3),证明升高不同的pH值按定义计算的结果值都落点在溶出率/w0%与wh%的连线上(见图3)。
根据定义⑴推论②,计算开始共同沉淀的最高碱化度/Bh%=1.8×2×10%=36%。
总结:多元弱碱金属氧化物不同pH值的溶出率(w%)测算值,见表2,图2和图3。

表2 多元弱碱金属氧化物不同pH值的溶出率(w%)计算值
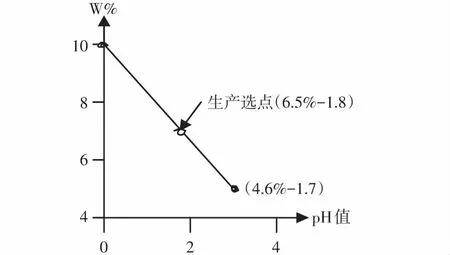
图2 活性铝土矿w%─pH值线
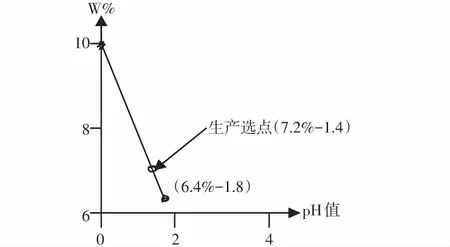
图3 黄铁矿烧渣w%─pH值线
4 测算结果的应用
4.1 青川活性铝土矿生产聚铝多元盐净水剂
由青川活性铝土矿粉w%─pH值变化线图2发现,生产聚铝多元盐净水剂,液体产品主料选定Al2O3≥6.5%,pH值选定在1.8,计算碱化度B=36%。碱化剂由原料(活性铝土矿)辅料(白云石)共同提供弱碱金属(铝除外)氧化物总含量≥3.5%。其他如重金属含量应符合GB/T 22627—2014标准。净水剂效果值=1.8/2.7=67%[5]。
4.2 云阳硫铁矿烧渣生产聚铁多元盐净水剂
由硫铁矿烧渣w%─pH值变化线图3发现,生产聚铁多元盐净水剂,液体产品主料选定Fe2O3≥7.2%,pH值选定在1.4,计算碱化度B=28%。碱化剂由原料(硫铁矿烧渣)辅料(白云石)共同提供弱碱金属(铁除外)氧化物总含量≥2.8%,重金属含量应符合GB 14591—2006标准。净水剂效果值=1.4/1.8=78%[5]。
