紫芝子实体活性多糖的纯化和结构解析
2019-03-14应一君刘艳芳张劲松唐庆九颜梦秋
应一君,刘艳芳,张劲松,唐庆九,杨 焱,周 帅, 颜梦秋,张 忠,韩 伟*
(1.华东理工大学 药学院,上海 200237;2.国家食用菌工程技术研究中心/农业部应用真菌资源与利用重点开放实验室/上海市农业科学院食用菌研究所,上海 201403)
紫芝多糖在抗肿瘤[1-3]、抗氧化[4]、抗运动性疲劳和抗组织损伤[5]、免疫调节[6-8]和抗炎镇痛[9]等方面都有着显著作用。目前,已经从紫芝子实体和菌丝体中纯化出20多种多糖类物质[10-12],其中大部分组分相对分子质量均在10万以下。研究人员从紫芝子实体中还分离得到相对分子质量为1.86×106的糖蛋白 (编号为GSP-6B)和相对分子质量为8.3×105的杂多糖(编号为GSP-4)。其中GSP-6B以β-1,6-葡萄糖残基为主链,以β-1,3-和β-1,4-葡萄糖残基为支链,蛋白质约占质量分数10.13%,具有激活树突状细胞的免疫活性;GSP-4以葡萄糖残基为主链,以半乳糖和甘露糖残基为支链,连接方式较复杂[6-7]。作者以紫芝子实体为材料,以活性实验为指导,对其进行分离纯化得到均一多糖,并进行结构解析,为紫芝多糖结构和活性关系的研究提供一定的依据。
1 材料与方法
1.1 材料与试剂
紫芝子实体(编号为305):浙江龙泉基地提供;9 种单糖标准品(Gal、Man、Ara、Glc、Rha、Fuc、Xyl):Sigma 公司产品;葡聚糖(Pullulan-50):Shodex 公司产品;细菌脂多糖(LPS)、植物凝集素(PHA):Sigma公司产品;青霉素和链霉素:Amresco公司产品;RPMI1640培养基、DMEM培养基、胎牛血清(FBS)、0.25%胰蛋白酶、磷酸缓冲盐溶液(PBS):Gibco公司产品。
1.2 仪器
高效液相色谱仪 (2695型)、示差折光检测器(2414型):Waters公司产品;八角度激光光散射仪:Wyatt公司产品;台式高速大容量离心机:Eppendorf公司产品;粘度检测器:Wyatt公司产品;高效离子色谱仪(ICS-2500型):Dionex公司产品;微型漩涡混匀仪(XW-80A):Kylin-bell公司产品;傅里叶红外光谱仪:Thermo Fisher公司产品;气相色谱-质谱联用仪:Agilent公司产品;DD2 600 MHz液体宽腔核磁仪:Agilent公司产品。
1.3 方法
1.3.1 多糖的提取和分离纯化 精密称取1 kg紫芝子实体粉末,加入蒸馏水,使料液体积质量比为20 mL/g,沸水浴提取2 h,将提取液在10 000 r/min条件下离心30 min。取离心残渣,按上述提取方法提取1 h后,过滤离心,合并两次提取液,真空减压浓缩至1 L,加入无水乙醇使醇浓度达到30%,4℃静置 12 h,12 000 r/min离心收集沉淀 (命名为GS30),沉淀用体积分数30%乙醇洗涤2次后,离心,沉淀加水溶解,80℃水浴挥去乙醇后冷冻干燥。
精密称取醇沉干燥物50 mg溶于10 mL蒸馏水中,12 000 r/min离心15 min,弃沉淀。将上清液过DEAE-Sepharose离子柱层析进行分析。洗脱溶剂为蒸馏水和2 mol/L NaCl,进行梯度洗脱,流量为10 mL/min,每管收集5mL,逐管苯酚-硫酸法检测。根据糖趋势曲线分别收集水相2个组分 (命名为GS30W1、GS30W2)和盐相 3个组分 (命名为GS30S1、GS30S2、GS30S3),减压浓缩,透析,冷冻干燥。取GS30S1粗多糖干燥物配成2 mg/mL,加入无水乙醇使醇体积分数达到20%,4℃静置12 h,12 000 r/min离心分别收集沉淀和溶液。沉淀用体积分数20%乙醇洗涤2次后,离心,沉淀加水溶解,80℃水浴挥去乙醇后冷冻干燥 (命名为GS30S1-20E)。上清液减压浓缩,冷冻干燥(命名为GS30S1-20S)。
1.3.2 各组分对刺激RAW264.7细胞释放NO活性的影响 RAW264.7细胞株用含有质量分数1%青链霉素混合液和10%胎牛血清的DMEM培养液培养,培养条件为:CO2体积分数5%,37℃,湿度95%。取对数生长期的RAW264.7细胞,调节密度为106个/mL,以每孔180 μL接种于96孔板,培养5 h,分别以PBS和LPS(6 μg/mL)为阴性对照和阳性对照,加样量为20 μL,以多糖样品液为实验组(使终浓度分别为 50,200,500 μg/mL),在培养箱(37 ℃、体积分数 5%CO2)中培养 3 d。取上清液 100 μL,加入50 μL Griess试剂,10 min后测定543 nm处的吸光度,计算培养基中NO的生成量。
1.3.3 多糖纯度鉴定及相对分子质量分析 采用苯酚-硫酸法测定GS30S1-20E样品中的多糖质量分数。
称取5 mg粗多糖样品,加入1 mL流动相充分溶解,离心,上清液用0.25 μm的水相微孔膜过滤后取100 μL进样分析。采用高效凝胶尺寸排阻色谱-多角度激光光散射-示差折光检测仪联用分析技术(HPSEC-MALLS-RI)对 GS30S1-20E 相对分子质量进行分析。色谱柱为:G6000PWXL和G4000PWXL(7.8 mm×300 mm,TOSOH,日本)连用。流动相:pH=7且含有质量分数0.02%叠氮钠的0.15 mol/L NaNO3和0.05 mol/L NaH2PO4缓冲液。以35℃的温度和0.5 mL/min流速进行洗脱分析,其它条件参考文献[13]。
1.3.4 单糖组成分析 称取2~3 mg GS30S1-20E,加入3 mL浓度为2 mol/L的TFA,在110℃下水解3 h后,加入3 mL甲醇吹干,洗涤4次以上至无酸味。加入超纯水溶解,定容至50 mL。色谱条件参照文献[14]。
1.3.5 甲基化分析 按照方法,精密称取样品2 mg于V-型样品瓶,进行甲基化,水解及还原和乙酰化后,进行GC-MS分析,色谱条件为:色谱柱为HP-5MS 型石英毛细管柱,30 m×250 μm×0.25 μm。载气为氦气,恒流模式进样。进样口温度250℃,流量为1 mL/min。升温程序:柱初始温度160℃,2℃/min升至210℃,然后5℃/min升至240℃,一共需要7 min。传输线温度280℃,不分流模式进样,进样量为2 μL。四级杆温度150℃,离子源温度230℃。
1.3.6 核磁共振分析 称取30 mg GS30S1-20E多糖样品,加入2.0 mL的D2O,充分溶解,冷冻干燥,重复此步骤3次,最后用1.0 mL D2O和氘代DMSO的混合溶剂(体积比为1∶10)溶解样品,进行一维氢谱(1H-NMR)、碳谱(13C-NMR)分析。
2 结果与分析
2.1 紫芝多糖的柱层析分离及活性比较
紫芝子实体热水提取物经体积分数30%乙醇沉淀后所得粗多糖GS30的多糖质量分数为41.20%,为了进一步对该组分进行纯化,将其溶解后经DEAE-Sepharose Fast Flow阴离子柱洗脱分离,收集得到5个组分(图1),分别为水洗脱部分GS30W1 和 GS30W2,NaCl洗脱部分 GS30S1、GS30S2和GS30S3,各组分多糖含量均有所提高,其中GS30S1的多糖质量分数达到86%,证明经过离子柱层析分离,有效富集了多糖组分。
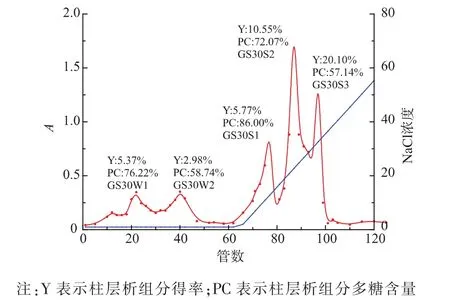
图1 GS30多糖DEAE-Sepharose Fast Flow离子柱层析分离曲线Fig.1 Elution curve of GS30 by DEAE-Sepharose Fast Flow Column chromatography
体外刺激巨噬细胞释放NO的活性结果显示(图2),与乙醇沉淀所得粗多糖GS30相比,经离子柱分离所得的3个盐相组分活性均有提高,水相的两个组分活性降低。经检测发现,GS30S1组分的分子量较大,为了解析该多糖的结构特征,对其进行了进一步纯化。

图2 GS30柱层析5个组分刺激RAW264.7产生NO的结果Fig.2 Results of five fractions of GS30 after the column chromatography on NO release from RAW264.7 cells
2.2 紫芝多糖的纯化及相对分子质量特征和活性分析
参考文献[15]所述,以体积分数20%乙醇沉淀法对大分子量的多糖组分GS30S1进行纯化,得到沉淀GS30S1-20E和上清GS30S1-20S,活性比较结果(图3)显示,沉淀GS30S1-20E活性远高于上清部分,表明通过该方法有效的保留了多糖的有效成分。

图3 体积分数20%醇沉各部分刺激RAW264.7产生NO的结果Fig.3 Results of polysaccharide fractions by 20%ethanolprecipitation on NO release from RAW264.7 cells
GS30S1-20E多糖质量分数为96.63%且其水溶液在260 nm和280 nm处均无紫外吸收峰,说明该组分不含有核酸和蛋白质。经HPAEC测定表明该多糖只含葡萄糖一种单糖,因此判定GS30S1-20E为一种葡聚糖。
HPSEC-MALLS-RI法分析其相对分子质量特征,结果如图4所示,示差检测器(RI)信号峰为单一对称峰,表明该多糖为均一组分,Astra软件计算其重均相对分子质量为2.418×106,数均相对分子质量为1.668×106,多分散指数为1.450,特性粘度为927.49 mL/g。

图4 GS30S1-20E液相图谱Fig.4 The HPSEC spectrum of GS30S1-20E
2.3 傅里叶红外光谱分析结果
GS30S1-20E红外光谱图谱如图5所示,在3 328 cm-1处有一个较宽且强的吸收峰,该吸收峰为多糖分子内-OH的伸缩振动峰;在2 924 cm-1处有一个较弱的吸收峰,为多糖的C-H伸缩振动峰,以上两个吸收峰为多糖的特征吸收峰,表明该样品为多糖。在1 640 cm-1的吸收峰,是C-O的伸缩振动峰,在1 369 cm-1处的吸收峰是C-H键的变角振动峰;在1 200~1 000 cm-1之间的吸收峰,表明该多糖属于吡喃型多糖;在889 cm-1处是β-构型的特征吸收峰,表明该多糖为β-葡聚糖。

图5 紫芝多糖GS30S1-20E红外图谱Fig.5 Infrared spectrogram of polysaccharide fraction GS30S1-20E from Ganoderma sinense
2.4 紫芝子实体多糖GS30S1-20E甲基化分析结果
GS30S1-20E通过甲基化后,经GC-MS分析,如图6和表1所示,GS30S1-20E主要包含末端连接、1,3-连接、1,3,6-连接的葡萄糖残基,且摩尔比为 1.00∶2.32∶1.01。 表明此多糖是以 1,3-连接为主链,以1,6-连接为支链。

图6 GS30S1-20E的GC-MS图谱Fig.6 GC-MS spectrum of GS30S1-20E

表1 紫芝多糖GS30S1-20E的甲基化分析结果Table 1 Result of methylation of GS30S1-20E
2.5 GS30S1-20E的核磁共振分析结果
为了进一步验证其结构,对GS30S1-20E多糖进行了核磁共振分析。从1H-NMR谱图(图7)可以看出,异头氢区域有4个共振峰信号,分别在δ4.76×10-6(3 个 H 重叠)、δ 4.46×10-6处出现,表明GS30S1-20E为β构型葡聚糖。
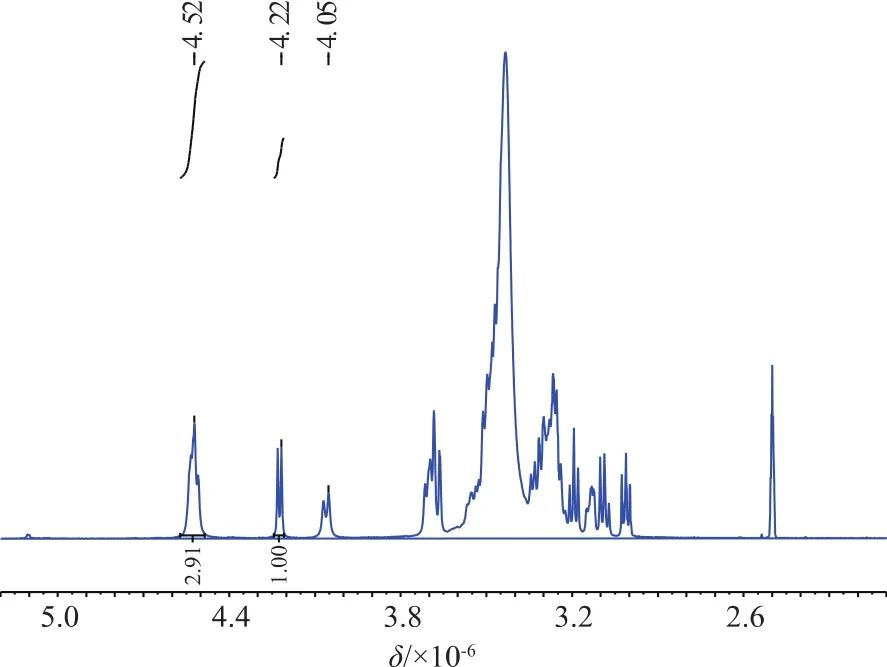
图7 紫芝多糖GS30S1-20E的1H-NMR谱图Fig.7 1H-NMR spectra ofpolysaccharide fraction GS30S1-20E from Ganoderma sinense
从13C-NMR谱图(图8)可以看出,异头碳区域的共振信号峰出现在 δ 102.89×10-6和 δ 102.79×10-6处,表明GS30S1-20E为β构型,与红外光谱结果和氢谱一致。经与文献[16]比对,图谱中δ 75×10-6、δ 76.2×10-6、δ 72.7×10-6、δ 68.3×10-6和 δ 60.8×10-6处的信号峰依次归属于未被取代的C3、C5、C2、C4和 C6,δ 85.9×10-6和 δ 70×10-6分别归属于被取代的C3和C6。该结果进一步证明该多糖是以β-(1,3)-糖苷键为主链和 β-(1,6)-糖苷键为支链的葡聚糖。

图8 紫芝多糖GS30S1-20E的13C-NMR谱图Fig.8 13C-NMR spectraofpolysaccharidefraction GS30S1-20E from Ganoderma sinense
3 结 语
以RAW264.7细胞释放NO免疫活性实验为指导,通过多次乙醇沉淀和DEAE阴离子交换柱层析的方法从紫芝子实体中分离得到均一多糖,该多糖重均相对分子质量为 1.825×106, 以 β-(1,3)-糖苷键为主链和β-(1,6)-糖苷键为支链,主链与支链上糖残基的摩尔比为3:1。目前研究表明,紫芝子实体多糖以杂多糖为主,主要的单糖有葡萄糖、半乳糖、甘露糖和岩藻糖。Lan-Zhen Meng等[17]分离得到的GSPS由葡萄糖、甘露糖、半乳糖和岩藻糖组成,Gao等[11]通过超滤方法分离得到的GS-6b包含有岩藻糖、阿拉伯糖、木糖、甘露糖、半乳糖和葡萄糖组成,作者从紫芝子实体中分离得到的大分子β-葡聚糖,为首次从紫芝子实体中分离得到。
体外活性实验显示该多糖能够显著刺激RAW264.7细胞释放NO,随着多糖质量分数的增加,其NO释放量也逐渐增加,呈现质量分数依赖性。NO是一种具有广泛生物活性的细胞信号因子,它可参与神经、免疫等调节作用[18]。Murata等[19]研究表明β-葡聚糖可通过刺激巨噬细胞产生IL-12、IL-10、IL-6和PGE2来调节细胞免疫反应。据报道β-葡聚糖广泛地分布于真菌、细菌和植物体内,并且真菌β-葡聚糖是公认的活性成分之一[20],具有多种生物活性,包括免疫调节[21]、抗肿瘤[22]、抗氧化[23]等,作者分离得到的β-葡聚糖表现出较好的免疫活性,其免疫机制有待进一步的研究。
