萘醌衍生物抗血管平滑肌细胞增殖的活性研究
2019-03-13张伟云王晓禹王丽荣许长江温忠秀
张伟云,王晓禹,王丽荣,许长江,温忠秀
(厦门医学院药学系,福建省中药精加工与健康产品开发重点研究室,福建 厦门 361023)
血小板衍生生长因子(platelet-derived growth factor,PDGF)由激活的巨噬细胞、血管平滑肌细胞(vascular smooth muscle cells,VSMCs)和内皮细胞产生,形成3个亚型(AA、AB、BB),在各种血管疾病的发病和发展中起着重要作用[1-2]。PDGF-BB引起VSMCs过度增殖是动脉粥样硬化和相关血管疾病的标志[3]。因此,抑制PDGF-BB诱导的VSMCs增殖是预防和治疗血管疾病的重要策略。PDGF-BB与PDGF受体结合,激活PI3K/Akt、磷脂酶Cγ1(phospholipase Cγ1,PLCγ1)和细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)信号转导途径[1]。因此,抗增殖作用可能通过调控PI3K/Akt、PLCγ1、ERK1/2信号通路而实现。VSMCs增殖是由细胞周期控制的,细胞周期包括处于休止期(G0)和细胞生长间期即DNA合成前期(G1期)、DNA合成期(S期)、DNA合成后期(G2期)、细胞分裂期(M期)[2]。
紫草醌是从中药紫草中提取的一种萘醌类化合物,对大鼠VSMCs有抗增殖活性,研究者报道了紫草醌抑制TNF-α诱导的大鼠VSMCs生长[4]。一些萘醌类衍生物具有抗增殖活性。2-氯-3-(4-苯基)-氨基1,4-萘醌抑制了胎牛血清诱导的大鼠主动脉VSMCs增殖。2-氯-3-[4-(乙基羧基)-苯基)]-氨基-1,4-萘醌抑制了PDGF-BB刺激的大鼠主动脉VSMCs DNA合成,并通过抑制PDGFβ受体(PDGFRβ)的活性而抑制细胞周期进程[3]。
在本研究中,我们实验室合成的一系列萘醌衍生物中的2-壬基硫酰-5,8-二甲氧基-1,4-萘醌(2-nonylsulfinyl-5,8-dimethoxy-1,4-naphthoquinone, 2-nonylsulfinyl-DMNQ,结构见Fig 1),表现出抑制由PDGF-BB刺激的大鼠主动脉VSMCs增殖的活性。为了研究萘醌类化合物潜在的抗VSMCs增殖的作用机制,本课题对PDGF-BB介导的相关信号通路如ERK1/2、Akt、PLCγ1、PDGFβ受体,以及细胞周期进程和细胞周期调控蛋白进行了研究。

Fig 1 Chemical structure of 2-nonylsulfinyl-5,8-dimethoxy-1,4-naphthoquinone(2-nonylsulfinyl-DMNQ)
1 材料
1.1药物与试剂2-nonylsulfinyl-DMNQ,由本实验室合成,纯度>98%。PDGF-BB购自Upstate Biotechnology公司;抗体GAPDH、p-Akt1/2/3(Ser 473)-R、Akt,购自Santa Cruz生物技术公司;抗体p-PDGFRβ(Tyr751)、p-p44/42 MAPK(ERK1/2) (Thr202/Tyr204)、p-PLCγ1(Tyr783)、PDGFRβ、p44/42 MAPK(ERK1/2)、PLCγ1,均购自Cell Signaling Technology公司;Akt抑制剂LY294002,购自Cayman Chemical 公司;PDGFRβ抑制剂AG1295、ERK抑制剂U0126、PLCγ抑制剂U73122,均购自Sigma-Aldrich公司;Premix WST-1细胞增殖测试试剂盒,购自TaKaRa公司;其他化学试剂均为分析级。
1.2细胞株大鼠主动脉血管平滑肌细胞A10,型号FS-1629,购自美国菌种保存中心(American Type Culture Collection,ATCC)。
1.3仪器IFS-110-8型CO2恒温培养箱(新加坡Esco Micro Pte有限公司);Multiskan Go型全波长酶标仪(美国赛默飞世尔科技有限公司);LS3801型液体闪烁计数器(德国Beckman Düsseldorf公司);FACS Calibur型流式细胞仪(美国Becton Dickinson公司);ChemiDoc XRS凝胶成像系统(美国Bio-Rad公司)。
2 方法
2.1细胞培养A10细胞用含10%胎牛血清(FBS)的DMEM培养基,在37 ℃、5% CO2培养箱中培养,第5~9代的细胞用于实验。
2.2细胞增殖实验采用非放射性比色法WST-1和细胞计数法,测定了2-nonylsulfinyl-DMNQ对A10细胞的抗增殖作用。以2.5×107·L-1的浓度将A10细胞接种于96孔培养板,并在含10% FBS的DMEM培养液中培养24 h。接着用无血清的DMEM培养液培养24 h后,再分别用含0.1、0.5、1 μmol·L-12-nonylsulfinyl-DMNQ的无血清DMEM培养液处理24 h, 再加入25 μg·L-1的PDGF-BB 培养22 h,最后加入WST-1培养2 h后,于450 nm波长下测定细胞光密度。
进一步用细胞计数实验证明2-nonylsulfinyl-DMNQ的抗增殖作用。以5×107·L-1的浓度将A10细胞接种于6孔培养板,并在含10% FBS的DMEM培养液中培养24 h,再用无血清DMEM培养液培养24 h,接着分别用0.1、0.5、1 μmol·L-1的2-nonylsulfinyl-DMNQ处理24 h后,用25 μg·L-1的PDGF-BB处理24 h。最后,细胞用胰蛋白酶-EDTA消化,置于显微镜下,使用血细胞计数器计数细胞个数。


为排除假阳性,使用WTS-1试剂盒测试2-nonylsulfinyl-DMNQ对A10细胞的细胞毒性, 洋地黄毒苷(25 μmol·L-1)作为对照药物。A10细胞在无血清DMEM培养液中培养24 h后,分别加1 μmol·L-12-nonylsulfinyl-DMNQ处理0、3、6、12、24、48 h,而后细胞加入WST-1培养2 h,于450 nm波长下测定和记录相应的光密度值。
2.3[3H]胸腺嘧啶核苷参入实验参照文献方法[5],利用[3H]胸腺嘧啶核苷参入法测定2-nonylsulfinyl-DMNQ对DNA合成的作用。A10细胞用25 μg·L-1的PDGF-BB处理20 h后,再用1 mCi·L-1[3H]胸腺嘧啶核苷处理4 h。使用液体闪烁计数器来量化[3H]胸腺嘧啶核苷的参入量。
2.4细胞周期进程分析按照文献描述方法[5]确定细胞周期。用0.1、0.5、1 μmol·L-1的2-nonylsulfinyl-DMNQ处理A10细胞24 h,再用25 μg·L-1的PDGF-BB刺激24 h后收集、清洗细胞,然后用70%乙醇于4 ℃固定30 min。再将细胞混匀后离心,弃去上清液,在室温下将细胞放置于300 μL的碘化丙锭溶液(50 mg·L-1碘化丙锭的样品缓冲液中含有100 mg·L-1核糖核酸酶A)15 min。每个细胞核的碘化丙锭-DNA复合体用流式细胞仪测量。通过程序Modfit LT分析确定细胞周期G0/G1、S和G2/M阶段的比例。
2.5免疫印迹分析参照文献方法[5]进行免疫印迹分析。将A10细胞以5×107·L-1的浓度接种于6孔培养板,用含10% FBS的DMEM培养24 h,再用无血清的DMEM培养24 h,接着分别用2-nonylsulfinyl-DMNQ(0.1、0.5、1 μmol·L-1)、10 μmol· L-1ERK1/2抑制剂U0126[6]、10 μmol·L-1PI3K抑制剂LY294002[7]、20 μmol·L-1PLCγ抑制剂U73122[8]、20 μmol·L-1PDGFRβ抑制剂AG1295[9]处理24 h。用25 μg·L-1的PDGF-BB刺激A10细胞15 min后,检测ERK1/2、Akt、PLCγ1和PDGFRβ的磷酸化水平。蛋白样品用SDS-PAGE分离,分别使用相应的抗体进行免疫印迹分析,使用ChemiDoc XRS成像系统和Bio-Rad的MultiAnalist软件对免疫印迹分析中的条带进行密度可视化和测量。

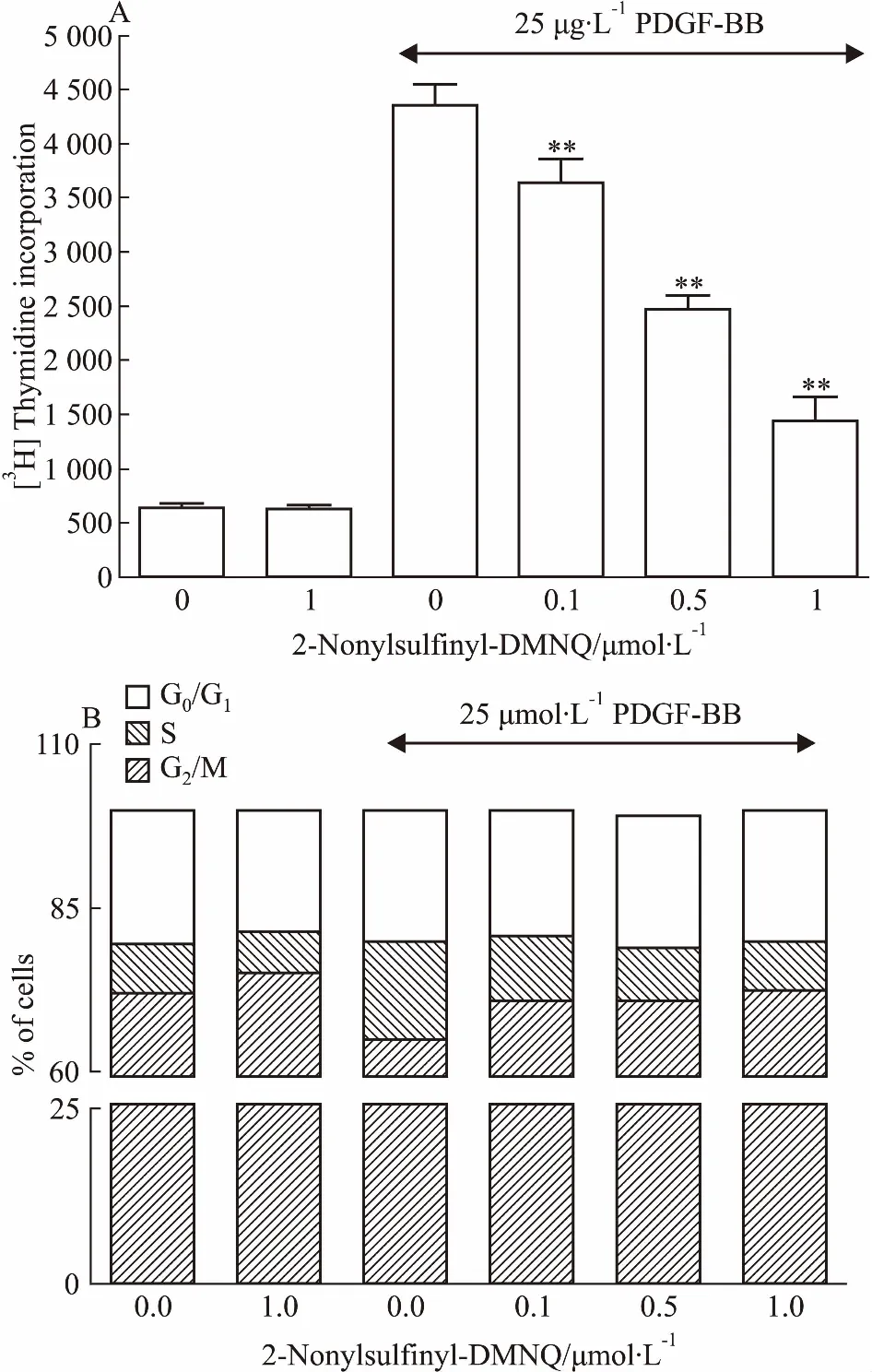
Fig 3 Effect of 2-nonylsulfinyl-DMNQ
A:[3H]thymidine incorporation.[3H]thymidine uptake into DNA of A10 cells was quantified using a liquid scintillation counter; B: Cell cycle progression. The individual nuclear DNA content was reflected by fluorescence intensity of incorporated PI. Each item was derived from a representative experiment, where data from at least 10, 000 events were obtained.**P<0.01vsPDGF-BB group.
3 结果
3.12-nonylsulfinyl-DMNQ对A10细胞增殖的影响如Fig 2A所示,与无血清培养液对照组相比,经过25 μg·L-1的PDGF-BB刺激后的A10细胞生长明显加快,2-nonylsulfinyl-DMNQ以浓度依赖的方式抑制PDGF-BB引起的A10细胞增殖。Fig 2B细胞计数实验结果显示,与无刺激组(5.7×107·L-1)相比,25 μg·L-1PDGF-BB处理组(12.4×107·L-1)细胞的数量明显增加;经2-nonylsulfinyl-DMNQ(0.1、0.5、1 μmol·L-1)处理,细胞明显减少至8.4×107·L-1、7.5×107·L-1、6.9×107·L-1。

Fig 4 Effect of 2-nonylsulfinyl-DMNQ on PDGF-BB stimulated phosphorylation of ERK1/2(A), Akt(B), PLCγ1(C) and
**P<0.01vsPDGF-BB group
图2C结果显示,细胞经过1 μmol·L-12-nonylsulfinyl-DMNQ处理48 h后,并未出现任何细胞毒性,提示2-nonylsulfinyl-DMNQ抗细胞增殖的作用不是由于细胞毒性。
3.22-nonylsulfinyl-DMNQ对[3H]胸腺嘧啶核苷参入的影响PDGF-BB引起[3H]胸腺嘧啶核苷参入由641 cpm/孔增加到4 358 cpm/孔。经过2-nonylsulfinyl-DMNQ(0.1、0.5、1 μmol·L-1)处理,明显抑制了PDGF-BB引起的[3H]胸腺嘧啶核苷进入DNA, 抑制率分别是16.6%、43.3%、66.9%(Fig 3A)。
3.32-nonylsulfinyl-DMNQ对细胞周期进程的作用通过细胞周期的分布(Fig 3B)可以看出,PDGF-BB引起S期细胞的比例由7.4%增加到14.9%。2-nonylsulfinyl-DMNQ处理能阻止细胞周期进程,减少处于S期细胞的百分比,其抗细胞增殖作用与增加处于G0/G1的细胞有关。
3.42-nonylsulfinyl-DMNQ对PDGF-BB引起的Akt、PLCγ1、PDGFRβ磷酸化的作用Fig 4结果显示,PDGF刺激的ERK1/2磷酸化水平被10 μmol·L-1ERK抑制剂U0126降低到PDGF-BB诱导的对照组的39.1%;用2-nonylsulfinyl-DMNQ(0.5、1 μmol·L-1)处理后,ERK1/2磷酸化水平分别降低到74.3%和51.6%。1 μmol·L-12-nonylsulfinyl-DMNQ和10 μmol·L-1PI3K抑制剂 LY294002处理细胞后, 均明显抑制了由PDGF-BB引起的Akt磷酸化。20 μmol·L-1PLCγ1抑制剂U73122明显降低由PDGF-BB介导的PLCγ1磷酸化水平,降低至PDGF-BB刺激对照组的3.3%;2-nonylsulfinyl-DMNQ在0.1~1 μmol·L-1浓度范围内,明显降低了PLCγ1磷酸化水平。20 μmol·L-1PDGFRβ抑制剂AG1295处理后,PDGF-BB刺激的PDGFRβ磷酸化水平被明显抑制到PDGF-BB刺激对照组的14.7%;2-nonylsulfinyl-DMNQ(0.5、1 μmol·L-1)均能明显抑制PDGFRβ磷酸化水平。
4 讨论
动脉壁中VSMCs的过度增殖是血管疾病的重要病理因素[10]。因此,抑制VSMCs增殖是针对这类疾病的重要治疗策略之一[11]。本研究结果显示,2-nonylsulfinyl-DMNQ明显抑制PDGF-BB引起的VSMCs增殖、DNA合成,其抗增殖作用与G0/G1期抑制有关。
PDGF-BB与PDGF受体结合,导致PDGFRβ酪氨酸残基磷酸化,刺激PI3K/Akt、ERK1/2和PLCγ1的激活[1,3]。PDGF、Akt、ERK1/2和PLCγ1的磷酸化水平降低可能会抑制PDGF-BB刺激的VSMCs增殖。ERK1/2是细胞生长早期细胞内的有丝分裂信号转导的重要参与者,并且与PDGF-BB诱导的各种细胞类型的增殖有关。Akt是另一个与PDGF-BB介导的增殖有关的下游信号。本实验结果表明,2-nonylsulfinyl-DMNQ以浓度依赖性的方式抑制PDGF-BB刺激的ERK1/2、Akt、PLCγ1、PDGFRβ的磷酸化,提示其抗增殖作用可能通过抑制上述信号分子的磷酸化来调节。
综上所述,2-nonylsulfinyl-DMNQ通过抑制ERK、Akt、PLCγ1和PDGFRβ路径,通过在G0/G1期阻滞细胞周期进入S期,从而减少了DNA合成,最终抑制了PDGF-BB诱导的VSMCs增殖。因此,2-nonylsulfinyl-DMNQ可能具有通过抑制VSMCs增殖来预防和治疗动脉粥样硬化的潜力。深入探索2-nonylsulfinyl-DMNQ抑制VSMCs增殖的作用机制,将为该化合物在防治动脉粥样硬化的应用提供实验依据。
