多巴胺能神经传输在吗啡成瘾与应激性抑郁中的作用机制
2019-03-13杨晓艳
杨晓艳,白 洁
(昆明理工大学医学院,云南 昆明 650500)
中脑多巴胺(dopamine, DA)能奖赏回路在调节抑郁和压力应激方面起着关键作用, 腹侧被盖区(ventral tegmental area,VTA)的DA能神经元,对慢性不可预知轻度压力所引起的小鼠抑郁样和损害性行为的输出具有特异性调节作用。研究表明,吗啡成瘾还能够增加大脑对压力和负面情绪的敏感性,通常导致焦虑、抑郁和认知功能障碍[1],应激性抑郁症(stress depression,SD)是与吗啡成瘾相关的最常见的神经精神合并症之一,通过治疗戒断症状可以缓解抑郁症,同时也能进一步改善成瘾的戒断症状。因此,本文对DA能神经传输在吗啡成瘾和SD中的作用机制进行综述。
吗啡是从罂粟中提取的一种生物碱,其进入人体后与中枢神经系统(central nervous system, CNS)特异性受体相结合,经过受体后信号传导,引发一系列级联反应。吗啡成瘾包括躯体依赖和精神依赖,精神依赖是吗啡等成瘾药物作用于机体后,产生奖赏效应[2],其作用机制见Fig 1,吗啡作用于VTA中γ-氨基丁酸(γ-aminobutyric acid, GABA)神经元上的μ受体,与μ受体结合后抑制GABA神经元,从而解除其对DA能神经元的抑制,进而促进VTA到伏隔核(nucleus accumbens, NAc)区的DA释放,并与DA受体相结合,最终引发奖赏效应。

Fig 1 Morphine reward circuit
SD是指当存在强烈、持久、不可控制的应激刺激时,会引起机体的不适反应,不适反应不断累积则诱发抑郁。长期慢性吗啡作用,会诱发机体产生应激性反应,且慢性应激引起抑郁症和情感性精神障碍。应激导致抑郁发生的过程和机制比较复杂,与脑内DA能奖赏回路[3]、调节情绪和与认知功能相关的下丘脑-垂体-肾上腺轴(hypothalamic pituitary adrenal axis, HPA)、五羟色胺(5-hydroxy tryptamine, 5-HT)系统以及海马神经元损伤和再生障碍密切相关,慢性应激能够增加神经系统对外界伤害性刺激的敏感性,降低对应激反应的能力,加重神经系统的损伤。
1 DA系统在吗啡成瘾与SD中的作用机制
DA主要来源于黑质(substantia nigra, SN)和中脑VTA,DA受体分为1-5(dopamine receptor 1-5, D1-D5),它是儿茶酚胺和苯乙胺家族的有机化合物,在脑和肾中合成前体分子左旋多巴胺(L-dopamine, L-DOPA),去除羧基后生成DA,是产生欣快感的重要神经递质,与奖赏和情绪控制有关[4]。研究证明,VTA中DA能神经元可以投射到伏隔核(nucleus accumbens, NAc)、前额叶皮层(medial prefrontal cortex, mPFC)、杏仁核(amygdala, Amy)、海马(hippocampus, Hip)以及纹状体(striatum, ST)[5]。这些脑区在奖赏、厌恶、应激和情绪控制方面都发挥重要作用(Fig 2)[6]。吗啡能增加中脑的DA能神经活性,这种信号起源于VTA,并向其他脑区传输,与药物依赖和抑郁的产生有关。综上所述,DA系统参与吗啡奖赏和情绪相关的调控,它是成瘾和抑郁神经回路中的关键环节。
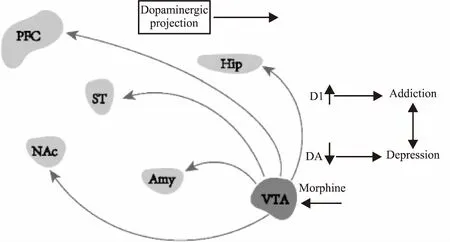
Fig 2 Role of DA neurotransmission from VTA to differentregions of brain in morphine addiction and stress depression
大量研究报道,抑郁症与脑内奖赏系统和学习记忆系统的降低有关,但其对药物成瘾的影响不完全一致。推测抑郁的人或动物对吗啡等致瘾药物的敏感性可能降低,可能与抑郁症的DA等递质的水平低下有关。然而,事实上却相反,其机制也不清楚,因此,探讨他们之间相关性及其神经生物学机制具有重要意义。
2 VTA到不同脑区的DA能神经传输在吗啡成瘾和SD中的作用机制
2.1VTA到NAc的DA能神经传输NAc是中脑边缘DA系统的投射脑区之一,在药物奖赏和SD中发挥重要作用。来自微透析研究的证据表明,在SD期间,VTA到NAc的DA能神经活动降低,从而拮抗DA能传输,削弱吗啡的奖赏效应[7],因此,在抑郁期间,VTA到NAc中的DA能传输减少可能导致药物奖赏效应的损伤。急性应激能够抑制吗啡诱导的条件性位置偏好(conditioned place preference, CPP);相反,慢性应激由于NAc中的环磷酸腺苷反应元件结合蛋白(cyclic adenosine monophosphate response element-binding,CREB)增加,会减缓急性应激所致的吗啡诱导的CPP抑制[8]。在NAc中,通过DA能神经激动剂SKF81297使DA能神经传输激活,也抑制吗啡诱导的CPP消退[9]。
酪氨酸羟化酶(tyrosine hydroxylase, TH)是DA生物合成中的关键酶,参与吗啡戒断过程中诱发的抑郁和焦虑等精神病理状态。慢性吗啡作用,使NAc中的TH表达水平上调,而当TH甲基化或活性降低,则诱发SD[10]。因此,从TH的变化水平看,吗啡诱导TH表达水平上调,同时使DA的生物合成增加,从而可以缓解因TH减少而诱发的SD[11]。也有报道指出,VTA内注射吗啡(25.5 ng/0.15 μL)缓解了抑郁样行为。但研究也表明,成瘾加重抑郁症状, 并没有对抑郁有治疗效果,因为慢性吗啡作用,特别在强制戒断期间会诱发焦虑、烦躁、抑郁等负性情绪[12]。还有研究表明,大脑双侧NAc进行深部电刺激(deep brain stimulation, DBS),抑制了吗啡成瘾大鼠的觅药行为和抑郁样行为以及NAc区Δ FosB的表达。
遗传病学研究也表明,DA系统与精神类疾病在遗传学上产生的遗传连锁参与了吗啡成瘾和SD。VTA中的DA依赖性基因如多巴胺受体1(D1)、D2和儿茶酚-O-甲基转移酶(catechol-O-methyltransferase, COMT)基因,都与应激性抑郁和药物滥用有关[13]。当这些基因表达发生改变时,可能导致中脑边缘DA能奖赏回路功能障碍,包括NAc中DA能突触功能的改变,这种改变可导致抑郁行为以及吗啡奖赏效应的明显降低[3]。
2.2VTA到mPFC的DA能神经传输mPFC是与记忆、注意力和执行功能相关的脑区。研究表明,VTA到mPFC发送DA能投射,其涉及吗啡奖励及情绪的处理。例如,在VTA内注射阿片受体(opioid receptor, MOR)激动剂,增加了前额叶皮质中的DA水平,相反,mPFC中DA水平降低会使大鼠中阿片类物质激动剂诱导的CPP受损[14]。同时,mPFC中的大麻素受体-1(cannabinoid receptor 1, CB1)可以通过GABA信号传导来调节VTA中DA能神经传输[15],从而调节大鼠情绪、记忆以及和吗啡相关的奖励和厌恶的平衡[16]。这些研究均表明,VTA到mPFC的DA能神经传输,在吗啡成瘾以及吗啡成瘾诱导的情绪处理中发挥关键作用。
HPA轴影响VTA到mPFC的DA能神经传输,进而影响吗啡成瘾和SD。在吗啡成瘾和SD中,通过影响糖皮质激素(glucocorticoid, GCS)的分泌,使HPA轴负反馈调节损伤,从而使前额叶皮质的DA能神经传输发生适应性改变,使DA释放减少,从而造成吗啡奖赏效应的损伤和抑郁的加重[17]。有报道表明,神经肽FF(neuropeptide FF, NPFF)属于 RFamide家族,被称为吗啡调节肽,通过神经肽FF受体1(neuropeptide FF receptor 1, NPFFR1)和NPFFR2来调节下丘脑的功能。HPA轴通过增加GCS的水平,从而调节情绪反应,进而参与生理应激反应的调节。激活HPA轴会引起焦虑或抑郁行为。研究也表明,HPA轴功能下降与5-HT等中枢神经递质的机能紊乱密切相关,在吗啡成瘾与SD中,5-HT转运蛋白基因SLC6A4甲基化或其他异常,从而使HPA轴功能紊乱,进而影响吗啡成瘾与SD[18]。
2.3VTA到Hip的DA能神经传输Hip是参与学习、记忆以及情绪控制的脑区,VTA到Hip的DA能回路与吗啡诱导的CPP的形成有关。使用D1或D2受体拮抗剂可以抑制VTA到Hip的DA能神经传输,从而抑制吗啡所诱导的大鼠CPP[19]。研究报道,抑郁症患者Hip体积减小,吗啡诱发奖赏效应形成受损。慢性吗啡作用,大鼠Hip中DNA甲基转移酶(DNA methyltransferases, DNMTs)表达增加,并在糖皮质激素受体17(glucocorticoid receptor,GR17)启动子处结合,引起GR17启动子的超甲基化,最后导致糖皮质激素受体的蛋白和GR17 mRNA的表达下调,从而参与慢性吗啡诱导下HPA轴的功能障碍,进而对吗啡依赖和相关情绪进行调节[29]。另有报道指出,慢性吗啡应激导致HPA轴持续性过度活跃,使体内的GCS浓度升高,造成海马的神经损伤,促使海马丧失了负反馈调节能力。失控的HPA轴持续活跃加剧海马区损伤,最终导致情感障碍或SD,体内高水平的GCS和HPA轴的亢进成为诱发抑郁症的原因之一。近来对情感障碍引起自杀的患者的研究也发现,海马及前额叶皮质的盐皮质激素受体mRNA和糖皮质激素受体mRNA下降,是一种保护性的补偿反应,防止高浓度的GCS对相应的脑区造成进一步的损伤。这些研究说明了慢性吗啡作用造成相关脑区受损,进而诱发SD。
2.4VTA到基底外侧杏仁核(basallateralamygdalanucleus,BLA)的DA能神经传输杏仁核包括BLA和中央杏仁核(central amygdaloid nucleus, CeA),杏仁核在解剖学上连接了mPFC和NAc,在调节情绪反应和学习记忆中发挥重要作用。VTA区向BLA发送DA能投射,并在BLA中诱导神经元突触可塑性的形成。吗啡成瘾和SD与杏仁核功能变化密切相关[1]。研究发现,在吗啡镇痛药物连续使用9年的人群中,与情绪调节、冲动控制、奖励和动机相关的NAc和杏仁核间的功能发生了变化。平均每天使用78 mg吗啡的患者,在用药30 d后,杏仁核中的灰质减少。这些研究表明,慢性吗啡使用后,引起与奖励和情绪控制的相关脑区的损伤,这可能是SD的基础。VTA到BLA(也包括NAc)的联结与慢性吗啡所致记忆巩固损伤有关[20],而NAc 区的α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(α-amino-3-hydroxy-5-methyl-4-isoxazole propionate receptor,AMPA)的激活与吗啡戒断所致的负性情绪有关。吗啡戒断2周,杏仁核脑区p38 MAPK磷酸化水平明显升高。杏仁核给予κ阿片受体拮抗剂能够阻断吗啡戒断引起的p38磷酸化的升高,从而能够逆转吗啡戒断引起的抑郁样行为[21]。
2.5VTA到ST的DA能神经传输吗啡应激产生的神经适应性可能会破坏ST和PFC的神经回路,从而影响药物应激中情感和认知的加工过程,引起焦虑、抑郁等情绪障碍。吗啡对恒河猴脑内ST中的多巴胺转运蛋白(dopamine transporter, DAT)功能有快速和持久的影响[22]。还有实验数据显示,慢性吗啡给药后,多巴胺受体5(D5)、D2及DAT的蛋白水平增高, Dl降低,引起大鼠行为及其DA能中脑皮质边缘神经通路内DA受体、转运体及脑源性营养因子改变,最终造成SD[23]。背外侧纹状注射D1拮抗剂SCH23390、D2拮抗剂Eticlopride,大鼠吗啡自身给药和戒断后,抑制吗啡觅药行为的表达,说明背外侧纹状体DA能系统中的D1和D2受体参与调控戒断后吗啡觅药行为的表达。DA的5种受体中,D2受体主要分布于中脑边缘系统,VTA到ST的DA奖赏环路中D2受体的异常则是抑郁症发病中重要的分子机制。综合以上的研究和报道可以看出吗啡作用后,中脑VTA到ST奖赏环路D2受体异常,使纹状体D2受体功能下降,结合力降低,最终诱发SD[24]。因此,VTA到ST的DA能神经传输在调节吗啡成瘾和SD中起重要作用[25]。
3 结语
吗啡成瘾和SD精神障碍之间存在相同特点,表明他们可能共享一种或多种常见的神经生物学机制。本文通过综述DA能神经传输与吗啡成瘾与SD之间的关系,表明吗啡成瘾和SD的交互联系与DA能神经活性改变有关。吗啡虽是最常用的镇痛药,但容易产生药物依赖,吗啡或其他药物成瘾都会对大脑以及机体的其他器官产生损伤,引起并发症,SD是伴随吗啡成瘾最常见的一种病,关键原因是DA奖赏回路与调节情绪与认知功能相关的大脑神经环路有共同的通路。然而,吗啡成瘾和SD的神经环路也存在差异,中脑边缘系统与药物的奖赏效应相关,皮层和海马与SD等负性情绪的调控有关,有关的神经传输和分子机制还需要进一步的研究。成瘾戒断的条件下,强烈的戒断症状产生,诱发SD,而抑郁则会增强成瘾敏感性。成瘾和SD与突触可塑性相关,成瘾导致大脑神经突触的改变,可以改善抑郁症的记忆损伤,二者之间的相互作用分子机制复杂,将来通过建立吗啡成瘾应激性抑郁的动物模型,利用大脑神经环路示踪技术、电生理等手段,对特定的脑区以及脑区间神经环路进一步研究,阐明吗啡或其他药物成瘾诱发SD的分子机制,这将为治疗吗啡成瘾和SD提供新思路。