外泌体的提取方法及其在药物递送系统中的应用
2019-03-13王飘飘王会会彭代银陈卫东
王飘飘,王会会,王 雷,姚 亮,彭代银,2,陈卫东
(1. 安徽中医药大学药学院,安徽 合肥 230011;2.安徽省中药研究与开发重点实验室,安徽 合肥 230031)
外泌体(exosomes,Exos)是细胞分泌的一种膜囊泡,因其可以将供体细胞的信息通过其携带的蛋白质、mRNA、miRNA等传递到受体细胞,实现细胞之间的信息交流及物质交换,并且可以作为药物载体转运药物而引起科学家的广泛关注[1](Fig 1)。外泌体作为内源性的天然药物载体有着独特的优势,表面由脂质和蛋白质组成,使其可以穿透许多生物膜,提高药物的运输效率和靶向性,可以稳定存在于血液中,纳米级尺寸明显增强药物在肿瘤部位的渗透滞留效应(permeability and retention effect, EPR)[2]。目前,许多抗癌药物、基因药物及抗炎药物均被成功载入外泌体。但是由于没有较好的外泌体分离纯化和载药的方法,使得其作为药物载体的应用受到限制。本文主要回顾和讨论外泌体作为药物载体的研究进展及其面临的挑战。
1 外泌体简介
外泌体来源于几乎所有细胞的膜囊泡(直径40~150 nm),密度在1.13~1.19 kg·L-1之间 ,是目前临床诊断和治疗肿瘤等相关疾病的重要工具[3]。外泌体的形成先是细胞质膜的内陷形成胞内小泡,然后胞内小泡进一步发展成多泡小体,最后多泡小体与细胞质膜融合释放[2],其通常被释放到细胞外,然后与其他的细胞质膜融合。外泌体是一个“纳米球”,由来自于亲本细胞的蛋白质和脂质组成,主要有热休克蛋白(HSP70、HSP90),膜转运和融合蛋白(GTP酶、膜联蛋白),四分子交联体家族(CD9、CD63、CD81)及多泡的生物合成(如Alix、TSG101)涉及的蛋白,外泌体膜表面丰富的蛋白使其可以与靶细胞膜上的特异性蛋白结合,使其具有靶向性[4],如来自少突胶质细胞的外泌体,因带有髓磷脂蛋白质,使其具有独特的选择属性[5](Fig 2)。

Fig 1 Biogenesis of exosomes

Fig 2 Structure of exosomes
在药物递送系统的快速发展中,纳米技术因能靶向和控释使其具有很好的应用前景,各类型的纳米载体能明显提高药物的治疗效果[6]。病毒具有传送其基因组进入其他细胞的能力而被应用于递送遗传物质到细胞[7]。然而,利用病毒转染可能会引起潜在的基因突变,诱发癌症与加重免疫反应,并且高额的成本限制了病毒载体在临床上的应用[8]。
理想的载体应该是安全、有效,并且有最佳的生物利用度。同时,载体的稳定性,低的细胞毒性和免疫原性,以及能否成功地将药物运送到特定的组织或细胞也是至关重要的。外泌体作为药物递送系统具有一系列的优点:(1)从患者的组织或血液收集(如骨髓、单核细胞或巨噬细胞)的外泌体,载药后可以逃避单核吞噬细胞系统(mononuclear phagocyte system,MPS)的清除,从而减少药物的清除率[9]。(2)外泌体具有潜在的靶向性,可以增加药物输送到靶组织的能力[10]。(3)外泌体膜的特定脂质体和蛋白质,使得外泌体可以直接与靶细胞膜融合,从而明显提高药物进入细胞的可能性。(4)外泌体载体可以避开内吞途径的内化,而且外泌体的安全性在许多临床试验已经得到证实[11]。因此,越来越多的研究开始关注外泌体作为载体的可能性及临床应用的价值。
2 外泌体的提取、分离方法
开发高效、快速、稳定,并且保持外泌体结构和生物功能完整性的方法,是目前外泌体应用于临床的基础和前提。从细胞上清和体液中提取分离外泌体的方法很多,但是外泌体的纯度和产量却和分离方法息息相关。通常分离步骤少、产率高,但是纯度会受到影响。鉴于每种分离方法都有其优缺点,实验可以根据样本来源、下游实验目的等,选择合适的外泌体分离方法。2015年,国际囊泡组织(Internation Society for Extracelluar Vesicles , ISEV)指出,简单依靠一种分离方法得到的外泌体的纯度和产量都难满足实验的需求。因此,推荐联合使用各种方法,从而得到高纯度和高产量的外泌体。本文总结了常用的传统和新兴的外泌体提取方法(Fig 3)。
2.1超高速离心法
常用的是超高速离心法,该方法是被誉为分离外泌体的“金标准”。该方法利用离心力从细胞培养液或生物流体获得外泌体,经过400×g、2 000×g、10 000×g的低速离心,除去细胞及大的细胞分泌物;最后超高速100 000×g离心得到外泌体[12]。超高速离心因操作简单,不需要复杂的技术支持,并且成本相对较低而被广泛使用。但是该方法耗时、产率低,得到的外泌体的数量和质量很大程度上受转子的类型、转子沉降角度等因素影响,其中最主要的问题就是差速离心法获得的沉淀物是外泌体,但也会有其他的囊泡、蛋白质或蛋白和RNA的聚集体。

Fig 3 Isolation of exosomes
2.2尺寸排阻色谱法和超滤法尺寸排阻色谱法是利用分子筛理论,最初是根据蛋白质分子大小分离蛋白质的色谱技术。该方法的主要优点是不需要很大的离心力,从而保证了外泌体的完整性。Mol等[13]对比超高速离心和尺寸排阻色谱法得到的外泌体蛋白,结果显示,后者得到的外泌体的蛋白丰度高于前者。这些基于过滤或尺寸排阻色谱的新方法为外泌体大规模的生产和临床应用提供了可能。
超滤也是根据外泌体的尺寸将其分离出来的一种方法,超滤一般被认为是外泌体分离过程中的一个准备过程,通过超滤除去大分子和小分子的蛋白质。不过连续的超滤可以分离出外泌体,和超高速离心相比,超滤不需要特殊的设备就可以较短时间内分离出外泌体。但是,超滤膜对外泌体的黏附作用会降低外泌体的产量,并且超滤过程中施加的外力可能会使外泌体变形或者破裂。
2.3免疫亲和层析法免疫亲和层析法是利用生物体内存在的抗原、抗体之间高度特异性的亲和力进行分离的方法,主要用于生物大分子的分离、纯化。将其应用于外泌体的分离主要是借助外泌体表面的特异性抗体,如TSG101或四跨膜蛋白。此方法的原理是利用抗原抗体的特异性结合,只有囊泡表面有特异性的抗体才可以被识别,这使得提取的外泌体纯度高,但是产量低。Zarovni等[14]分别用超速离心、密度梯度离心和免疫层析法,从血浆和细胞上清中提取外泌体蛋白,结果表明,免疫亲和层析法得到的外泌体表面存在多种标记蛋白(Alix、CD9、CD63),同时,ELISA和PCR结果也证明了该方法的可行性。
2.4梯度密度离心法研究发现,外泌体的密度在1.1~1.19 kg·L-1之间,因此,可以采用密度梯度离心法来分离外泌体。该方法是将超速离心结合蔗糖密度梯度或蔗糖垫结合,原理是先除去非囊泡物质,再通过梯度密度浓缩提取外泌体,该方法可以得到相对较为纯净的外泌体。传统的梯度密度方法通常需要离心16 h,但是2012年,研究者[15]使用了62~90 h才分离出某些确切囊泡,因此,该方法可能不足以沉淀所有的外泌体。如果离心时间不充足,污染物质可能和外泌体保持在相同的密度层,特别是这个密度范围又比较宽。
2.5聚合物沉淀法聚合物沉淀法用于分离病毒和其他的生物大分子已有50多年历史,近几年,将其作为一种新的方法来分离外泌体。目前,市场已经有应用聚乙二醇(polyethylene glycol, PEG)溶液提取外泌体的试剂盒,最常见的是System Biosciences 公司的ExoQuick®和ExoQuick-TC®kits,该试剂盒操作简单不需要特殊的仪器,但是价格昂贵。提取外泌体的试剂盒主要成分是PEG8000(30%~50%),将试剂盒与体液或细胞培养液4 ℃孵育过夜,之后再低速离心。
2.6微流控技术微流控是利用微纳米级尺寸的管道来处理和操控流体所涉及的一门技术,其在外泌体分离方面的应用受到越来越多学者的关注。Jie等[16]课题组开发了一种三维纳米结构微流控芯片,微柱阵列通过化学沉积将交叉多壁碳纳米管功能化,然后其就可以识别特定的分子(CD63)并利用独特拓扑纳米材料高效的捕获外泌体。Wunsch等[17]利用硅工艺生产纳米级确定性侧向位移(Nano-DLD)芯片,得到了均匀的间隙尺寸,该芯片可以灵敏地将20~110 nm 的颗粒分离。该研究证明了外泌体基于大小的位移,从而揭示了利用芯片分选和量化纳米级生物胶体的潜力。
3 外泌体作为“货物”载体
外泌体的脂质双分子膜可以保护其在血液循环中不被降解,但是这种膜结构以及其内含各种丰富的物质,使得外泌体载“货物”变得困难。外泌体只有保证膜结构的完整性,才能不引起免疫反应,不被MPS吞噬 。目前,将“货物”载入外泌体的方法主要有两种(Fig 4):(1)前转载,在分离外泌体之前,将“货物”与母代细胞共培养和对母代细胞进行转染,可以让母代细胞分泌含有“货物”的外泌体;(2)后转载,分离出外泌体之后,将“货物”载入外泌体。
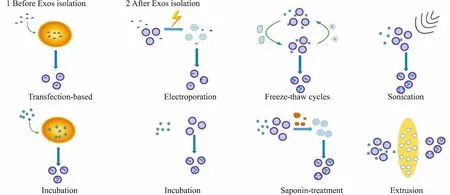
Fig 4 Methods of drug loading
3.1前转载前转染主要是用转染剂将“货物”转染进入亲代细胞(或者将“货物与亲代细胞孵育”),然后收集培养基,获得载有“货物”的外泌体的过程。该方法的主要问题是合适有效的转染试剂很少,且转染试剂无法完全去除,导致转染效率低,无法排除转染试剂对实验的影响。
3.1.1外泌体载核酸类物质 Didiot等[18]将小干扰RNA通过疏水性修饰(hsiRNA)后,与外泌体孵育,结果载有靶向亨延顿mRNA的hsiRNA外泌体可以被小鼠原代皮层神经元内化,导致亨延顿mRNA和蛋白发生剂量依赖性沉默,然后单侧注入含有hsiRNA的外泌体到小鼠纹状体,导致寡核苷酸的双侧分布,亨延顿mRNA在两侧均有35%的沉默。递送至脑的含hsiRNA外泌体广泛分布和有效性有望改善和治疗亨延顿以及其他神经变性疾病。Buscail等[19]利用工程化手段,将来源于正常成纤维细胞间充质细胞的外泌体修饰为“iExosomes”,其可以递送小RNA,以特异性靶向突变体KRAS,导致疾病抑制,并增加小鼠模型的总体存活率。研究人员使用RNA干扰(RNAi)的靶向方法,用天然来源的外泌体递送时,抑制胰腺癌细胞中的突变体KRAS的表达,从而影响多种胰腺癌模型中肿瘤的生长和存活。与正常的脂质体相比,工程化的外泌体(iExosomes)靶向致癌性KRAS,并且他们还发现,通过外泌体表面的CD47分子可以让外泌体给巨噬细胞一个“别吃我”的信号,从而减少外泌体的损耗,提高其在血液中的半衰期,最终提高治疗效果。
3.1.2外泌体载蛋白质 无论是化学试剂还是核酸,这些大分子物质都可以被成功载入外泌体中,但是载高分子质量的蛋白质却存在很大难点,重组蛋白的提纯耗时、耗钱,而且过程中因物理或者化学作用会导致蛋白变性。Yim等[20]最近研究一种新的蛋白质载入外泌体的方法:通过可逆蛋白相互作用,促进蛋白质载入外泌体(EXPLORs),相比其他方法,该方法的载蛋白量更高。实验过程中,在蓝色荧光控制下,有效利用可逆蛋白与蛋白之间的相互作用,将货物蛋白导入亲代细胞,然后从亲代细胞提取分离出含有目的蛋白的外泌体。因为EXPLORs是通过胞内蛋白活跃载入外泌体的,在这个过程中使用了蓝色荧光,并且整个过程不包括蛋白提纯的步骤。该课题组通过体内、体外实验均成功地转运诸如Cre recombinase一类的功能蛋白到靶细胞,他们进一步阐释,认为EXPLORs技术对于提高治疗性蛋白的装载和转运效率具有重要的意义。
3.1.3外泌体载化疗药物 Ascucci等[21]将紫杉醇(2 mg·L-1)和小鼠间充质干细胞(3×105)混合培养24 h,除去未进入细胞的紫杉醇,48 h以后收集细胞上清,超高速离心提取外泌体。高效液相色谱和红外光谱结果显示,间充质干细胞分泌的外泌体中含有紫杉醇,同时研究人员将含有紫杉醇的外泌体作用于人的胰腺癌细胞,结果显示,含有紫杉醇的外泌体有效抑制了胰腺癌细胞的增殖。另外,该课题组还发现,不同来源的外泌体具有特异性的标记,且该标记有望成为疾病诊断的靶点。
3.2后转载另一种常见的方法是将“货物”与外泌体孵育,鉴于外泌体的磷脂双分子层表面,该方法更适用于小分子的疏水性“货物”。对于水溶性的“货物”则常用电穿孔的方法将“货物”载入外泌体。
3.2.1自然孵育 越来越多的研究聚焦于外泌体作为载体用于向中枢神经系统递送药物、RNA和蛋白质。为了克服血脑屏障(blood brain barrier, BBB),外泌体需要靶向脑内皮的脑归巢肽修饰,这可能会增强免疫应答。Yuan等[22]首次证明不需要这种修饰的外泌体也可以透过哺乳动物的BBB。原始巨噬细胞的外泌体一方面可以利用整合素淋巴细胞功能相关抗原1(lymphocyte function associated antigen-1, LFA-1)和细胞间黏附分子1(intercellular adhesion molecule-1, ICAM-1),另外通过碳水化合物结合的C型凝集素受体,与包含BBB的脑微血管内皮细胞相关作用。更重要的是,炎症中常见的ICAM-1上调可以促进BBB细胞对外泌体的摄取。研究者进一步的体内实验证明,巨噬细胞的外泌体可以穿过BBB,并将大脑衍生的神经营养因子(neurotrophin, NT)递送到脑中,这种传播在脑炎症的存在下会增强。
来自路易斯维尔大学的Agrawal等[23]探讨了牛奶来源的外泌体作为口服递送化疗药物紫杉醇(PAC)代替静脉注射,从而改善药物的负载效率和降低药物毒性反应的可行性。研究结果表明,负载PAC外泌体(ExoPAC)的粒径约为108 nm,负载率8%左右,-80 ℃时,外泌体和ExoPAC在模拟胃肠液中均表现出较好的稳定性。体外实验发现,ExoPAC在PBS(pH 6.8)环境下,对PAC的缓释效果可以持续至少48 h。体内实验中,口服递送ExoPAC作用于人肺癌荷瘤小鼠,其肿瘤的生长明显受到抑制(抑制率为60%,P<0.001)。而同等剂量的PAC静脉注射,只显示出中等程度(抑制率为 31%),且抑制作用无统计学差异。值得注意的是,与传统静脉注射相比,口服ExoPAC全身毒性和免疫原性毒性更低。
3.2.2电穿孔 电穿孔法因参数容易控制,多种“货物”载入外泌体都可以使用该方法。Wang等[24]研究了胞外囊泡作为小RNA的靶向递送系统,利用电穿孔法将siRNA/microRNA载入核酸适配体AS1411(AS1411是一种靶向肿瘤细胞高表达核仁素的核酸适配体)修饰的囊泡中,然后通过外泌体将siRNA/microRNA靶向递送到乳腺癌组织。由于AS1411和核仁素的的结合达到瘤靶向(核仁素在乳腺癌细胞表面高表达),这种靶向let-7miRNA的囊泡可在体外传递到人乳腺癌MDA-MB-231细胞。静脉注射载有Cy5荧光标记的miRNA let-7的AS1411囊泡,可以选择性靶向荷瘤小鼠中的肿瘤部位,并抑制肿瘤的生长,而且修饰的囊泡耐受性良好,没有显示明显的非特异性副作用或免疫应答反应。
化疗药物虽然为肿瘤的治疗带来了希望,但是临床使用的化疗药物均有不同程度的毒副作用,如阿霉素,其心脏毒性限制了阿霉素的广泛使用。Hadla等[25]用电穿孔的方法将阿霉素载入外泌体中,构建一个新的药物递送体系,在后续的体内和体外实验中均发现,与阿霉素相比,外泌体载阿霉素可以部分限制阿霉素穿过心血管内皮细胞,并减少阿霉素在心脏部位的聚集,从而降低了心脏毒性。外泌体载阿霉素在小鼠体内的耐受量明显高于游离的阿霉素,从而增加了阿霉素对乳腺癌和卵巢癌的治疗指数。
4 总结与展望
过去的几十年中,越来越多的研究聚焦在外泌体作为药物递送系统的可能性,但是外泌体的提取方法、纯度、产业化生产及低的载药量等,限制了其进一步的发展。未来的研究将集中在如何提高外泌体的载药量上,事实上,外泌体本就能够携带大量“货物”进入机体。外泌体的进一步修饰可以提高其活性,并且也可以根据疾病产生的细胞毒性(癌症治疗),或保护特性(用于治疗神经退行性疾病的影响,提高治疗的效果)来修饰外泌体。新的治疗干预措施,包括扩大生产规模和控制生产质量,严格的药代动力学和毒理学研究,这些目标的实现将是后续的工业发展的关键步骤。目前,一些抗癌药物包括阿霉素、紫杉醇和基因类药物,都已经可以有效地负载到外泌体中,说明了外泌体在药物递送上的潜力。但是,外泌体的研究目前仅仅停留在实验室基础上,将其应用于临床还需要很多的研究。
