Sema 4D与神经系统疾病相关性的研究进展
2019-03-13姣综述余昌胤徐祖才审校
李 岚,王 姣综述,余昌胤,徐祖才审校
信号素(Semaphorin,Sema)是分泌和膜相关的糖蛋白,根据其结构要素和氨基酸序列相似性分为8类, 1类和2类发现于无脊椎动物;而3~7类存在于脊椎动物;第8类则由病毒编码[1]。 其中Sema 4D是第一个被发现的具有免疫特异性的分泌和膜结合蛋白,其在神经元和少突胶质细胞的迁移和分化、中枢神经系统炎症和神经变性中起重要作用。本文拟对Sema 4D与神经系统疾病相关性的研究进展作一综述。
1 Sema 4D的生物学特性
1.1 Sema 4D的分子结构 Sema 4D是分泌和膜结合蛋白家族Semaphorin的成员,Sema 4D cDNA胞外部分同时存在Sema和Ig样域,是第一个被发现的具有免疫特性的Sema成员。Sema 4D含有一个保守的400个氨基酸的“Sema”结构域,这个结构的中心特点是一个七叶片β螺旋桨折叠整体结构[2],被归类为第4类Semaphorin成员;其通常以二硫键连接的同源二聚体形式在胚胎及成年哺乳动物中枢神经系统中都有较高的表达,通过金属蛋白酶依赖性水解过程成为可溶性分子从细胞表面释放[3],其功能主要由水解后的可溶性Sema 4D(sSema 4D)实现。
1.2 Sema 4D的受体 Sema 4D通过结合3种不同的亲和性受体发挥作用:Plexin-B1、Plexin-B2和CD72。高亲和力受体Plexin-B1和中等亲和力受体Plexin-B2都在神经细胞中表达并参与神经系统发育[4],但Plexin-B2与Sema 4A亲和性更高;Plexin-B1在血管内皮细胞中也有表达,二者均含具有PDZ结构域,与LARG(白血病相关的Rho GEF)和Rho GEF分子的PDZ结构域相互作用,其中,PDZ也称为“盘状同源区域”,是一种由80到100个氨基酸残基组成的保守序列,生物作用主要是介导膜上的蛋白聚集,结合目标蛋白的C端,目标蛋白结合在由PDZ结构域第一个α螺旋和第二个β折叠所构成的沟内[5]。低亲和力受体CD72是主要由造血细胞表达,CD72属于Sema 4D的主要淋巴细胞受体[6]。
2 Sema 4D在中枢神经系统中的作用
2.1 Sema 4D参与调控突起生长 神经轴突再生包括轴突延伸、髓鞘形成、突触形成等过程,Sema 4D通过其受体Plexin-B1参与轴突再生不同过程,同时抑制树突生长。
Sema 4D通过其受体Plexin-B1调节微管末端的功能,调节轴突和树突生长。在轴突再生过程中,其前端的生长锥,是轴突生长的执行单元,其内部以微丝、微管为支架,通过内部肌动蛋白的聚合和解聚向前延伸。有研究表明,Sema 4D通过不同作用通路诱导生长锥塌陷,从而抑制轴突再生。在树突延伸过程中,Sema 4D也通过其受体Plexin-B1及其下游通路参与微管形成过程,抑制树突生长[7]。
Sema 4D与Plexin-B1结合后,Plexin-B1被激活,PDZ RhoGEF和白血病相关的RhoGEF(LARG)通过将它们的PDZ结构域与Plexin-B1的PDZ结构域结合,这些GEF通过其DH/PH结构域刺激Rho磷酸化而被激活,从而激活Rho以及其下游效应分子。ROK信号刺激LIM激酶(LIMK),其通过磷酸化丝切蛋白(Cofilin)而抑制其活性,从而抑制肌动蛋白应力纤维移动。同时ROK也通过阻断肌球蛋白磷酸酶活性而活化肌球蛋白轻链(MLC),从而增强由肌球蛋白激酶(MLCK)引起的磷酸化MLC的积聚,最终促使应力纤维的聚合和收缩,轴突生长被抑制。在内皮细胞,如果细胞通过整联蛋白附着于细胞外基质,收缩应力纤维产生的张力促进组装成熟的粘联复合物(focal adhensions)和脯氨酸酪氨酸激酶2(Pyk2)的激活。Pyk2激活导致磷脂酰肌醇3-激酶(PI3K)、蛋白激酶B(Akt)和蛋白激酶1/2(Erk1/2)的激活,是促进血管内皮细胞迁移的重要环节[1.7](见图1)。
在小胶质细胞内,ERK1/2同时也激活小胶质细胞,增加NO的产生,增强中枢神经系统炎症反应[8]。有研究认为,Sema 4D与Plexin-B1的结合后,Plexin-B1胞内部分的酪氨酸残基磷酸化激活其GAP活性[9],导致R-Ras活动的下调,其下游的PI3K信号传导途径随之下调,PI3K失活引起下游通路的Akt的去磷酸化和GSK-3β活化,诱导生长锥塌陷[10]。但有实验表明Sema 4D与Plexin-B1并非激活R-RasGAP活性的唯一条件[1],Sema3A与Plexin-A1结合同样能激活R-RasGAP活性[10](见图1)。
Ena/VASP蛋白家族参与微丝(F-actin)的成核和延伸,Ena/VASP通过将肌动蛋白复合物装配到活性肌动蛋白前端,增强微丝的伸长。Lpd是Ena/VASP家族蛋白的一种调节因子,M-Ras与Lpd结合后,使Lpd被激活到微丝前端,作用于Ena/VASP介导肌动蛋白细胞骨架形成。当树突受损后,其再生功能被激活,但Sema 4D与Plexin-B1 结合后,激活了Plexin-B1的GAP活性,其GAP活性抑制M-Ras活性,Lpd不能与Ena/VASP结合,F-actin不能形成,从而树突形成过程也被抑制[7](见图2)。
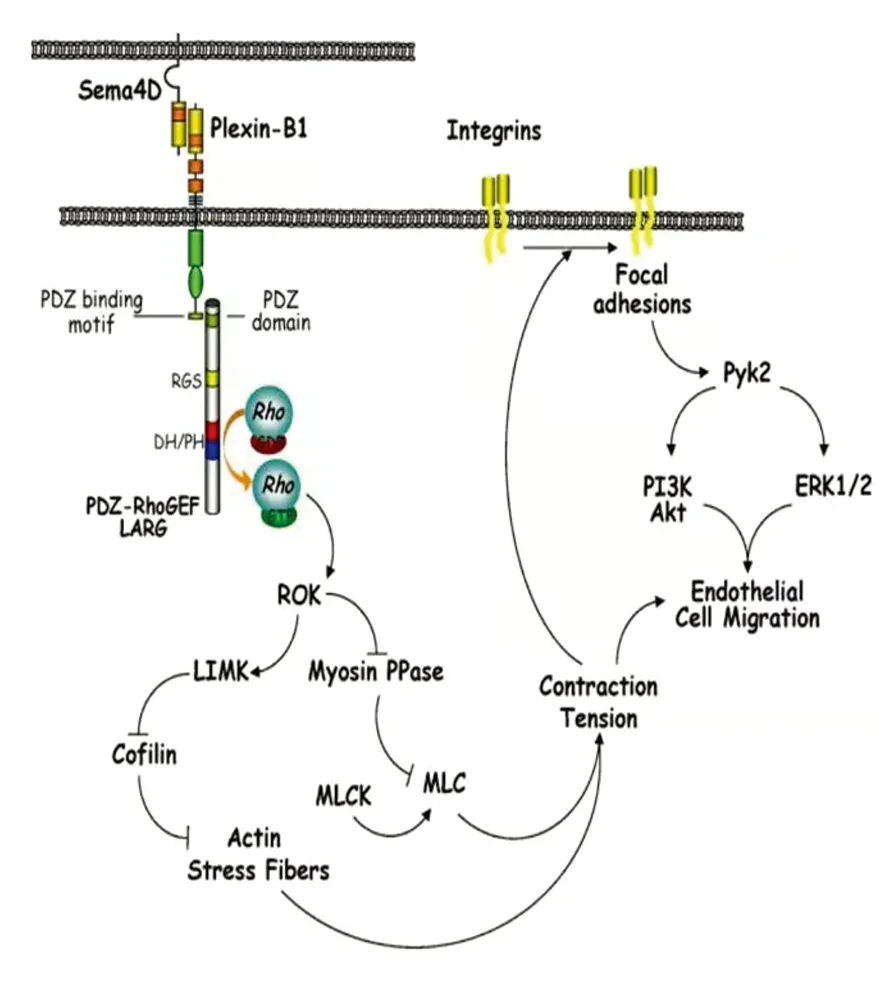
图1[1]Sema 4D也通过其受体Plexin-B1及其下游通路参与神经再生及内皮细胞迁移过程
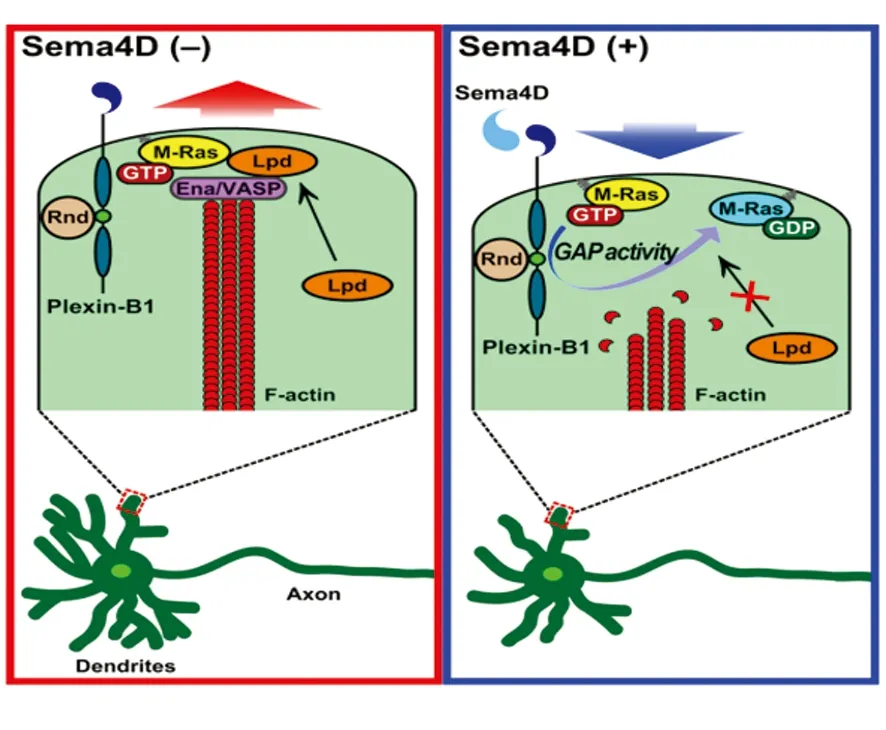
图2[7]Sema 4D与Plexin-B1 结合后,抑制M-Ras活性,抑制树突生长
2.2 Sema 4D参与少突胶质细胞相关的髓鞘形成 少突胶质细胞是中枢神经系统的髓鞘形成细胞,Sema 4D在少突胶质细胞的迁移和分化过程具有重要作用。实验表明[11,12],Sema 4D缺乏导致少突胶质细胞分化增强和迁移,而外源性添加可溶性Sema 4D则抑制少突胶质细胞分化,并进一步促进少突胶质细胞的凋亡。所以,Sema 4D也通过抑制轴突髓鞘形成参与轴突再生过程。动物实验表明[13],大鼠少突胶质细胞Sema 4D敲除可促进脊髓损伤(spinal cord injury,SCI)后的功能恢复。也有研究称[14],斑马鱼SCI后损伤部位Sema 4D表达上调有助于其运动功能的恢复;抑制Sema 4D的表达,延缓了运动功能的恢复及损伤部位以下轴突再生。在SCI后,Sema 4D不仅在少突胶质细胞中表达,而且在内皮细胞也有表达。Sema 4D在内皮细胞中表达促进血管形成,而在少突胶质细胞前体细胞中的过表达抑制神经元髓鞘形成,同时也激活了炎症反应。
2.3 Sema 4D促进抑制性突触形成 研究表明,Sema 4D不仅能促进哺乳动物海马GABA能神经突触的发育, sSema 4D还可促进GABA能突触的形成;Sema 4D不需要其细胞内结构域来调节突触形成,但sSema 4D促进GABA能突触的形成,需要其受体PlexinB1介导[15]。在癫痫小鼠模型中,海马CA1区输注Sema 4D,3 h后分离的海马切片免疫组化显示GABA能神经神经递质密度升高,且处理后的小鼠较对照组癫痫发作程度减轻,持续时间缩短,可能与Sema 4D调控哺乳动物海马GABA能神经突触形成有关[16]。其机制可能是 Sema 4D定位到GABA能突触的突触后膜,通过与GABA能突触末端表达的PlexinB1的跨膜突触相互作用,促进突触的形成[17]。
2.4 Sema 4D参与中枢神经系统炎症反应 激活的小胶质细胞可表达诱导型一氧化氮合酶(iNOS),从而增加NO生成,参与中枢神经系统炎症反应,T细胞释放的Sema 4D可与脊髓中小胶质细胞的plexin-B1结合,从而参与自身免疫性脑脊髓炎(EAE)的发病。阻断Sema 4D信号能有效抑制EAE的小胶质细胞活化和神经炎症反应;Sema 4D通过Plexin-B1机制激活小胶质细胞增加NO生成;而细胞外调节蛋白激酶(ERK)阻滞剂可抑制Sema 4D引起iNOS的表达,换言之, Sema 4D通过ERK激活小胶质细胞,从而iNOS合成增加,参与中枢神经系统炎症反应[8]。 并且也报道称,Sema 4D通过Plexin-B1加速急性脑卒中后血脑屏障(BBB)破坏和促进炎症反应[18]。
2.5 Sema 4D与神经退行性疾病 Sema 4D可能调节神经退行性病变的发展过程,通过抑制Sema 4D信号可增加神经元生长和增强少突胶质细胞成熟,这可能有助于治疗神经退行性疾病[19]。Sema 4D在阿尔兹海默病患者(AD)大脑皮质和海马中表达减少,但研究认为,Sema 4D并非AD的危险因素[20],Sema 4D表达减少与AD是否存在其他联系目前还未见文章报导。亨廷顿舞蹈病(HD)是一种遗传性致命性神经退行性疾病,除了特征性运动缺陷和尾状核萎缩外,HD的特征标志还包括行为异常,免疫激活以及皮质和白质损失。通过抗Sema 4D,改善了HD模型小鼠的神经病理学特征,包括纹状体、脑皮质和胼胝体萎缩,同时,焦虑样行为和认知障碍等症状也得到改善,但是对运动障碍没有明显的影响[21]。
人淋巴细胞白血病病毒1型(htlv-1)可引起htlv-1相关脊髓病/热带痉挛性瘫(HAM/TSP)是一种神经退行性中枢神经系统(CNS)疾病。这种病毒主要感染CD4+T淋巴细胞,而非感染神经元。中枢神经系统内浸润的受感染的淋巴细胞可分泌Tax,Tax通过改变细胞内通路与轴突骨架动力学造成神经损伤。经培养,感染者的PBMCs显示出较高水平的CRMP-2,这种效果被Tax或Sema 4D抗体所阻断,且PBMCs分泌培养基中发现了Tax与sSema 4D的相互作用[22]。
2.6 Sema 4D刺激背根神经节(DRG)生长 研究表明[23],胚胎DRG不仅含Sema 4D,也有其受体plexinB1和plexinB2的表达,并且主要位于DRG神经元的轴突。Sema 4D可增强神经生长因子(NGF)刺激DRG神经元的轴突生长作用,其机制可能是,Sema 4D诱导生长锥崩溃信号传导过程中,PDZ-RhoGEF的PDZ结构域与plexin-B1的C末端结合,其内含有调节G蛋白信号(RGS)结构域,可以被异三聚体G蛋白调控,PDZ-RhoGEFs通过这一机制促进非活动的GDP转化为有活性GTP;因此,在胚胎发育中Sema 4D-Plexin-B1信号可能通过异三聚体GPCR,PDZ-RhoGEFs将抑制信号转化为活化信号。也有研究认为,Plexin-B2是神经突生长的正性调节因子[24];在胚胎组织发育过程中,是否可能存在某种机制,使得Sema 4D与plexinB2亲和性增强,或Sema 4D-plexinB1通路作用被抑制而Sema 4D-plexinB2通路作用被增强,从而得到Sema 4D对神经轴突生长表现为正性作用的结果;然而这些机制仍有待研究。
3 展 望
综上所述,相关的基础与临床研究均表明,Sema 4D不仅与神经系统的某些生理功能密切相关,同时还可能参与了脱髓鞘、炎症、癫痫、变性及神经再生等相关疾病,通过对Sema 4D及其作用通路的干预,在部分疾病的治疗上也已取得了一定的进步;但其更具体机制还有待更多的探究,通过对其更精确的调控和应用,也许能够获得更多神经系统疾病的治疗靶点。
