大脑中动脉穿支供血区单发脑梗死CISS临床分型及LDL-C、超敏-C反应蛋白的关系
2019-03-13车惠英曲琳卓关宏锏
车惠英,曲琳卓,关宏锏
临床应用将梗死部位位于基底节区大部分、尾状核体及内囊上部,梗死直径≤2 cm的脑梗死定义为腔隙性脑梗死,直径>2 cm的脑梗死定义为纹状体内囊大梗死。其病因的主要机制是因为大脑中动脉(middle cerebral artery,MCA)的深穿支主要是指源于MCA-M1段的豆纹动脉的阻塞或狭窄所致[1~3]。梗死直径≤2 cm的孤立腔隙性脑梗死,是因为小血管发生病变所导致,其中的病理改变以小动脉脂质透明样变或微粥样斑块形成为主[4,5];而纹状体内囊大梗死通常是因MCA-M1段动脉的粥样硬化性改变引起的狭窄或血栓引起的栓塞阻塞数个穿支动脉的开口所致[6]。根据临床常用的TOSAT(The Trial of Org 10172 in Acute Stroke Treatment)分型[7],梗死灶直径<1.5 cm为小动脉闭塞型(Small-artery occlusion,SAO),这部分小动脉闭塞型脑梗死中存在一定比例的责任大脑中动脉的斑块或狭窄,根据我国高山教授等提出的中国缺血性卒中亚型(Chinese ischemic stroke subclassfication,CISS)[8],而存在大脑中动脉斑块或狭窄的穿支动脉供血区单发梗死其发病机制为斑块阻塞穿支动脉开口应归类为大动脉粥样硬化型,这两部分不同分型的大脑中动脉穿支供血区单发脑梗死其LDL-C水平及超敏-C反应蛋白情况如何,对于二级预防是否需更改治疗方案,对此我们把相关临床观察报道如下。
1 对象与方法
1.1 病例选择 连续入选2016年10月-2017年10月入住延边大学附属医院神经内科治疗的急性脑梗死患者100例,其中男性70例(占70%),女性30例(占30%)。年龄15~86岁,平均(60.1±1.4)岁。所有入选病例均进行头部MRI+DWI的检查,入院条件:头部MRI+DWI检查显示:梗死部位位于基底节区和侧脑室体旁,其主要为MCA深穿支动脉分布区域。梗死部位位于丘脑、放射冠和半卵圆中心的病例被排除。
1.2 方法 (1)为评估颅内血管病变情况,对所有入选病例进行头部MRA和TCD检查;(2)排除颈内动脉狭窄>50%的患者(行双侧颈-椎动脉彩超检查);(3)为除外可疑的心源性栓子(行常规心电图和心脏彩超检查),除外包括急性心肌梗死(发病3 w内)、梗死后室壁瘤形成、急性或亚急性细菌性心内膜炎、没有附壁血栓的心房纤颤、病窦、各种程度的二尖瓣狭窄、机械瓣膜置换术后以及扩张型心肌病等;所有患者均常规进行血脂、生化等检查,记录LDL-C水平、超敏-C反应蛋白水平;由两位副主任医师(均从事临床工作15 y以上)根据得到的数据分别对每一例患者根据CISS分型进行二次分型,分为穿支动脉病变型、大动脉粥样硬化型两组,两组间比较LDL-C水平及超敏-C反应蛋白情况。
2 结 果
所有入选病例完善检查后按照CISS分型提示穿支动脉型63例,大动脉粥样硬化型37例,基线资料提示高脂血症、低密度脂蛋白胆固醇,2项指标提示存在统计学差异,而年龄、既往心脏病史(冠心病)、吸烟史及卒中史,虽然统计学差异不明显,但数值差异不大(见表1)。而在发现100例患者伴有同侧MCA-M1段斑块或狭窄37例,根据CISS分型二次分型后,穿支动脉病变型63例,大动脉粥样硬化型37例,大动脉粥样硬化型比例为37%。其中穿支动脉型LDL-C水平为(3.08±0.92) mmol/L,大动脉粥样硬化型LDL-C水平为(3.50±0.88) mmol/L,穿支动脉型组与大动脉粥样硬化型组比较存在统计学差异(P<0.05)(见表2)。
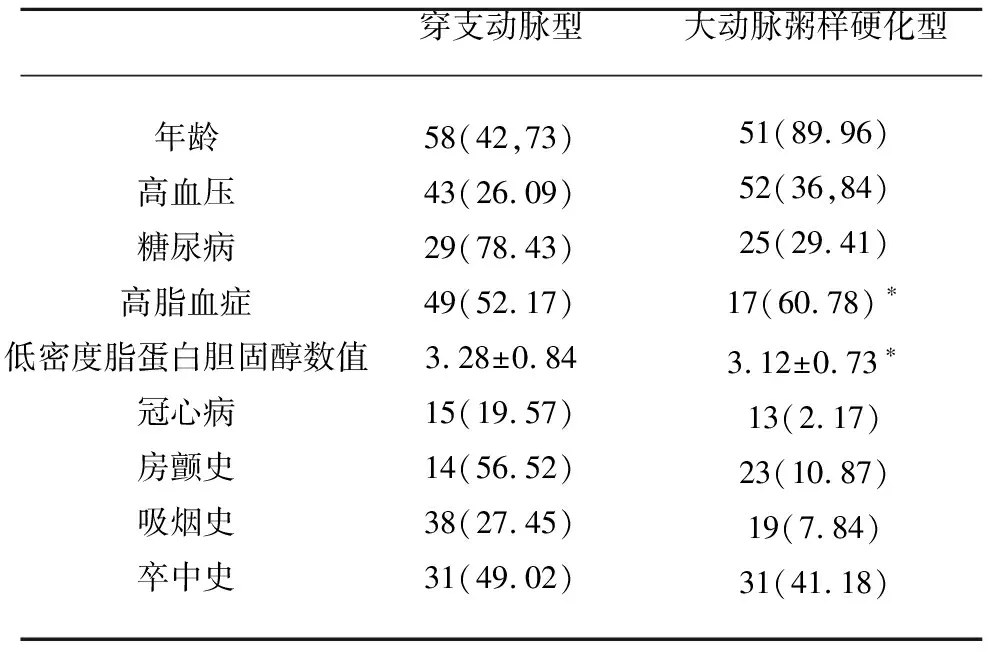
表1 患者基线资料与检查结果
与穿支动脉病变型比较*P<0.05
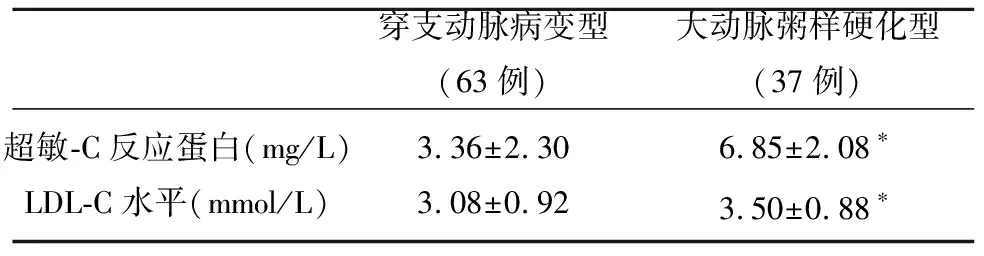
表2 根据CISS分型穿支动脉病变型与大动脉粥样硬化型LDL-C水平的比较
数据为(均数±标准差)与穿支动脉病变型比较*P<0.05
3 讨 论
我们知道经典的腔梗定义是梗死灶直径在2 cm以下,病因一般为高血压或糖尿病,以脂质透明样变或微粥样斑块形成为病理改变,最终导致穿支动脉(一般为直径100~400 μm)狭窄或闭塞。而MCA穿支动脉狭窄或闭塞的发病机制如下:(1)MCA穿支动脉开口被动脉粥样硬化斑块阻塞或原位血栓形成;(2)MCA粥样硬化斑块的形成,其表面成分以血小板聚集物和纤维蛋白为主,血流速度被降低,碎裂脱落的粥样斑块随缓慢的血流进入穿支动脉,部分血栓被滞留于血管管腔内,形成动脉-动脉的栓塞。由于皮质支存在较多侧支吻合,而属终末血管的穿支动脉缺乏可供血的侧支,因此当MCA狭窄时血栓更容易阻塞深穿支动脉血流,其对应的供血区域更易形成梗死灶,而皮质区供血则因侧支循环的开放可免于受累[9~11]。故深穿支供血区可因上述病理改变而发生小范围的脑梗死(直径≤2 cm),但是这些梗死与腔隙性脑梗死传统意义上的发病机制有很大不同。有研究报道炎性损伤参与了动脉粥样硬化性斑块的分解破裂,研究表明,巨噬细胞在粥样硬化形成的过程中可产生许多细胞因子(如白介素-6等),肝细胞受到上述细胞因子刺激后可合成并释放C反应蛋白进入血液循环,所以C反应蛋白水平的高低可能间接了反映动脉硬化的发展程度[12]。
在本研究中可以发现MCA的M1段存在着狭窄或者斑块的患者共37例,占总例数的37%,这些患者依据CISS分型应为大动脉粥样硬化型,而这部分大动脉粥样硬化型脑梗死与MCA正常而穿支动脉闭塞型脑梗死比较时其LDL-C水平升高,这充分表明其发病机制与动脉粥样硬化形成有直接相关关系;但MCA斑块破裂使深穿支动脉闭塞与其狭窄程度相关性尚有争议,主要与动脉硬化斑块不稳定有关,比较超敏-C反应蛋白水平时可发现大动脉粥样硬化型较穿支动脉闭塞型脑梗死水平明显升高,说明其发病机制与不稳定斑块炎症反应有关。Amarenco等学者参与了阿托伐他汀进行强化治疗的SPARCL研究[13,14],其结果显示:治疗组中于无冠心病史的近期(事件发生在6 m以内)有卒中或TIA病史的患者再发卒中危险可降低16%(P=0.03)。应用他汀类药物可使发生卒中或TIA的风险降低23%(P<0.001);致死性卒中的发生危险降低达43%(P=0.03);使发生任一的冠心病事件的风险极其显著的降低了42%(P<0.001),其中主要的冠脉事件发生风险降低了35%(P=0.003);并可极其显著的将颈动脉、颅内动脉、冠状动脉和周围血管血运重建等介入操作的危险降低45%(P<0.001);服用阿托伐他汀片80 mg/d可使缺血性卒中的整体危险降低22%。无论这些MCA M1段有狭窄/斑块的大动脉粥样硬化型患者LDl-C水平如何,强化其调脂治疗都十分的必要[14~20]。我国颅内动脉阻塞或狭窄发生率仍在较高水平,临床工作中我们应更广泛的采取CISS病因分型,指导缺血性脑卒中的二级预防。
