远隔缺血后适应通过调节反应性星形胶质细胞的可塑性改善小鼠缺血后脑组织的恢复
2019-03-13罗玉敏闵连秋
程 雪,罗玉敏,闵连秋,王 刚
缺血性脑卒中是一系列脑血管疾病导致死亡或严重的损伤,正在寻找广泛的治疗措施。其中一个潜在的治疗手段就是缺血后适应,它的神经保护被广泛的证实和认可,是目前发现的强烈的内源性缺血保护措施,缺血后适应是在缺血后给予一个非损伤性缺血适应,使对已严重缺血的器官产生保护作用。目前已有研究证实远隔缺血后适应能对心肌、肾脏、骨豁肌及脑产生缺血保护作用。四肢由于对缺血较耐受,容易观察缺血的程度,且容易实施缺血适应、具有事后性,目前已成为研究保护器官缺血/再灌注损伤方面的热点。很多研究表明缺血后适应能抑制缺血再灌注后炎性反应,提高脑循环,减少梗死面积,提高神经再生和血管再生[1],系统的研究它的临床应用及神经保护机制加速缺血后适应的临床转化[2]。到目前为止,更多的研究集中在脑缺血急性期的神经保护,在缺血性脑卒中恢复期对星形胶质细胞可塑性的研究尚无报道。
脑缺血后星形胶质细胞经历了快速的增生和肥大,反应性星形胶质细胞形成胶质瘢痕抑制轴索的再生和影响细胞外的微环境[3,4]。根据细胞形态学及解剖学定位,星形胶质细胞被分为两大主要亚型,原浆型(GS)和纤维型(GFAP)。GFAP是反应性星形细胞的标志, GFAP表达十种不同的亚型,最经典的亚型是GFAPα,在星形胶质细胞的白质和灰质表达,最多的可变剪切是GFAPδ,表达在较低水平, GFAPδ在许多疾病中被诱导变成反应性的星形胶质细胞[5,6],处理反应性星形胶质细胞亚型和GFAP亚型可提高缺血后神经元的可塑性。
1 材料和方法
1.1 动物和实验分组 成年雄性C57小鼠,质量22~24 g,购自北京维通利华实验动物技术有限公司。许可证号:SCXK(京)2008-0001。于恒温条件下饲养 (温度22 ℃~26 ℃,湿度56%~70%,12/12 h日夜循环)。63只小鼠被随机分为3组:(1)假手术组:小鼠和其他组一样经过同样的过程但不插入线栓;(2)模型组:给予大脑中动脉闭塞1 h再灌注;(3)RIPC组:大脑中动脉闭塞后给予RIPC。每组被分为两个亚组:3 d组(n=12)3只小鼠用于TTC染色,6只用于计算缺血侧半球的水肿及蛋白免疫印迹检测,3只小鼠用于免疫荧光检测;14 d组(n=9)6只用于计算缺血侧半球的萎缩和蛋白免疫印迹,3只用于免疫荧光。如果动物体重不符合需要被排除,所有的研究采用双盲。
1.2 小鼠模型的建立 建立局灶性脑缺血模型短暂性大脑中动脉闭塞(MCAO)模型。小鼠称重后采用4%~5%恩氟烷诱导麻醉并用面罩吸入1%~2%恩氟烷混合N2O∶O2(7∶3)维持麻醉。术中通过测量肛温、心率和平均动脉压来保持各项生理指标正常。将直径为0.19 mm线栓(货号701956PK5Re)缓慢插入至右颈总动脉,缺血1 h后拔出线栓,局灶的脑血流量通过经颅超声多普勒(PeriFlux System5000;Perimed,Sweden)观察证实。体温通过直肠探针检测,通过加热毯维持在(37.0±0.5)℃。MCAO再灌注后,小鼠被随机挑选即刻给予RIPC。为了造成肢体缺血,两个肢体末端用橡皮带做成一个小的橡皮管形成一个可逆性的勒除器。用勒除器结扎小鼠双后肢根部(约股动脉近端1/5~2/5的位置)阻断双侧股动脉,双侧股动脉被阻断10 min放开10 min,如此循环3次。在阻断的过程中,传感器置于双侧的足背动脉检测脉冲决定是否肢体的血流被阻断。如果脉冲消失证明肢体缺血,并且肢体变苍白。再灌注后,肢体恢复正常的粉红色。RIPC结束后,小鼠放回笼子里,观察它们的正常活动,包括行走、进食和睡眠。
1.3 转棒实验 小鼠的运动功能在自动化的旋转棒上被评估。小鼠被放在加速的旋转棒上(4~40 rpm over 120 s) 并且他们潜在的掉落次数被记录。在手术前3 d给予同样的训练。MCAO后,在3 d、14 d检测小鼠的情况。每天检测3次,取掉落的平均值进行统计。
1.4 检测梗死面积、半球水肿和脑萎缩 神经系统功能评定后,在再灌注3 d、14 d用10%水合氯醛致死剂量腹腔注射处死小鼠,距离大脑前极开始,在脑模具中切出冠状切片1 mm厚度脑片6片,将脑片放入TTC (TTC;Sigma,USA)溶液中,常温下20 min后捞出放入多聚甲醛固定液中,正常脑组织呈玫红色,梗死区脑组织呈白色,拍照。应用Image J软件分析梗死体积比率。梗死体积的计算根据下面的公式[7]:梗死体积%=[(非缺血侧面积总和-非梗死面积)/非缺血侧面积总和]×100%。相对脑水肿比率=[(缺血侧面积总和-非缺血侧面积总和)/非缺血侧面积总和]×100%。相对脑萎缩比率=[(非缺血侧面积总和-缺血侧面积总和)/非缺血侧面积总和]×100%[8]。
1.5 Western blot分析蛋白的表达 脑组织在3 d、14 d被收集,缺血侧脑组织在缓冲液中处理(RIPA;Cell Signaling Technology,USA),包括蛋白酶抑制剂(Thermo,USA)和用超声波细胞粉碎机粉碎组织细胞,在冰上静置1 h后用12000 g的低温离心机离心30 min;测蛋白浓度,之后以校正过的BCA标准蛋白吸光值对浓度(μg/ml)做图绘制标准曲线,使用标准曲线定量计算待测样品蛋白浓度。在Excel表中算出每100 μl需要加入的 Loading-Buffer的量,统一1 μl内的蛋白质含量。已经加入 Loading-Buffer 的标本-20 ℃冰箱冻存,剩余标本原液-80 ℃冰箱冻存。Western blot的操作按以前的方法[9],将醋酸纤维素膜浸入配置好的一抗溶液中4 ℃冰箱过夜; GFAP (1∶1000,Santa Cruz),GS(1∶1000,Abcam), GFAPa (1∶1000,Santa Cruz),GFAPδ (1∶1000,Abcam) 和 β-actin (1∶1000,Santa Cruz)。 然后加入二抗(1∶5000,Abgent,USA),通过凝胶成像系统扫描并分析目标条带的净光密度值和分子量。用 AlphaEaseFC图像分析软件计算出每个条带MBP及相对应的β-actin灰度值,并用(MBP灰度值)/(β-actin灰度值)计算出相对灰度值,进行统计分析。
1.6 免疫荧光 免疫荧光染色像以前的描述[10]。在再灌注3 d、14 d用10%水合氯醛致死剂量腹腔注射处死小鼠,脑组织冰冻切片复温后放入4%的多聚甲醛中固定,PBS冲洗后,用含有1%BSA、5%的山羊血清和0.1%的Triton X-100的PBS溶液20 ℃~25 ℃封闭1 h,以阻断非特异性结合位点。将封闭液洗掉加入按照一定比例稀释的一抗结合4 ℃孵育过夜。次日,将切片取出,然后加入荧光二抗,然后用防淬灭封片剂封片,在荧光显微镜(Olympus,Japan)下找到红色荧光和绿色荧光并拍照并用FV10-ASW 2.0软件分析。
2 结 果
2.1 RIPC 降低梗死面积、缺血半球脑水肿和脑萎缩,提高脑缺血小鼠的神经功能及生存率 5种方法测量脑组织的损伤:脑梗死体积、脑水肿、脑萎缩、神经功能评分、生存率。缺血在灌注后缺血半球的梗死体积(见图1A、B):缺血在灌注后定量分析显示缺血半球的梗死体积显著增加。RIPC治疗后显著降低缺血半球的梗死体积,由模型组的60%降低到40%。脑水肿是另一个常见的方法来评价缺血再灌注脑损伤。我们的数据显示RIPC能显著降低缺血再灌注3 d脑组织肿胀(见图1C、D)。为了研究RIPC在恢复期的保护作用,我们检测了脑缺血再灌注14 d脑萎缩的情况。我们发现RIPC在14 d能降低脑萎缩的程度(见图1E、F)。14 d的结果更显著的表明RIPC在急性期和恢复期对脑缺血再灌注都具有保护作用,为我们进一步研究RIPC的保护作用提供了形态学依据。神经功能评分我们选择了在缺血后3 d、14 d进行转棒实验。相对于MCAO组,RIPC能够显著降低缺血后运动功能缺陷,增加转棒的时间和路程,因此我们推断RIPC能够提高缺血后的神经功能(P<0.05,见图1G)。缺血再灌注后我们还检测了14 d的生存率,显示RIPC能提高缺血后的生存率,在MCAO组14 d,我们观察到几乎有50%的动物死亡,而RIPC组生存率从55%提高到77%,表明RIPC对脑缺血再灌注有显著的保护作用(见图1H)。
2.2 RIPC改变缺血诱导的GFAP和GS的表达 星形胶质细胞可塑性的适应性改变是脑水肿形成的主要原因[11]。星形胶质细胞的畸形生长会形成胶质瘢痕,影响神经修复。结果显示在3 d缺血后增加的GFAP的表达经过RIPC治疗后显著的降低,这意味着RIPC对GFAP有抑制作用 (见图2A、B)。 而且,RIPC不影响缺血在灌注后GS的表达(见图2A、C)。为了研究RIPC能否在恢复期影响反应性星形细胞胶质化,我们检测了缺血再灌注14 d,GFAP和GS蛋白水平的表达。结果显示缺血诱导的GFAP的表达经过RIPC治疗后没有显著的差异。GS的蛋白表达水平经RIPC治疗后显著升高(P<0.05,见图2D~F),说明在恢复期RIPC可能通过改变GS的表达发挥作用。同时,我们利用免疫荧光还观察了在皮质缺血周围区GFAP的情况。我们观察到在缺血周边区有大量增加的GFAP的表达,RIPC治疗后GFAP的表达有所减少(见图2G)。
2.3 RIPC 调节GFAP亚型的比例 星形胶质细胞不同的亚型在神经修复中发挥不同的作用。在正常的中枢神经系统中,GFAPδ∶GFAPα为1∶3是最适合的网络组成。WB的结果显示缺血再灌注3 d,小鼠缺血侧脑组织GFAPδ 的表达无明显的改变,而 GFAPα显著增加,导致 GFAPδ/GFAPα 的比率降低到1∶5;RIPC 治疗明显降低缺血后GFAPα的表达, 同时增加GFAPδ/GFAPα的比率(见图3A~D,P<0.05)。因此, RIPC 能调节它们的比率达到最佳的网络组成(见图3A~D)。然后,我们观察缺血再灌注14 d后GFAP亚型的变化。WB结果显示,经RIPC治疗后GFAPα 和 GFAPδ 没有明显的变化(见图3E~H)。但是RIPC能调节它们的比率达到最适的网络构成(见图3H,P<0.05)。

图1 远隔缺血后适应能提高缺血小鼠的存活率,减少神经功能缺损、梗死体积、脑半球肿胀和脑萎缩。A、B:据脑区2、3、5-三苯基四唑氯化物染色的区域损失来测定梗死灶的体积(N=3),给予RIPC后,梗死面积减少(P<0.05,与MCAO组相比)。C、D:与MCAO组相比,RIPC在3 d能显著降低缺血侧半球的肿胀(N=6) (P<0.05)。E、F:RIPC在14 d能显著降低缺血侧半球的萎缩(N=6) (P<0.05,与MCAO组相比)。 G:缺血再灌注后3 d、14 d用转棒能力来评价神经功能。给予RIPC后,3 d、14 d的转棒能力均有所提高(P<0.05)。H:RIPC 14 d的生存率显著提高

图2 远隔缺血后适应改变缺血诱导的GFAP和GS的表达。在缺血再灌注3 d、14 d,我们用WB检测缺血侧GFAP及GS的表达。A~C:显示缺血再灌注3 d后GFAP及GS的表达显著升高,给予RIPC治疗后,GFAP显著降低(P<0.05,与MCAO组相比),但GS无明显变化(N=6)。D~F:结果显示,在缺血再灌注14 d,GFAP逐渐增多(P<0.05,与SHAM组相比),GS无明显变化(与SHAM组相比)。 RIPC治疗后,GFAP无明显变化(与MCAO组相比),但GS的表达显著升高(P<0.05,与MCAO组相比) (N=6)。G:免疫荧光观察缺血周边区GFAP的表达(N=3)(×20)
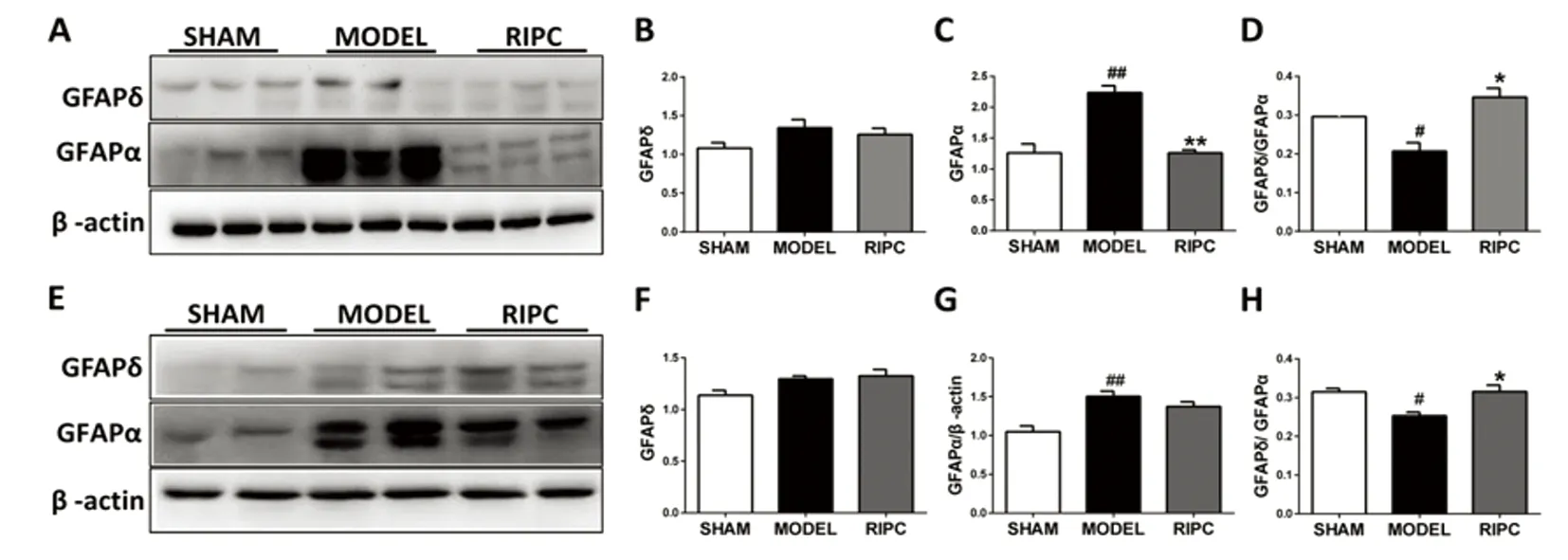
图3 远隔缺血后适应调节星形胶质细胞亚型的比例。缺血再灌注3 d,A~D:可以看出MCAO后GFAPδ 的表达无明显的改变而 GFAPα显著增加(P<0.05与SHAM组相比),导致 GFAPδ/GFAPα 的比率降低到1∶5。RIPC治疗明显降低缺血后GFAPα的表达(P<0.05与MCAO组相比), 同时增加GFAPδ/GFAPα的比率(P<0.05与MCAO组相比)。14 d,E~H:WB检测缺血侧GFAPα 和 GFAPδ 的表达(N=6):MCAO后GFAPα的表达增加(P<0.05与SHAM组相比),RIPC治疗后GFAPα 和 GFAPδ 没有明显的变化,但是RIPC能调节它们的比率(P<0.05与MCAO组相比)
3 讨 论
脑缺血导致过表达的激活和增生的星形胶质细胞,导致星形胶质细胞瘢痕的形成。细胞分子结构的改变,导致星形胶质细胞从营养保护神经元转为释放神经毒性,引起严重的神经元损害[12~14]。我们的研究证实RIPC能减少激活的星形胶质细胞,因此提高神经功能,减少死亡率,减少3 d梗死面积和缺血半球的脑肿胀,减少14 d的脑萎缩。
星形胶质细胞的活化是脑缺血的标志。由于细胞形态学的不同,星形胶质细胞组成成分也明显不同。基因表达对损伤反应有益和有害双重反应。星形胶质细胞分为两大主要亚型,原浆型和纤维型。纤维型星形胶质细胞主要分布在白质,与少突胶质细胞相互作用提高髓鞘形成[15]。原浆型星形胶质细胞与神经元和毛细血管联系,构成神经血管单元。因此,星形胶质细胞在突触的发展和血脑屏障的调节中发挥重要的作用。GS是原浆型星形胶质细胞的标志,并且有许多功能,例如调节谷氨酸盐的代谢、脑氨的解毒和同化、神经递质的循环和神经信号的终止[16]。卒中后3 d,星形胶质细胞的亚型标志物GFAP和GS均增高,RIPC能显著的降低GFAP的表达,但不能降低GS的表达水平,表明RIPC能显著降低纤维型星形胶质细胞的表达,但对原浆型星形胶质细胞无影响。14 d缺血诱导的GFAP的表达经过RIPC治疗后没有显著的差异。但是GS的蛋白表达水平经RIPC治疗后显著升高,以上的数据证实了持续的RIPC能够影响星形胶质细胞亚型的表达,使星形胶质细胞从纤维型转变为原浆型,因此降低了谷氨酸诱导的兴奋性毒性及增加缺血后神经元的保护作用。
此外,反应性星形胶质细胞集中在白质并释放大量的酸性蛋白,这在胶质瘢痕的形成过程中起着关键作用[17]。GFAP基因是被剪切的结合体,到目前为止,人类大脑中已经发现了10种不同的亚型。最经典的亚型是GFAPa,最大量的可变剪切变体是GFAPδ[18],在健康的大脑中,GFAPa在脑室中表现为灰质和白质的星形胶质细胞,软膜下和沿脑室起源于神经组织的星形胶质细胞,而GFAPδ则表现在较低的水平,主要表现在软膜下和室管膜下起源于神经组织的星形胶质细胞。高表达的GFAPδ导致细胞网络组的倒塌[19,20],由于GFAPδ的增加或GFAPa的减少导致比率的改变会改变层粘蛋白和网蛋白的表达,影响细胞的黏附和迁移。已有报道GFAPδ在许多疾病中被诱导为反应性的星形胶质细胞[21]。本实验中,缺血后GFAPa的表达显著增高,但是GFAPδ的表达无明显改变,RIPC治疗后能降低的蛋白表达并明显增加GFAPδ/GFAPα的比率,已有实验显示GFAPδ/GFAPα的比率为1∶3是GFAP最适的网络组成[22],在目前的研究中,RIPC不仅减少了总GFAP的表达,而且还调整了GFAPδ/GFAPα的比例,改变了GFAP的亚型,从而为GFAP的最佳网络组成提供了帮助,并进一步改善了卒中后的神经功能。总而言之,GFAP在许多细胞过程中发挥作用。GFAP表达的改变可以促进突触功能,改变谷氨酸-谷氨酰胺的代谢,从而扩大了星形细胞膜所接触的神经元表面的面积。而且,GFAP亚型表达的改变能导致功能的改变,GFAP亚型比率的改变也能调整星形胶质细胞的功能并影响周围的神经元。必须指出的是进一步研究GFAP特定的引物和阐明机制,结果,功能影响星形胶质细胞不同的亚群特定的网络组成,这对RIPC的进一步治疗和临床转化是有益的。
总之,目前的研究显示 RIPC 可通过调节反应性星形胶质细胞的可塑性,在卒中后帮助恢复脑的神经功能。RIPC能直接影响胶质瘢痕的形成可能与减少梗死面积相关,这需要进一步证实。这个发现为RIPC提高缺血后神经功能的恢复提供了进一步的证据,并且表明长期实施RIPC可以减轻卒中后损伤。
