线粒体钙单向转运体在β淀粉样蛋白诱导小胶质细胞凋亡中的作用机制
2019-03-13谢南昌余梦嫣李英娇孟祥荷连亚军
谢南昌,余梦嫣,王 翠,李英娇,孟祥荷,连亚军
阿尔兹海默病(Alzheimer’s disease,AD)是一种进展性中枢神经系统退行性疾病,以记忆力下降、认知功能障碍为主要临床特征[1]。细胞外β淀粉样蛋白(β-amyloid peptide,Aβ)沉积形成神经炎性斑(neuritic plaques,NP)是AD主要病理特点,指Aβ沉积周围出现大量反应性小胶质细胞。生理状态下,小胶质细胞处于静止期,在AD等神经退行性疾病中,小胶质细胞发生活化并吞噬清除β-淀粉样蛋白,但过度活化或凋亡导致促炎性细胞因子(如IL-1β、IL-6、TNF-α、NO等)释放,从而导致神经毒性或一系列不可控炎症反应[2]。因此在AD治疗靶向目标上,越来越多的目光移向小胶质细胞。
研究证明[3,4]活化的小胶质细胞发挥吞噬作用或促炎症因子的释放等功能均是钙离子依赖性的。最近鉴定出的钙离子单向转运体(mitochondrial calcium uniporter,MCU)是一种位于线粒体内膜上介导钙离子内流的选择性钙通道,在细胞和线粒体钙离子浓度调节过程中发挥重要作用[5]。以往研究[6,7]证实ER-线粒体串话参与Aβ诱导的神经元凋亡,且线粒体功能损伤增强了Aβ诱导的内质网应激(endoplasmic reticulum stress,ERS)。ERS时内质网分子伴侣葡萄糖调节蛋白质(glucose regulating protein 78,GRP78)首先与3种跨膜蛋白解离而被激活,启动ERS生存途径。ERS过度时,则启动ERS凋亡途径,相关凋亡分子CHOP(C/EBP homologous protein,CHOP)和caspase-12上调表达。最近研究[8,9]发现MCU在心肌损伤及脑缺血再灌注损伤中发挥重要作用,但MCU在Aβ诱导小胶质细胞凋亡中的作用仍未阐明。
本研究中,我们采用MCU抑制剂Ru360[10]和激动剂Spermine[11]来研究MCU在Aβ诱导体外原代培养小胶质细胞凋亡中的作用及机制。并进一步采用线粒体特异性抗氧化剂MitoQ来明确线粒体氧化应激与ERS之间的关系。
1 材料与方法
1.1 材料 DMEM 培养基、FBS(购自美国Hyclone公司);Ru360(购自美国Millipore 公司);Spermine、Aβ25-35(购自美国 Sigma 公司);MitoQ(购自新西兰MedChemExpress公司);Rhod-2/AM(购自美国Life Technologies公司);蓖麻凝集素-1(ricinus commol/Lunis agglutinin-1,RCA-1)抗体(购自美国 Vector 公司);MitoSOX 荧光探针(购自美国Invitrogen公司);GRP78、CHOP、caspase-12抗体(购自美国CST公司);β-actin(购自武汉三鹰公司);Annexin V-FITC/PI 双染凋亡检测试剂盒、全蛋白提取试剂盒(购自南京建成生物工程研究所)。
1.2 方法
1.2.1 原代小胶质细胞的制备与分组 取BALB/C新生小鼠(购自河南省动物实验中心),无菌条件下分离出双侧大脑皮质,剪成小块,用0.125%胰蛋白酶溶液在37 ℃恒温水浴消化20 min后加入培养液以终止消化。用滴管反复吹打成细胞悬液,200目尼龙网过滤,过滤液以1000 r/min离心,弃上清,加入培养液重悬。然后接种于培养瓶中培养至第10~14天时,用摇床固定以180 rpm震荡2 h,将振摇下来的小胶质细胞接种于培养瓶中培养。小胶质细胞纯度通过RCA-1染色验证>95%。将纯化的小胶质细胞随机分为5组,分别是对照组、Aβ25-35组、Ru360组、Spermine组、MitoQ组。对照组未特殊处理。Aβ25-35组用20 μmol/L Aβ25-35处理小胶质细胞24 h。Ru360组和Spermine组分别用5 μmol/L Ru360和10 μmol/L Spermine预处理原代小胶质细胞1 h,然后二者均用20 μmol/L Aβ25-35处理24 h。MitoQ组先用0.1 μmol/L MitoQ处理6 h,再20 μmol/L Aβ25-35处理24 h。实验程序经郑州大学委员会批准,动物实验操作规范严格参照国际标准。
1.2.2 Aβ25-35聚合物的制备 使用HFIP溶解至1 mmol/L,在生物安全柜中蒸发去除HFIP形成肽膜。-80 ℃保存。使用时将肽膜溶于无水DMSO中至5 mmol/L(储备溶液)。使用时用冷PBS将溶液稀释至100 μmol/L,4 ℃孵育24 h,并在4 ℃以14,000 g离心10 min,将含有可溶性Aβ25-35寡聚体的上清液转移至干净的试管中4 ℃保存备用。
1.2.3 线粒体钙离子浓度测定 首先用HEPES 缓冲液冲洗原代小胶质细胞,然后用含有11 μmol/L钙离子荧光探针Rhod-2/AM的HEPES缓冲液在低温下孵育15 min。使用分光光度计在575 nm的激发波长和605 nm的发射波长下测量荧光。
1.2.4 流式细胞术检测 先收集细胞并用冰冷的PBS洗涤两次,于200 μl结合缓冲液悬浮培养。 细胞重悬后,每个样品中各加入5 μl 膜联蛋白V-FITC和5 μl碘化丙锭。然后在室温下在黑暗中孵育10 min。在FACScan流式细胞仪上进行检测分析。
1.2.5 线粒体ROS生成水平检测 使用线粒体荧光探针MitoSOX评估线粒体ROS生成水平。用5 μmol/L MitoSOX工作液37 ℃避光孵育胰蛋白酶已处理过的原代小胶质细胞15 min,PBS清洗,然后通过流式细胞术分析ROS生成水平,结果以各单位的荧光强度表示。
1.2.6 Western blotting分析 通过SDS-聚丙烯酰胺凝胶电泳分离30 μg蛋白质,然后转移到PVDF膜上。室温下膜在5%脱脂奶粉组成的封闭溶液中封闭2 h。 然后用一抗GRP78(1∶1000)、CHOP(1∶1000)和caspase-12(1∶1000)抗体在4 ℃过夜孵育膜,内参为β-actin蛋白,用抗β-actin抗体(1∶2000)检测)。1×TBST溶液清洗3次,每次10 min。二抗中室温下孵育1 h,再1×TBST溶液清洗3次,每次10 min。用ECL化学发光液曝光,使用分光密度计的光密度分析来量化条带强度。
2 结 果
2.1 MCU对Aβ25-35诱导原代小胶质细胞凋亡的作用 通过流式细胞术检测凋亡细胞发现,和对照组相比,Aβ25-35组细胞凋亡明显增多(P<0.05);与Aβ25-35组相比,Ru360组小胶质细胞凋亡明显减少,而Spermine组小胶质细胞凋亡明显增多(P<0.05)(见图1)。
2.2 MCU对线粒体钙离子浓度和线粒体ROS生成水平的作用 与对照组相比,Aβ25-35组原代小胶质细胞线粒体钙离子浓度和线粒体ROS生成水平明显增加升高(P<0.05);与Aβ25-35组相比,Ru360组线粒体钙离子浓度和线粒体ROS生成水平明显降低,而Spermine组线粒体钙离子浓度和线粒体ROS生成水平明显升高(P<0.05)(见图2)。
2.3 MCU对GRP78、CHOP和caspase-12蛋白表达影响
2.4 MitoQ对ERS的激活作用 与对照组相比,Aβ25-35组原代小胶质细胞GRP78、CHOP和caspase-12的表达水平明显增加(P<0.05);与Aβ25-35组相比,Ru360减少了GRP78、CHOP和caspase-12表达水平的升高,而Spermine增加了GRP78、CHOP和caspase-12表达水平的升高(P<0.05)(见图3)。与Aβ25-35组相比,MitoQ明显降低了线粒体ROS生成水平,并且MitoQ预处理可降低GRP78、CHOP和caspase-12表达(见图4)。
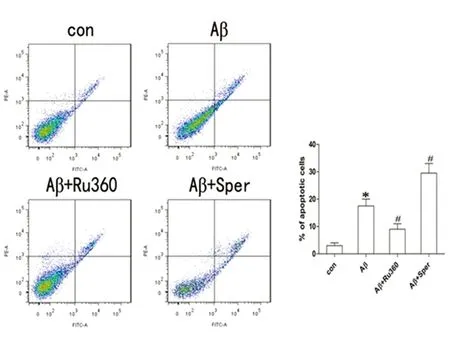
与对照组比较*P<0.05;与Aβ25-35组比较#P<0.05(各组实验重复5次)
图1 流式细胞术检测正常对照组、Aβ25-35组、Aβ25-35+Ru360组、Aβ25-35+Spermine组细胞凋亡
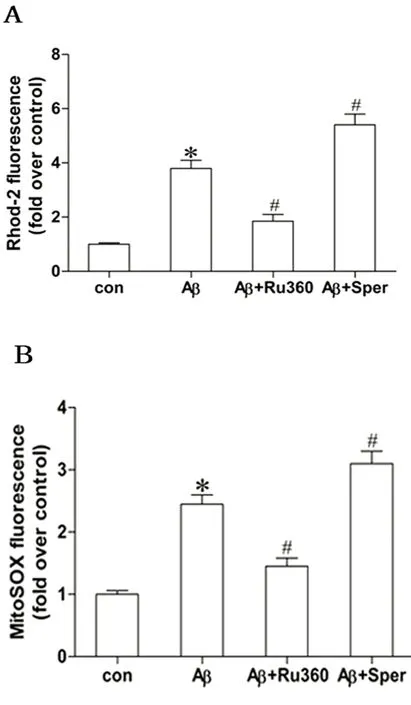
A:与对照组比较*P<0.05;与Aβ25-35组比较#P<0.05。B:与对照组比较*P<0.05;与Aβ25-35组比较#P<0.05(各组实验重复5次)
图2 A:Ru360和Spermine对Aβ25-35诱导的小胶质细胞线粒体钙离子浓度的影响;B:Ru360和Spermine对Aβ25-35诱导的小胶质细胞线粒体ROS生成的影响

与对照组比较*P<0.05;与Aβ25-35组比较#P<0.05 (各组实验重复5次)
图3 Ru360和Spermine对Aβ25-35诱导的小胶质细胞内质网应激通路蛋白CHOP、GRP78、caspase-12表达的影响

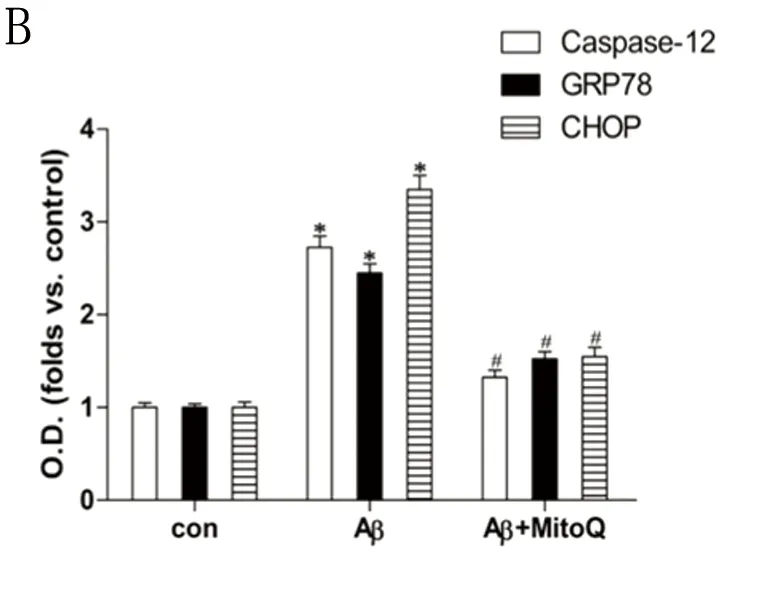
A:与对照组比较*P<0.05;与Aβ25-35 组比较#P<0.05。B:与对照组比较*P<0.05;与Aβ25-35组比较#P<0.05(各组实验重复5次)
图4 A:MitoQ对Aβ25-35诱导小胶质细胞线粒体ROS生成水平的影响;B:MitoQ对Aβ25-35诱导小胶质细胞内质网应激通路蛋白CHOP、GRP78和caspase-12表达的影响
3 讨 论
本研究中,我们证实了MCU在Aβ25-35诱导小胶质细胞凋亡中发挥重要作用,发现抑制MCU可通过缓解线粒体钙超载、氧化应激及ERS对Aβ25-35诱导小胶质细胞凋亡发挥神经保护作用,而激活MCU发挥相反作用。且进一步发现采用线粒体特异性抗氧化剂MitoQ干预缓解了ERS,表明线粒体氧化应激介导了Aβ25-35诱导小胶质细胞ERS的激活。
MCU是钙离子进入线粒体的重要通道,当线粒体与内质网之间形成瞬间高浓度Ca2+微区[12]或结合激动剂Spermine时,MCU开放从而导致线粒体钙离子浓度升高。生理状态下,线粒体基质可代偿增多的钙离子,但线粒体钙超载会导致线粒体通透性转运孔(mitochondrial permeability transition pore,mPTP)开放,并可刺激ROS生成,引起线粒体膜电位降低,细胞色素C释放,导致细胞凋亡。氧化应激是神经退行性疾病如AD的发病机制之一[13,14],其在Aβ介导的神经毒性过程中起着重要作用[15]。本研究发现Aβ25-35诱导的小胶质细胞线粒体Ca2+浓度和ROS生成水平升高,而MCU抑制剂逆转了线粒体钙超载和氧化应激。以往研究发现Spermine可增强缺血再灌注引起的氧化应激,并且MCU抑制剂可降低因脑和心脏细胞中的铁超载引起的ROS产生[16~19],这些发现与本研究结果一致。
ERS时,GRP78表达上调促进蛋白正确折叠、协助错误折叠蛋白的转移以恢复ER稳态,但过度或持续的ERS可激活CHOP、caspase-12和JNK通路诱导细胞程序性死亡。CHOP可通过上调促凋亡基因Bax/Bak、下调抗凋亡基因Bcl-2促进细胞凋亡[20],而caspase-12活化后激活caspase-9、caspase-3从而导致细胞凋亡。以往研究[6,7]证实线粒体-ER串话参与Aβ诱导的神经元凋亡,本研究发现Aβ25-35诱导小胶质细胞内质网应激相关蛋白GRP78、CHOP和caspase-12表达增加,提示Aβ25-35激活小胶质细胞内质网应激反应。我们进一步发现MCU抑制剂显著降低GRP78、CHOP和caspase-12表达并减少小胶质细胞凋亡,而Spermine增加GRP78、CHOP和caspase-12表达并增加小胶质细胞凋亡,表明MCU调控的ERS在Aβ诱导的小胶质细胞凋亡中发挥重要作用。
许多病理状态下,氧化应激与内质网应激密切相关,氧化应激可以破坏ER功能,并诱发内质网应激[21,22]。MitoQ是目前线粒体靶向抗氧化剂中最具代表性的。本研究发现MitoQ抑制了Aβ25-35诱导小胶质细胞线粒体ROS产生的同时并降低GRP78、CHOP和caspase-12表达,因此提示线粒体ROS介导的ERS在Aβ25-35诱导小胶质细胞凋亡中发挥作用,与以往研究氧化还原信号传导途径支配ERS相一致[23,24]。
综上所述,抑制MCU对Aβ诱导的小胶质细胞凋亡发挥神经保护作用,且氧化应激介导的ERS可能在MCU参与Aβ25-35诱导的小胶质细胞凋亡中发挥重要作用。
