高分散纳米薄水铝石和纳米氧化铝的制备及其对甲基橙的吸附性能
2019-03-13吴彩红郑国源王吉林莫淑一邹正光
吴彩红 郑国源*, 王吉林 莫淑一 邹正光 龙 飞*,
(1桂林理工大学材料科学与工程学院,有色金属及材料加工新技术教育部重点实验室,桂林 541004)
(2桂林理工大学广西有色金属隐伏矿床勘查及材料开发协同创新中心,桂林 541004)
0 引 言
自20世纪以来,由于工业化进程的加速,染料废水排放量剧增。这些废水中含有大量的芳香族、稠环芳香族或杂环化合物等有毒且难以被生物降解的物质[1-3],并且此类物质会通过食物链进入人体,诱发癌症,严重危害人类健康。因此,如何有效降解或去除废水中的有机染料已经成为研究热点[4-5]。去除废水中有机染料的方法有多种,如催化臭氧化法、高级氧化法、膜分离法、光催化降解法和吸附法[6],其中,吸附法因去污效率高和低成本被广泛用于去除水中有机染料[7]。
近年来,由低维纳米材料(如纳米粒子、纳米纤维、纳米带等)组成的3D(三维)结构材料因具有优异的吸附性能受到研究者们的广泛关注[8]。其中,薄水铝石因具有片层状结构 (在这结构中,1个铝离子(Al3+)与周围6个氧离子(O2-)形成了1个变形的八面体且氧离子的共有八面体边界是由双层锯齿形的氢键相连而成的)而被广泛用作催化剂载体、助催化剂、吸附剂和药物佐剂等[9-11]。此外,不同维度、形貌、分散性、表面性质、尺寸及组成结构单元的γ-AlO(OH)会有不同的吸附及催化等性能。另外,γ-AlO(OH)材料还是合成纳米级Al2O3的关键前驱体。因为维度、形貌、分散性和尺寸等可以在从γ-AlOOH到Al2O3的相变期间保留[12]。因此,控制薄水铝石纳米结构的分散性和形貌不仅是改善其自身性能的因素还是改变Al2O3材料性质的关键参数。为了满足各种应用的需求,已经开发了各种方法合成薄水铝石,如溶胶-凝胶法[13]、沉淀法[14]和模板水热法[15]。然而,通过这些方法所获得的样品通常具有尺寸较大、形貌不均匀和产品易结块等缺点。
我们通过水热法结合冷冻干燥手段制备了高分散的纳米结构γ-AlO(OH)。并将制备得到的前驱体在500和1 100℃下对其进行煅烧分别生成了γ-Al2O3和θ-Al2O3。此合成手段因为在其呈悬浊液状态时进行低温干燥,使所得产物的颗粒更细、分散性更高,同时避免了传统手段中因长时间高温干燥而结块的缺点。另外,研究了所得产品对甲基橙的吸附性能,它们均表现出了高的吸附容量,这主要是因为产品具有高度分散的捆扎状结构。相比纳米氧化铝,纳米薄水铝石具有更高的吸附容量,这除了因为具有多孔结构和更高的表面正电荷,还因为在水溶液中薄水铝石表面有大量的羟基基团(-OH),通过这些基团或基团的变形与被吸附物质发生吸附作用提高了对有机染料的吸附性能。
1 实验过程
1.1 试 剂
硝酸铝(Al(NO3)3·9H2O,分子量为 375.14),尿素(CO(NH2)2,分子量为 60.06),甲基橙(MO,分子量为327.35)。所用试剂均购于国药集团化学试剂有限公司,且均为分析纯。所用水为去离子水(Milli-Q,18.2 MΩ·cm)。
1.2 样品制备
将9.38 g Al(NO3)3·9H2O加入50 mL去离子水中,搅拌溶解形成溶液A;将3 g CO(NH2)2加入15 mL去离子水中,搅拌溶解形成溶液B;在剧烈搅拌下将B逐滴加入A中,持续搅拌15 min。然后把所得溶液移入到100 mL聚四氟乙烯内衬的不锈钢反应釜内,密封后置于烘箱,在140℃下保温10 h。待其冷却至室温后收集内衬底部的白色沉淀,用去离子水洗涤6次后冷冻干燥20 h得到目标产物γ-AlO(OH)。最后,将 γ-AlO(OH)分别在 500 和 1 100 ℃下煅烧2 h得到煅烧产物。
1.3 样品表征
采用Panalytical X′Pert PRO型X射线粉末衍射仪(工作电压:40 kV,工作电流:40 mA,辐射源:铜靶Kα辐射,波长:λ=0.154 18 nm,扫描范围:5°~80°)分析产物的物相组成;采用Thermo Nexus 470型傅里叶变换红外光谱仪(基底:KBr)分析产物的红外光谱;采用S-4800型场发射扫描电镜(加速电压:0.5~30 kV)和JEM-2100F型透射电镜(加速电压:200 kV)表征产物的形貌与微观结构;采用NOVA-1200e型分析仪测量N2吸附-脱附等温线(-196℃);用多点 BET法和 Barrett-Joyner-Halenda(BJH)模型分别计算比表面积和孔结构;使用ζ电位仪(nano-zs)测量产物的ζ电位;使用UV-3600型分光光度计(测量范围:200~600 nm)测量溶液的吸光度。
1.4 产物的吸附性能测试
配制50 mL 200 mg·L-1的MO溶液,称取50 mg活性产物作为吸附剂加入到MO溶液中,用0.1 mol·L-1HNO3或1 mol·L-1NaOH来调节溶液的pH值,随后在暗室条件以500 r·min-1的搅拌速度对前述混合液进行搅拌。在搅拌适当的时间后,从悬浮液中取出水样(3 mL)。通过离心获得离心液,并且使用UV-Vis分光光度计测量离心溶液的吸光度。通过下式计算瞬时吸附量 qt(mg·g-1)和平衡吸附量 qe(mg·g-1)[16]:
式中,C0(mg·L-1)是初始的 MO 浓度;Ce(mg·L-1)和 Ct(mg·L-1)分别是平衡时和任意时间 t(min)的 MO浓度;V(L)是溶液的体积,m(g)是吸附剂的质量[17]。
1.5 解吸实验
MO的解吸实验使用超纯水作为清洗剂,用乙醇溶液作为解吸剂。将用过的样品用水除去未被吸附上的MO。然后将负载了MO的样品加入乙醇溶液剧烈搅拌并离心。离心后,将获得的样品冷冻干燥。然后将得到的粉末样品进行连续的吸附-解吸循环。
2 结果与讨论
2.1 产物的结构与形貌特征
图1分别为水热合成产物及不同煅烧温度产物的XRD图。水热合成温度为140℃,保温时间为10 h,反应得到产物为单一的γ-AlO(OH)(PDF No.21-1307)。 其 XRD 图在 2θ为 14.3°、38.1°、48.8°、64.8°、71.9°出现的衍射峰分别对应于 (020)、(120)、(031)、(051)、(002)、(251)晶面衍射峰。 水热产物经过500℃煅烧之后,产物的衍射峰发生了变化,XRD图在 2θ为 39.4°、45.9°、66.9°出现的衍射峰分别对应于(111)、(200)、(220)晶面衍射峰,对应的物相为 γ-Al2O3(PDF No.29-0063)。产物经过1 100℃煅烧后,衍射峰强度变强,2θ为 32.8°、36.8°、67.5°出现的衍射峰分别对应于 θ-Al2O3(PDF No.35-0121)的(202)、(111)、(215)晶面衍射峰。 由此可知,γ-AlO(OH)在经过500和1 100℃煅烧之后,其晶体结构发生了改变,结构由 γ-AlO(OH)→γ-Al2O3→θ-Al2O3转变。

图1 γ-AlO(OH)(A)、γ-Al2O3(B)和 θ-Al2O3(C)的XRD图Fig.1 XRD patterns of γ-AlO(OH)(A),γ-Al2O3(B)and θ-Al2O3(C)
图2 为 γ-AlO(OH)、γ-Al2O3和 θ-Al2O3样品的FTIR图谱。由图可知,三者分别在1 633、1 635和1 636 cm-1处的吸收带是由于表面吸附的水分子的弯曲振动所致[18]。在γ-AlO(OH)谱图中,位于3 111和3 325 cm-1的吸收带分别对应于(Al)O-H的不对称伸缩振动νas和对称伸缩振动νs[19]。在1 066 cm-1处的吸收带为氢键的振动[20]。此外,位于481,636和749 cm-1处的峰可归属于Al-O键的振动[21]。在γ-Al2O3的FTIR光谱中,位于727和576 cm-1的吸收带可归属于四配位Al-O的振动。从θ-Al2O3谱图中可以发现,在500~1 000 cm-1波数段出现了5个明显的特征吸收峰, 分别位于 924、827、764、636 和565 cm-1处。这些峰归属于AlO4以及AlO6紧密结构中的 Al-O振动。此外,γ-Al2O3和 θ-Al2O3分别在3 451和3 445 cm-1处的吸收峰是表面吸附水的OH 伸缩振动所致[22]。 与 γ-Al2O3和 θ-Al2O3相比,γ-AlO(OH)含有大量的羟基基团,通过这些基团或基团的变形与被吸附物质发生的吸附作用能提高对染料离子的吸附容量[23]。

图2 在 400~4 000 cm-1范围内 γ-AlO(OH)、γ-Al2O3和θ-Al2O3的 FTIR 谱图Fig.2 FTIR spectra of γ-AlO(OH),γ-Al2O3and θ-Al2O3 in a range of 400~4 000 cm-1
图3 中,图3(a~c)为样品的发射扫描电镜图(FESEM),(d~i)为样品的透射电镜图和高分辨透射电镜图。图3(a~c)中显示所制备的样品是由纳米纤维组成的高分散的捆扎状结构,并且这些高度分散的结构搭接形成具有大量孔洞的网络结构。这种结构对样品吸附MO是有利的。捆扎状结构的长度为2~3 μm,宽度为 0.2~0.4 μm。 每个结构都是由纳米纤维(长度为 0.5~1 μm,宽度为 25~85 nm)组装而成。与其他方法合成的产物 (如Cai等用无模版水热法制备的 γ-AlOOH[24]和 γ-Al2O3[25]、刘辉等[26]用微波水热法制备的片状结构γ-AlOOH和γ-Al2O3和Cai等[27]用酒石酸钠介导相变法合成的勃姆石空心核/壳和空心微球)相比,本文所制备的产物分散性更高,形态更均匀和完整,结构之间呈搭接状态,而不是其他文献所呈现的粘结状态。因此本文所制备的产物具有更高的吸附性能。 从 γ-AlO(OH)、γ-Al2O3和 θ-Al2O3的TEM图中可以观察到γ-AlO(OH)经煅烧生成γ-Al2O3后,样品表面出现了大量孔洞,但当继续升温生成θ-Al2O3后,样品表面的孔洞完全消失(图3(d~f))。 HRTEM 图中的晶面间距 0.186、0.198 和0.202 nm 分别对应 γ-AlO(OH)、γ-Al2O3和 θ-Al2O3的(051)、(200)和(211)晶面((图 3(g~i))。
图4(a,b)分别为产物的N2吸附-脱附等温线和BJH孔径分布。此外,样品的比表面积、孔体积和平均孔径列于表1中。图4(a)表明在相对压力(P/P0)为0.4~1.0的范围内出现了滞后现象,该滞后环类型属于Ⅳ型,表明所制备的3种样品均具有介孔结构[28]。并且回滞环的形状类似于类型H3,表明样品具有狭缝状的孔[29]。在相对压强接近1.0时等温线显示高的吸附值,这是典型的介孔和大孔材料[30]。图4(b)为由BJH方法计算的各样品的吸脱附等温线孔径分布图,分析表明制备的样品孔径分布较窄。如表1所示,γ-AlO(OH)、γ-Al2O3和 θ-Al2O3的比表面积分别为 106、221 和 56 m2·g-1;孔体积分别为 0.133、0.213和 0.076 cm3·g-1; 平均孔径分别为 5.1、3.8 和 5.4 nm,证实3种材料都形成了主要包含微孔和中孔的多孔结构。而且由γ-AlO(OH)转变成γ-Al2O3过程中,比表面积和孔体积都增大,这是由于在烧结过程中γ-AlO(OH)中的结晶水蒸发而留下大量孔洞。然而,当γ-Al2O3转变成θ-Al2O3后,孔体积和比表面积都减小,这可能是由于在继续升温的情况下,氧化铝晶粒生长填满了样品的孔洞。这与TEM的结果保持一致。

图3 γ-AlO(OH)(a,d,g),γ-Al2O3(b,e,h)和 θ-Al2O3(c,f,i)的 FESEM,TEM 和 HRTEM 图Fig.3 FESEM,TEM and HRTEM images of γ-AlO(OH)(a,d,g),γ-Al2O3(b,e,h)and θ-Al2O3(c,f,i)
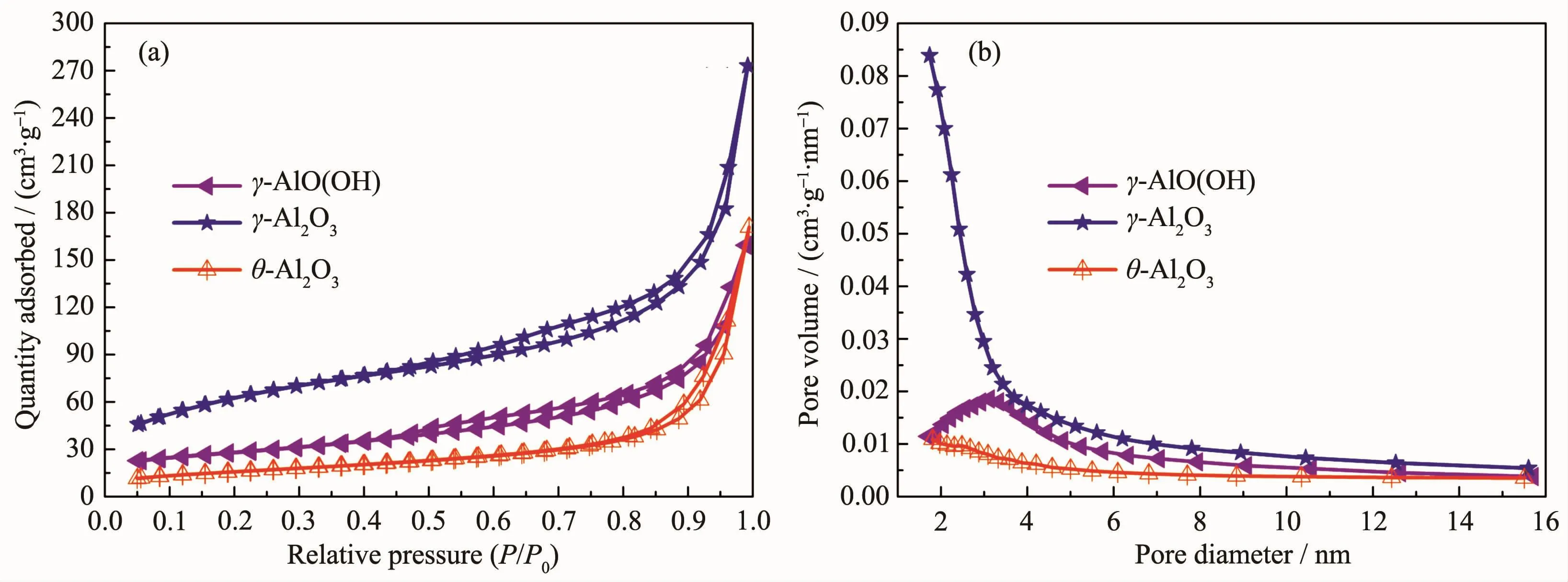
图4 产物的N2吸附-解吸等温线曲线(a)和孔径分布曲线 (b)Fig.4 N2adsorption-desorption isotherm curve(a)and pore size distribution curve(b)of various materials
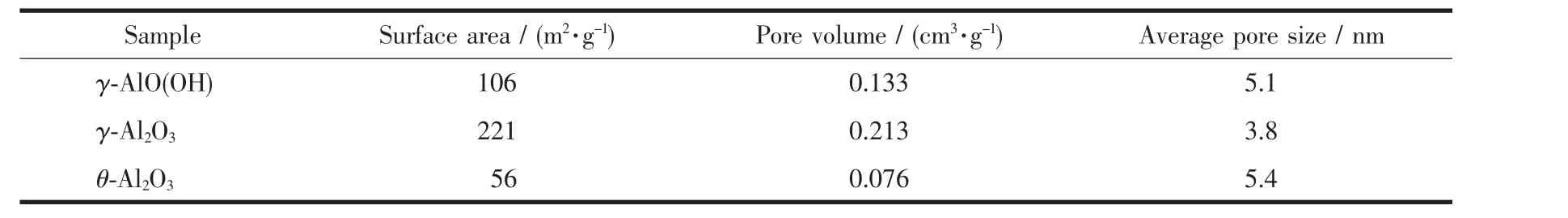
表1 γ-AlO(OH)、γ-Al2O3和 θ-Al2O3的织构性质Table 1 Textural properties of γ-AlO(OH),γ-Al2O3and θ-Al2O3
2.2 MO溶液pH值对产物吸附性能的影响
由于溶液的pH值会影响吸附剂的表面电荷,溶液的pH值在吸附过程中起着重要作用[31]。图5(a)显示了初始溶液pH值对γ-AlO(OH)吸附MO的影响。对于MO吸附,当溶液的pH值从2增加到3,样品对 MO的平衡吸附量从 179.4 mg·g-1增加到183.3 mg·g-1,并且在pH=3时达到最高平衡吸附量。但随着MO溶液pH值的继续升高,样品对MO的平衡吸附量随之下降。这表明合成后的样品倾向于在酸性溶液中能更有效地吸附MO。当MO溶解在水溶液中时,磺酸盐基团(D-SO3Na,图5(a)插图)将电离成染色分子阴离子(D-SO3-)和阳离子(Na+)[32]。因此,产物表面带正电荷越多对MO的吸附越有利。在不同初始溶液pH值下表征了γ-AlO(OH)的ζ电位(图5(b))。如图5(b)所示,初始溶液pH值在2~8之间时γ-AlO(OH)表面带正电,但当pH值增加到10时γ-AlO(OH)表面呈负电。并且ζ电位值从大到小为pH=3(22.57 mV)>pH=2(20.08 mV)>pH=4(12.68 mV)>pH=6(11.63 mV)>pH=8(4.99 mV)>pH=10(-12.38 mV)。 这表明γ-AlO(OH)在pH=3时更有利于吸附MO。此外,与pH=3相比,pH=2时产物ζ电位值的减小是由于γ-AlO(OH)在极酸的情况下表面基团发生了变化。因此,选取测试的初始MO溶液pH值为3。
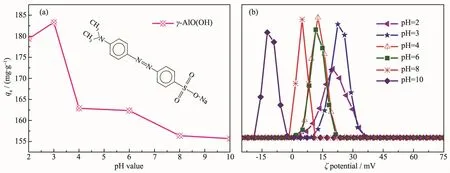
图5 (a)初始溶液pH值对γ-AlO(OH)吸附MO的影响和(b)不同初始溶液pH值下γ-AlO(OH)的ζ电位Fig.5 Effect of initial solution pH value on the adsorption of MO by γ-AlO(OH)(a)and ζ potential of γ-AlO(OH)at different initial solution pH values(b)
2.3 吸附动力学研究
图6(a)为不同吸附时间对样品吸附MO的影响,由图可知3种样品在初始阶段对MO的吸附速率大,随后吸附速率降低。这是由于吸附剂表面上有大量的吸附位点并且吸附剂颗粒周围的流体膜之间存在大的浓度梯度,因此在开始阶段吸附速率相对较高[33]。随着吸附时间的延长,由于固相和液相中的MO分子之间的排斥力,剩余的空位吸附位点很难被占据,从而导致低的吸附速率直到达到平衡[34]。吸附平衡之后,γ-AlO(OH)、γ-Al2O3和 θ-Al2O3在平衡时的MO 的吸附量分别为 183.0、100.0 和 125.0 mg·g-1。
为了解 MO 在 γ-AlO(OH)、γ-Al2O3和 θ-Al2O3上的吸附机理,采用准一级和准二级动力学模型对实验数据进行拟合。准一级和准二级动力学方程分别为方程(3)和(4)[35]:

式中,k1(min-1)和 k2(g·mg-1·min-1)分别是准一级和准二级动力学模型的吸附速率常数[36]。
由图6(b)(准一级动力学模型)和图6(c)(准二级动力学模型)的斜率和截距计算的动力学常数和相关系数总结在表2中。表2中的相关系数R2表明与准一级动力学模型相比,3种吸附剂对MO的吸附更符合准二级动力学模型。此外,实验所得的平衡吸附容量也非常接近从准二级模型中计算获得的平衡吸附容量。这些结果表明准二级动力学模型更适合解释样品对MO的吸附过程。该模型的适用性揭示了速率控制步骤涉及吸附剂活性位点和MO之间的化学吸附或化学键合[37-38],然而,吸附过程中初始阶段的快速阶段涉及物理吸附[37-38]。

图6 (a)吸附时间对各种材料吸附MO的影响;(b)准一级动力学模型的线性拟合曲线;(c)准二级动力学模型的线性拟合曲线Fig.6 (a)Effect of contact time on MO adsorption using various materials;(b)Linear fitting curves with pseudo-first-order kinetic model;(c)Linear fitting curves with pseudo-second-order kinetic model

表2 在γ-AlO(OH)、γ-Al2O3和θ-Al2O3上吸附MO的动力学参数Table 2 Kinetic parameters for the adsorption of MO onto γ-AlO(OH),γ-Al2O3and θ-Al2O3
2.4 吸附等温线
平衡吸附等温线通常描述被吸附物与吸附剂之间的相互作用。图7(a)为3种样品在不同初始MO浓度(200、300、400、500、600、700 mg·L-1) 下对 MO的吸附等温线。通过图中发现,qe的值随着Ce的增加而增加并有逐渐变为固定值的趋势。为了评估平衡状态下MO和吸附剂之间的关系,用Langmuir和Freundlich模型分析吸附实验数据。等式表示如下:

式中,qm(mg·g-1)为吸附剂的最大吸附量[39]。 KL(L·mg-1)是与吸附速率有关的Langmuir常数。KF[(mg·g-1)(L·mg-1)1/n]和n-1(无量纲)分别是与吸附容量和吸附强度有关的Freundlich常数。
拟合等温线如图7(b,c)所示。2个模型的等温线参数由方程的斜率和截距计算得到。3种吸附剂的等温线参数列于表3中。表3表明γ-AlO(OH)对MO的最大吸附容量明显高于γ-Al2O3和 θ-Al2O3。与Freundlich模型相比,Langmuir模型的R2较高,说明材料更符合Langmuir等温吸附理论。这表明吸附是在均质吸附剂表面上形成MO的单层覆盖物[40]。通过 Langmuir方程拟合,γ-AlO(OH)的 qm为 1 492.50 mg·g-1, 远 高 于 γ-Al2O3(420.20 mg·g-1)和 θ-Al2O3(444.40 mg·g-1),表明 γ-AlO(OH)对 MO 的吸附容量大于γ-Al2O3和θ-Al2O3。 此外,由Freundlich方程可知 γ-AlO(OH)的 KF最大,也表明 γ-AlO(OH)对 MO具有更强的亲和力。而且所制备的高分散捆扎状γ-Al2O3、θ-Al2O3和 γ-AlO(OH)对 MO 的最大吸附量远高于大多数报道的材料(表4)。并且,与其他γ-AlO(OH)相比,本文的γ-AlO(OH)对MO的吸附能力提高了10倍左右。综上所述,高分散捆扎状γ-Al2O3、θ-Al2O3和γ-AlO(OH)材料具有有效去除有机染料的竞争性和前景。

图7 (a)将MO吸附在所得材料上的吸附等温线;(b)用Langmuir模型拟合的线性曲线;(c)用Freundlich模型拟合的线性曲线Fig.7 (a)Adsorption isotherm of MO on the obtained materials;(b)Linear fitting curves with Langmuir model;(c)Linear fitting curves with Freundlich model
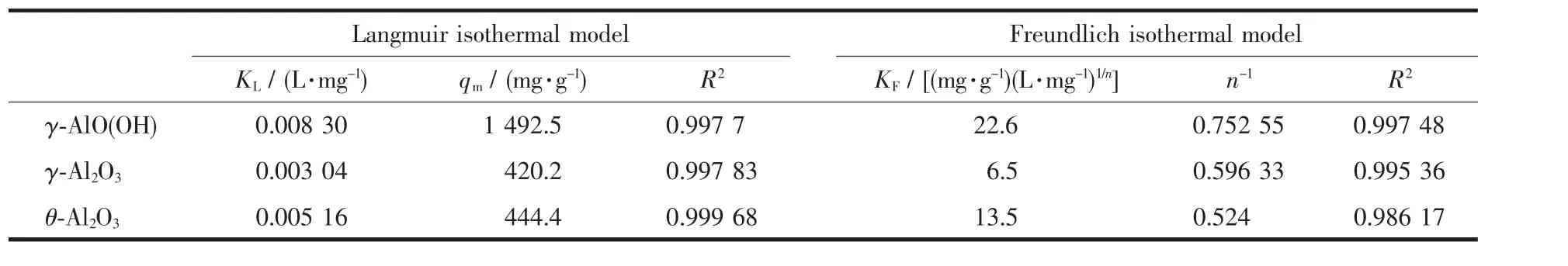
表3 在γ-AlO(OH)、γ-Al2O3和θ-Al2O3上吸附MO的2种等温模型的参数Table 3 Parameters of two kinds of isothermal models of MO adsorbed on γ-AlO(OH),γ-Al2O3and θ-Al2O3
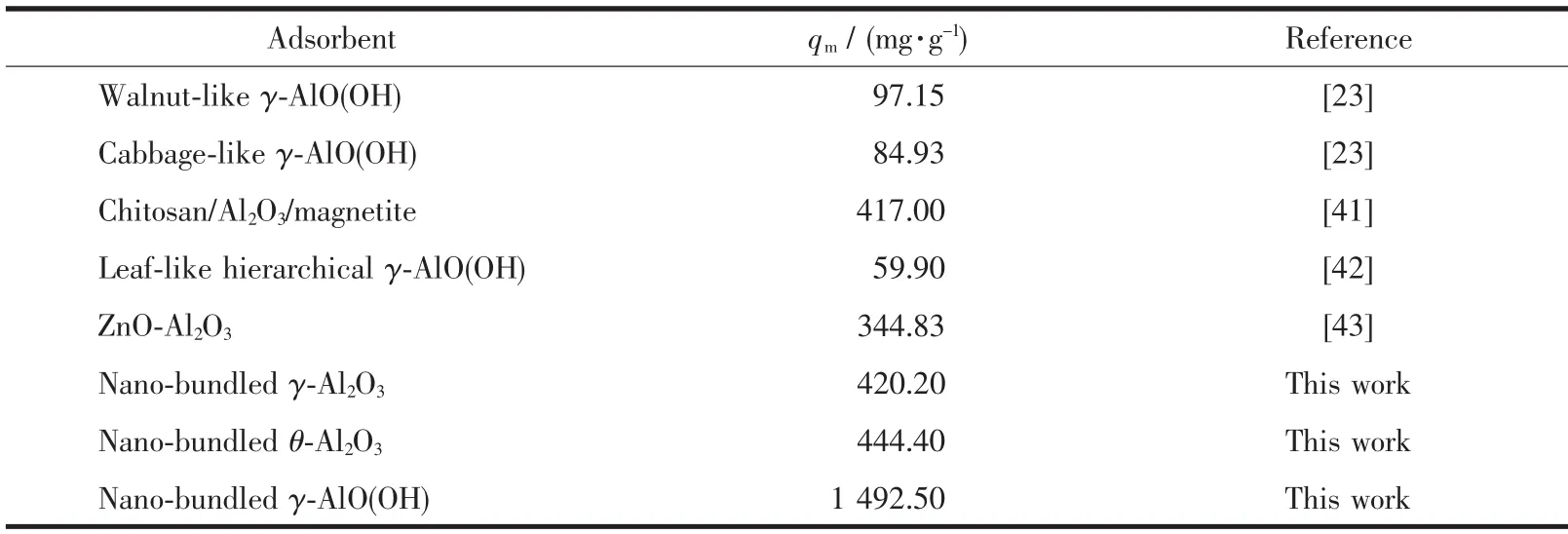
表4 其他吸附剂对MO的最大吸附容量的比较Table 4 Comparison of the maximum adsorption capacity for MO with other adsorbents
2.5 产物的吸附机制
研究吸附机理对于更好地理解吸附剂的使用具有重要意义。通过FTIR和ζ电位表征吸附剂,推导出MO的去除机理,结果如图8所示。与γ-AlO(OH)相比,吸附MO后的γ-AlO(OH)的FTIR光谱有明显变化(图8(a))。1 608 cm-1处的吸收带为N=N的伸缩振动[44],1 118 cm-1处的吸收峰归因于O=S=O的对称伸缩振动[44]。吸附MO后的γ-AlO(OH)的O-H峰的移动表明氢键参与吸附过程[45]。由以上结果可知MO分子固定在吸附剂表面上[46]。

图8 在400~4 000 cm-1范围内γ-AlO(OH)吸附前后的FTIR谱图(a)和在pH=3的水溶液中各种材料(0.2 mg·mL-1)的ζ电位(b)Fig.8 FTIR spectra of γ-AlO(OH)before and after adsorption between 400 and 4 000 cm-1(a)and ζ potentials of various materials(0.2 mg·mL-1)in aqueous solution at pH=3(b)
材料的吸附性能与其表面上的电荷状态有关。如图8(b)所示,所得物质在pH=3下,悬浮液显示出带正电荷的表面,γ-AlO(OH)(22.57 mV)的ζ电位值大于 γ-Al2O3(17.61 mV)和 θ-Al2O3(18.94 mV)。这表明γ-AlO(OH)更有利于MO的吸附,三者吸附能力顺序为 γ-AlO(OH)>γ-Al2O3>θ-Al2O3。 与纳米氧化铝相比,纳米薄水铝石具有更高的吸附容量,这除了因为其具有多孔结构,还因为在水溶液中薄水铝石表面有大量的羟基基团(-OH),通过这些基团或基团的变形与被吸附物质发生吸附作用提高了对有机染料的吸附性能[23],并且在酸性水溶液中薄水铝石表面带有比纳米氧化铝更高的正电荷,这对吸附阴离子染料MO更有利。综合以上测试结果可知,本文所制备的材料的吸附机制包含化学作用吸附机制、静电作用吸附机制和物理作用吸附机制[23,38]。
2.6 吸附剂的再生循环性能
图9(a,b)分别为γ-AlO(OH)及其脱附后的FTIR谱图和γ-AlO(OH)对MO吸附的循环再生性能。通过比较γ-AlO(OH)及其脱附后的FTIR吸收带可以看出,γ-AlO(OH)在吸附过程中表现出优异的稳定性。图9(a)还表明染料的解吸率基本达到100%,因为在脱附后的FTIR光谱中没有观察到MO的特征峰。从图9(b)可知,γ-AlO(OH)的吸附容量在第4个循环时仍有155.4 mg·g-1,吸附效率仍高于84.8%。容量降低是由于在洗涤染料分子时,吸附剂随着洗涤、离心而损失。由此可见,γ-AlO(OH)对MO的吸附有较好的循环可再生性能,是一种潜在的有机染料吸附剂。

图9 在 400~4 000 cm-1处 γ-AlO(OH)和 γ-AlO(OH)脱附后的 FTIR谱图 (a);回收 γ-AlO(OH)去除 MO 图 (b)Fig.9 FTIR spectra of γ-AlO(OH)and γ-AlO(OH)after desorption at 400~4 000 cm-1(a);Recycling of γ-AlO(OH)for removal of MO(b)
3 结 论
(1)采用水热法一步合成高分散纳米γ-AlO(OH),通过500和1 100℃煅烧分别得到γ-Al2O3和θ-Al2O3,煅烧产物的比表面积产生了变化。其比表面积变化的主要原因是产物孔隙率的变化。
(2)采用ζ电位表征材料的表面电荷,结果表明:在pH=3时材料表面带正电荷最多,这更有利于吸附阴离子染料MO,且γ-AlO(OH)表面正电荷高于γ-Al2O3和 θ-Al2O3。
(3)采用准一级和准二级两种动力学模型来拟合实验数据。动力学结果表明,3种产物对MO的吸附动力学遵循准二级动力学模型。此外,产物对MO的吸附符合Langmuir等温线模型。γ-AlO(OH)的最大吸附容量高达1 492.5 mg·g-1。
(4)相比 γ-Al2O3和 θ-Al2O3,γ-AlO(OH)吸附容量的提高不仅因为其表面正电荷更高还因为其含有大量羟基基团,这些基团能与被吸附物质发生吸附作用。
(5)γ-AlO(OH)对MO有较好的吸附循环性能,在第4个循环吸附容量仍有155.4 mg·g-1,吸附效率为84.8%,是一种潜在的有机染料吸附剂。
