球磨法制备Y3+/TiO2光催化剂及处理海水养殖废水
2019-03-13张大帅王丽丽张小朋2刘张苏敏李天略史载锋
李 晨 吴 迪 张大帅 王丽丽 张小朋*,,2刘 建 张苏敏 李天略 史载锋*, 林 强
(1海南省水环境污染治理与资源化重点实验室,海南师范大学化学与化工学院,海口 571127)
(2污染控制与资源化研究国家重点实验室,南京大学环境学院,南京 210023)
(3南京林业大学化学工程学院,南京 210037)
0 引 言
近年来,海南省海水养殖业迅猛发展,近海岸出现了许多高位养虾池。海水养殖过程中产生大量废水,其中包含鱼虾排泄物、残留饵料及药物,不经处理直接排放,对近海水环境造成严重污染[1]。为有效去除水中污染物的去除、改善海洋环境,通常采用物理、化学和生物方法等[2]。光催化技术是目前最有前途且有效的处理方法,其中TiO2因具有氧化能力强、光化学稳定性高、无毒且成本低等优点而受到广泛关注[3]。然而,能带较宽和量子效率低是TiO2的2个固有缺点,制约了其在光催化中的实际应用[4]。因此为了提高TiO2的催化性能,人们致力于形貌调控、金属或非金属掺杂、半导体复合等方式的研究[5]。
由于稀土元素具有丰富的能级和特殊的电子层结构4fn6s2或 4fn-16s2,Y3+的离子半径(0.089 3 nm)与TiO2中Ti4+的半径(0.068 0 nm)相近,外层电子轨道为4s24p6,d轨道和f轨道无电子。由于d轨道的作用,可在TiO2价带顶上方引入一条空能带,作为电子捕获陷阱,提高光生电子空穴对的分离效率[6]。Reszczyńska等采用溶胶凝胶法制备了一系列Er3+-TiO2,Yb3+-TiO2和 Er3+/Yb3+-TiO2光催化剂,表征结果显示Er和Yb元素以氧化物的形式存在,掺杂离子进入TiO2晶体结构中,产生氧空位和表面缺陷,光催化活性最高的样品为反应中添加了1%(n/n)Yb3+制备的锐钛矿型 TiO2,其比表面积为 125 m2·g-1,平均晶粒尺寸为13 nm,在3 h的可见光辐射下苯酚的去除率可达89%,对Er3+/Yb3+-TiO2样品的作用光谱分析表明420~475 nm范围的辐射是产生可见光活性的原因[7]。
以稀土金属Y为掺杂剂,采用机械球磨法制备了Y3+修饰TiO2光催化剂,通过UV-Vis DRS、XPS、N2吸附-脱附、XRD、SEM等对材料进行表征,以MB为降解基质考察Y3+/TiO2的催化活性,优化球磨条件。将活性最高的催化剂负载于塑料浮球表面,分别在紫外光和模拟太阳光下降解养虾废水中的有机物,为解决悬浮催化剂处理实际海水养虾废水提供了途径。
1 实验部分
1.1 试 剂
二氧化钛(>99.5%(w/w),南京天行新材料有限公司),氧化钇(湖南稀土金属材料研究院),浓盐酸(AR,西陇化工股份有限公司),浓硫酸(AR,西陇化工股份有限公司),重铬酸钾(AR,上海抚生实业有限公司),硝酸银(AR,上海抚生实业有限公司),硫酸汞(AR,上海抚生实业有限公司),养虾水(取自海口市某高位养虾池),塑料多面空心球(浮球,江西凯莱化工填料有限公司)。
1.2 仪 器
采用美国PE公司Lambda 750s紫外可见近红外分光光度计检测Y3+/TiO2样品的光吸收性能,波长范围 200~800 nm。 PHI5000 Versaprobe-Ⅱ多功能扫描成像光电子能谱(附加扫描俄歇电子能谱)被用来确定Y3+/TiO2样品的表面元素组成,阳极采用Al靶,功率 50 W,电压 15 kV,通能 46.95 eV,以 C1s 284.8 eV为内标进行校正。采用美国康塔仪器公司ASIQC0000-2比表面和孔径分布分析仪确定样品的BET比表面积,N2吸附-脱附等温线是在-195.8℃下测定。采用日本理学UltimaⅣX射线粉末衍射仪确定样品的晶体结构,Cu靶 Kα辐射(λ=0.154 2 nm),工作电压 40 kV,电流 40 mA,2θ范围为 10°~80°,扫速5°·min-1。采用日本电子株式会社JSM-7100F场发射扫描电子显微镜表征催化剂颗粒的微观形貌,工作电压5 kV。采用岛津UV-2700紫外可见分光光度计测定MB溶液的吸光度;采用日本Hitachi公司F-7000荧光分光光度计测定养虾废水的三维荧光数据,激发波长范围200~450 nm,发射波长范围200~600 nm,狭缝宽度为10 nm,扫描速度为2 400 nm·min-1,扫描间隔10 min。采用南京大学仪器厂QM-3SP04行星式球磨机来批量制备光催化剂,并使用南京胥江机电厂XPA光化学反应仪来进行光催化实验。H1850台式高速离心机,湖南湘仪实验室仪器开发有限公司。CODCr采用HACH(美国哈希)消解仪及分光光度仪消解测定。
1.3 催化剂的制备
准确称量5 g TiO2,用去离子水与浓盐酸(36.0%~38.0%(w/w))体积比为1∶1配置的稀盐酸逐滴加入一定量Y2O3中至其刚好完全溶解,即得到Y3+溶液,两者与玛瑙球混合后加入玛瑙罐中,加入10 mL去离子水,Y3+的含量为1%~3%(nY3+/nTi),球磨时间 1~12 h,球料比 1∶1~20∶1(w/w),球磨转速 300~500 r·min-1,球磨后得到 Y3+/TiO2光催化剂,将浆料取出后洗涤、离心、干燥并研磨成粉。将5 g TiO2在相同的条件下球磨后得到纯TiO2样品。
为了解决悬浮态TiO2光催化剂难以回收的问题,实验采用浸涂胶粘法将纯TiO2及Y3+/TiO2粉体分别负载于塑料浮球上:先将塑料浮球浸于胶黏剂中,取出后置入TiO2粉体中使塑料浮球各扇叶表面均涂覆TiO2粉体,然后放入烘箱中恒温35℃干燥4 h。通过水洗去除表面负载不牢固的粉体,再于35℃下干燥4 h,确保光催化剂牢固负载于载体上。因负载型催化剂的表面积为影响光催化效果的直接因素,因此不考虑催化剂的负载量。
1.4 光催化实验
将500 mL MB溶液(25 mg·L-1)加入石英玻璃反应器中(图 1a),催化剂的用量为 0.2 g·L-1,采用300 W中压汞灯作为紫外光源,光催化反应仪的温度保持在25℃来避免温度对反应的影响。光照前,反应器中的混合物在暗箱下不断地鼓气搅拌30 min,使光催化剂和MB之间达到吸附-解吸平衡。每隔一定时间,取出10 mL样品并离心,用UV-2700紫外可见分光光度计测量其在664 nm下的吸光度来确定反应液的浓度。
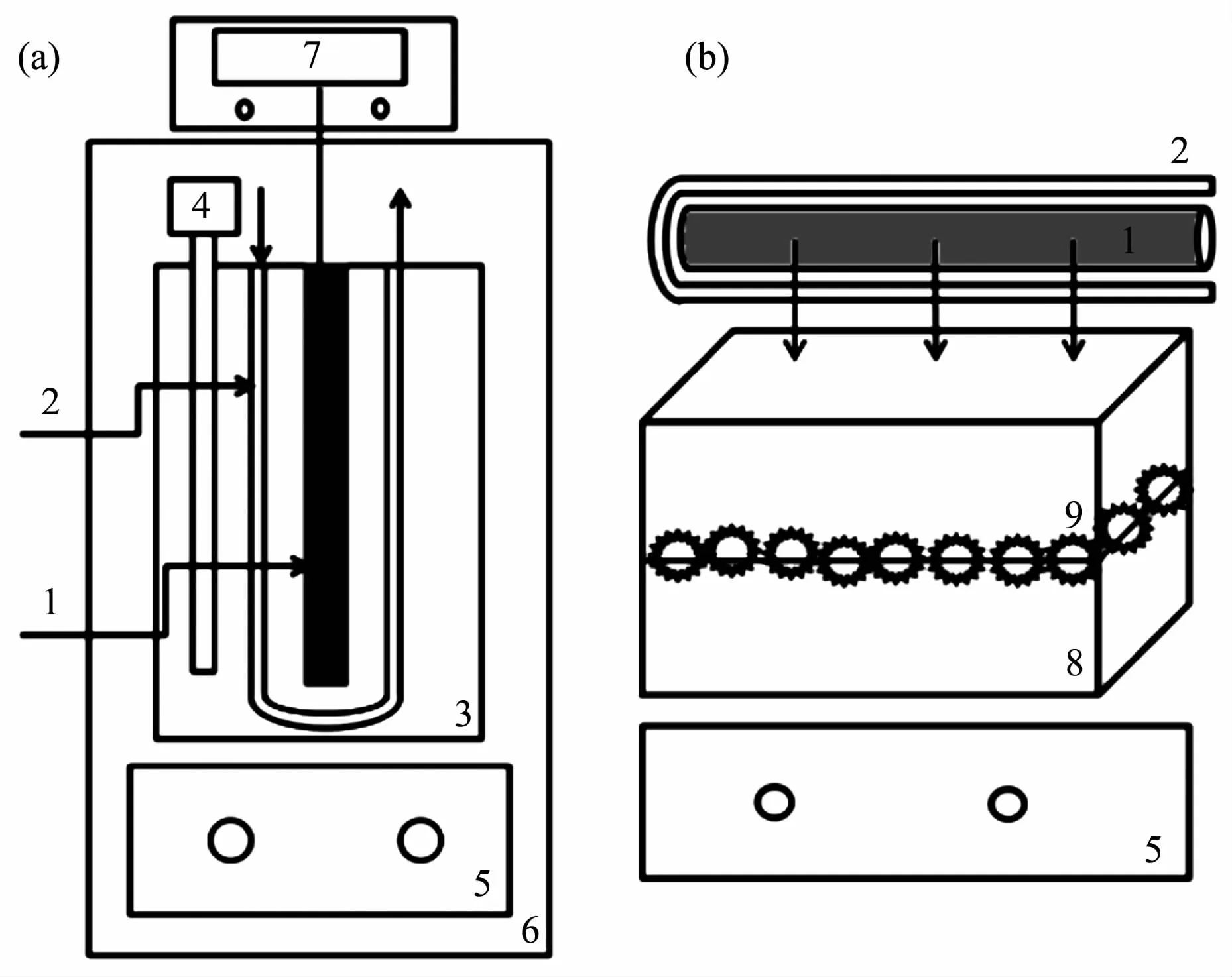
图1 (a)光催化反应仪示意图和(b)光催化反应示意图Fig.1 Schematic diagrams of photocatalytic reactor(a)and photocatalytic reaction(b)
采用上述光催化实验中效果最佳的Y3+/TiO2粉体样品悬浮于溶液中,并将MB溶液改为养虾废水,玻璃水槽代替石英反应器(图1b),以300 W氙灯模拟可见光光源,300 W汞灯模拟紫外光源,测量光催化反应4 h内养虾废水CODCr及三维荧光的变化。将上述催化剂均匀负载在塑料浮球上进行负载型光催化实验:准确量取过滤后的养虾废水750 mL倒入玻璃槽中,分别放入15个Y3+/TiO2或纯TiO2负载后的浮球,将光源横着放在水槽上,在避光条件下鼓气搅拌30 min,使浮球表面颗粒和养殖水达到吸附-解吸平衡,打开光源后每隔15 min取样进行COD和三维荧光的测定。
2 结果与讨论
2.1 光催化活性研究
Y3+/TiO2和纯TiO2的光催化活性是通过在紫外光照射下MB溶液降解反应的表观一级反应速率来考察的,计算公式为-ln(Ct/C0)=kt。C0和Ct分别指反应0和t min时MB溶液的浓度,k为一级反应速率常数,t为反应时间。图2为Y3+含量、球磨的条件对TiO2光催化活性的影响。
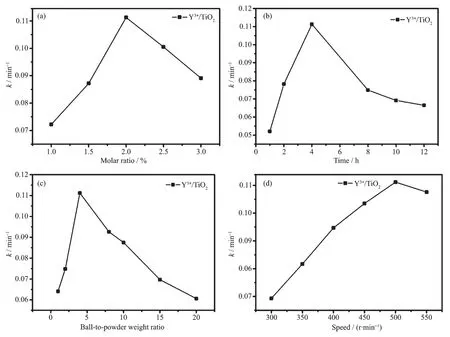
图2 Y3+的物质的量分数 (a)、球磨时间 (b)、球料比 (c)及球磨转速 (d)对反应速率常数k的影响Fig.2 Effects of mole ratio of Y3+(a),time(b),ball-to-power weight ratio(c)and speed(d)on reaction rate constant k
由图2(a)可知,当球磨时间为4 h,球料比为4∶1,转速为 500 r·min-1时,在 Y3+掺杂量 1%~2%的范围内,k随着 Y3+的增加由 0.072 2 min-1增大到0.111 3 min-1,继续增加掺杂量,k减小到0.089 1 min-1,Y3+的最佳负载量为2%,光催化效率是纯TiO2的4.2倍。图2(b)中当掺杂量为2%,球料比为4∶1,转速为500 r·min-1时,球磨时间从1 h增加到4 h,k从0.052 1 min-1增大到0.111 3 min-1,继续增加球磨时间,k值减小到0.066 5 min-1并且趋于平缓,最佳球磨时间为4 h,球磨时间过长会减少TiO2表面活性点[8-9]。图2(c)中当掺杂量为2%,球磨时间为4 h,转速为 500 r·min-1时,球料比与 k值的关系,当球料比由 1∶1 增加到 4∶1 时,k 值从 0.064 1 min-1增加到0.111 3 min-1,继续增大球料比,k减小到0.060 6 min-1。这说明球料比过大时不利于球与物料之间充分的挤压、碰撞和研磨,一部分磨球处于“空转”状态且能量损失较大[10];球料比过小时,缓冲作用过大,球料间作用减小[11],实验最佳的球料比为4∶1。图 2(d)中当掺杂量为 2%,球磨时间为 4 h,球料比为4∶1时,球磨转速与k值的关系,为了给磨球和粉体提供足够的能量,转速设置为300~550 r·min-1,随着转速的增加k从0.069 3 min-1增大至0.111 3 min-1,并在 500 r·min-1处达到最大,转速过高效率不一定高。最佳的球磨条件是当球磨时间为4 h、球料比为 4∶1、 球磨转速为 500 r·min-1、Y3+的含量为2%时,光催化效率最高。
2.2 UV-Vis DRS分析
为了探究Y3+/TiO2和纯TiO2的光学吸收性能,采用紫外可见吸收光谱来检测优化的球磨工艺制备的Y3+/TiO2和纯TiO2样品(图 3)。纯 TiO2仅在紫外光部分有吸收,对400~750 nm范围的光没有吸收;在200~400 nm范围内,所有Y3+/TiO2样品的吸收都明显增强,在400~750 nm范围内,Y3+/TiO2样品对可见光产生一定的吸收。与纯TiO2相比,Y3+/TiO2样品的吸收整体发生红移。沿着吸收曲线作切线并延长与横轴相交,所得吸收波长阈值,通过简化的Kubelka-Munk公式Eg=1 240/λg计算出禁带宽度[12]。计算得到纯TiO2的禁带宽度为3.20 eV,2%Y3+/TiO2的吸收波长阈值为406.9 nm,禁带宽度为3.05 eV。由于Y3+的价层电子排布为4s24p6,无d电子,也无f电子,球磨后可在TiO2价带上方引入一条空能带,可作为电子跃迁的桥梁,价带中的电子可被能量较低的光激发后跃迁至导带,使TiO2的光吸收发生红移[13-14]。

图3 Y3+/TiO2及纯TiO2的紫外可见吸收光谱Fig.3 UV-Vis absorption spectra of Y3+/TiO2 and pure TiO2
2.3 XPS分析
如图4所示,在优化后的球磨工艺下,采用XPS来检测2%Y3+/TiO2和纯TiO2样品的表面元素,Ti2p和O1s的高分辨XPS图谱分别记录了钛、氧元素的化学组成状态。与纯TiO2相比,2%Y3+/TiO2中Ti的结合能分别在 458.38、460.24、463.92和 465.78 eV,4处峰面积分别占 9.91%、56.75%、4.96%和28.38%,其中458.38和463.92 eV的峰对应Ti3+的Ti2p3/2和 Ti2p1/2;460.24和 465.78 eV的峰对应 Ti4+的Ti2p3/2和Ti2p1/2。这说明,由于球磨过程中Y3+以游离态存在于TiO2晶格间隙或吸附在TiO2表面,造成电荷不均,引起晶格畸变,产生氧缺陷,使部分Ti元素价态降低[15-16]。O的结合能分别在529.41、531.55和 533.51 eV,3处峰面积分别占 6.62%、61.88%和31.50%,529.41~529.53 eV范围内的峰为TiO2的晶格氧(O2-),531.55~531.62 eV 范围内的峰表示桥接羟基氧(Ti-OH-Ti),533.51 eV的位置表示是末端羟基氧(Ti-OH),表面吸附氧的分布对光催化活性起到重要作用[17-18],纯TiO2中晶格氧(OL)含量为67.2%,化学吸附氧(OH)含量为32.8%,而2%Y3+/TiO2样品的晶格氧含量下降,吸附氧含量增加,光催化活性明显提高[19]。

图4 2%Y3+/TiO2和纯 TiO2的 Ti2p(a,c)和 O1s(b,d)的 XPS图谱Fig.4 Ti2p(a,c)and O1s(b,d)XPS spectra of 2%Y3+/TiO2and pure TiO2
2.4 SEM分析
图5 为优化的球磨条件下所制备的纯TiO2和2%Y3+/TiO2扫描电镜图。未经任何处理的原料TiO2颗粒较大,排列紧密,团聚现象严重(图5a),未掺杂的纯TiO2颗粒减小,但团聚明显(图5b)。与纯TiO2相比,在球磨过程中添加Y3+,可以改善其团聚现象,使得TiO2颗粒分散性更好,而球磨过程属于强烈的机械碰撞,瞬间所产生的能量可以使Y3+作用于 TiO2表面(图 5c)[20]。

图5 原料TiO2(a)、纯TiO2(b)和2%Y3+/TiO2(c)样品的扫描电镜图Fig.5 SEM images of raw TiO2(a),pure TiO2(b)and 2%Y3+/TiO2(c)samples
2.5 比表面积分析
如表1所示,未经球磨处理的原料TiO2比表面积为65 m2·g-1,与球磨后的纯TiO2比表面积相近。在优化的球磨条件下所制备的Y3+/TiO2样品比表面积相似,范围在 77~104 m2·g-1,与纯 TiO2相比,Y3+的修饰有利于增大TiO2的比表面积。在1%~2%范围内,Y3+含量的增加可以提高TiO2的比表面积,2%Y3+/TiO2样品的比表面积最大(104 m2g-1)。由于Y3+半径(0.089 3 nm)大于 Ti4+半径(0.068 nm),Y3+很难进入TiO2晶格取代Ti4+,而是存在于TiO2的间隙位置,当Y3+含量过多时,剩余的Y3+以游离态吸附在TiO2表面,造成表面电荷不均,晶格发生畸变,产生更多的表面氧缺陷,颗粒之间分散性更好,比表面积增大,类似的结论与Parnicka等报道的文献一致[21]。较高的比表面积可以提高TiO2颗粒的吸附能力,改善界面电荷的转移,对有机污染物更好的吸附性能体现了更高的光催化活性[22]。
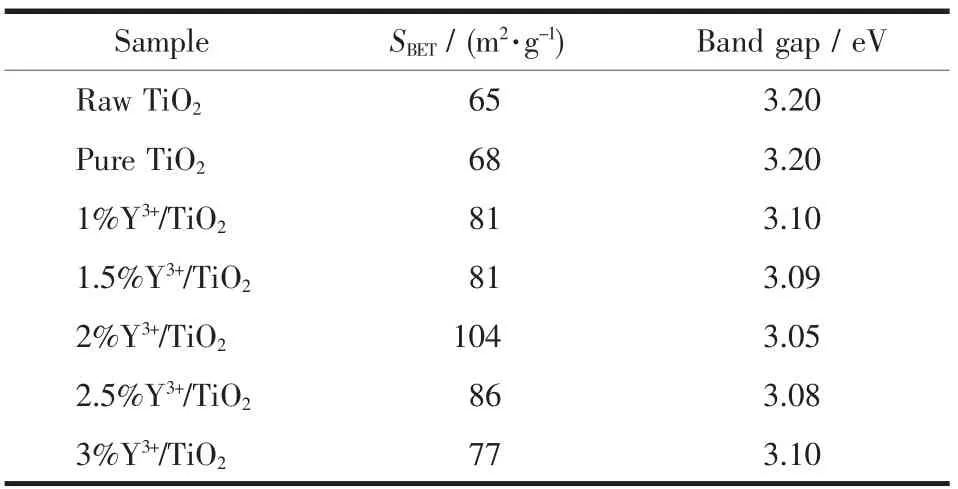
表1 纯TiO2和Y3+/TiO2的比表面积(SBET)和禁带宽度Table 1 BET specific surface area and band gap of pure TiO2and Y3+/TiO2
2.6 XRD分析
图6为2%Y3+/TiO2及纯TiO2的XRD图。球磨后Y3+/TiO2和纯TiO2均保持锐钛矿的晶形,Y3+/TiO2中(101)晶面衍射峰在 25.44°,Y3+进入 TiO2晶格间隙或者以游离态形式吸附在TiO2表面[23],且(101)衍射峰强度有所降低,TiO2的结晶度下降[24]。

图6 2%Y3+/TiO2和纯TiO2样品的XRD图Fig.6 XRD patterns of 2%Y3+/TiO2and pure TiO2samples
2.7 光催化降解养虾水中的有机物
2.7.1 紫外光下Y3+/TiO2对光催化活性的影响
图7为在300 W中压汞灯照射下,悬浮式光催化与负载光催化剂的浮球对750 mL养虾废水降解过程中CODCr的变化情况。由图可知,反应初始养虾废水的CODCr值为1 343 mg·L-1,空白实验中仅提供紫外光辐射,CODCr数值变化不大;负载纯TiO2的浮球在紫外光的照射下,养虾水反应4 h的CODCr去除率为26.9%;负载2%Y3+/TiO2光催化剂的浮球在4 h内对养虾水的CODCr去除率为37.5%,比纯TiO2的去除效果好。由于养虾废水中有机物成分复杂,反应初始阶段易氧化的有机物首先被降解,可以看到CODCr的数值明显降低;由于TiO2光催化属于非均相催化,反应存在诱导期,养虾废水中有机物种类复杂,有很多难以被强氧化剂氧化的有机物,随着光照的进行,水中羟基自由基和超氧自由基的含量增加,难氧化、难降解的有机物被破坏后,逐渐断键转变成易氧化的有机物,因此从45 min开始CODCr曲线出现明显升高,75 min后开始不断降低[25]。在悬浮式反应中,纯TiO2及2%Y3+/TiO2对CODCr的去除率分别为27.6%及38.7%,这是由于催化剂与废水能够充分接触,对CODCr的去除率有所提升。

图7 纯TiO2和2%Y3+/TiO2在紫外光下对CODCr变化的影响Fig.7 Effects of pure TiO2and 2%Y3+/TiO2on CODCr changes under UV light
2.7.2 氙灯模拟太阳光下Y3+/TiO2对光催化活性的影响

图8 纯TiO2和2%Y3+/TiO2在太阳光下对CODCr变化的影响Fig.8 Effects of pure TiO2and 2%Y3+/TiO2on CODCr changes under visible light
图8 为在300 W氙灯照射下,负载纯TiO2及2%Y3+/TiO2光催化剂的浮球对750 mL养虾废水降解过程中CODCr的变化情况。由图可知,仅在光照条件下养虾水的CODCr去除率为4%;负载纯TiO2的浮球对养虾水中CODCr的去除率为14.7%,而负载Y3+/TiO2时CODCr的去除率可达18.8%。以氙灯为光源,加入TiO2作为光催化剂时,TiO2的吸附作用占据主导地位,将水中一些污染物质吸附降解,因此能够降低养虾水的CODCr,但去除率不高[26]。而悬浮式反应对CODCr的去除率大于负载型反应,进一步证明了在光催化反应中催化剂的有效表面积是影响光催化效果的重要因素。
2.7.3 不同直径球对光催化效果的影响
实验探究了不同直径的浮球对光催化处理养虾废水的影响,由于浮球均含有24个扇形叶片,且叶片的两面均可负载催化剂,可通过以下公式计算其表面积:

图9 不同直径浮球对CODCr变化的影响及浮球实物图Fig.9 Effects of different diameter spheres on CODCrchanges and picture of spheres
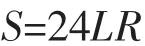
其中S为表面积,L为扇弧周长,R为球半径。
浮球的直径分别为1、2、3 cm,总表面积分别为3.525×10-2,9.51×10-2,0.12 m2。实验结果表明,采用直径2 cm的浮球为载体时光催化效率最佳,这是由小球浸入水中的面积所决定的。由于水槽容积固定,直径为1、2 cm的浮球在磁力搅拌和鼓气的作用下能够在水中不停地转动,直径为3 cm的浮球只有大约4/5浸没在水槽中且不能灵活旋转,因此有效参与光催化反应的表面积较小。
2.8 三维荧光分析
对光催化前后的养殖废水进行三维荧光表征来检测有机物的变化(图10)。结果表明:激发波长λex在 230~255 nm, 发射波长 λem在 400~500 nm 的范围内的荧光峰(Ⅲ)对应类腐殖质物质;λex在200~260 nm,λem在 300~380 nm 处的荧光峰(Ⅰ,Ⅱ)属于类蛋白物质[27-28]。类腐殖质在自然界中广泛存在,主要是动植物遗骸经过微生物作用后形成的高分子有机物,在养虾废水中主要是由残余的饵料和未及时处理的鱼虾残骸腐败所产生[29-30]。在4 h的光催化反应后,Ⅲ的荧光特征峰几乎消失而Ⅰ的特征荧光峰逐渐增强,说明养虾废水中难氧化、难降解的复杂有机物经过光催化被破坏,逐渐转化为易氧化、易降解的有机产物,与CODCr的结果相对应,说明TiO2光催化对养虾废水中有机物起到一定的降解效果[31-32]。

图10 光催化处理养虾废水过程中的三维荧光光谱Fig.10 Excitation-emission-matrix fluorescence spectra(EEM)of shrimp wastewater in photocatalytic treatment process
2.9 机理分析

图11 Y3+/TiO2光催化机理图Fig.11 Photocatalytic mechanism diagram of Y3+/TiO2
图11 为Y3+/TiO2样品的光催化机理图,由于锐钛矿型TiO2本身带隙较宽,电子跃迁发生在价带顶部的O2p轨道和导带底部的Ti3d轨道之间,由于Y3+的修饰,在价带顶上方引入了新的能级轨道[33]。当光能辐射在TiO2表面,价带中的电子受到激发首先跃迁至上方的这条空带中,再吸收更高波长的光能跃迁至导带,使TiO2的光吸收发生红移[34],Y中d轨道作为电子捕获陷阱,促进光生电子空穴对的分离效率,光催化活性得到提高[35]。另外,由于半径较大的Y3+存在于TiO2的晶格间隙,引起晶格畸变,使得表面电荷不均[36],Y3+/TiO2中表面吸附氧含量大量增加,电子可以通过这些氧缺陷迁移至表面与氧分子反应转变为超氧自由基[37],价带中的光生空穴可以将水分子转变为羟基自由基,从而将难降解的复杂有机物转化成易氧化的产物[38]。
3 结 论
(1)采用机械球磨法制备了Y3+修饰TiO2光催化剂,并在紫外光下,以亚甲基蓝(MB)为去除物来考察其催化剂活性。结果表明,当Y3+的含量为2%(n/n),球磨时间 4 h,球料比 4∶1,转速为 500 r·min-1时,反应速率常数可达0.111 3 min-1,是纯TiO2的4.2 倍。UV-Vis DRS,XPS,SEM,XRD 和 N2吸附-脱附测试的表征结果显示,与纯TiO2相比,2%Y3+/TiO2样品对可见光产生吸收,光吸收红移,禁带宽度降低,表面吸附氧含量明显增加,颗粒分散性更好,比表面积更大,晶型未发生变化。
(2)将最佳条件下制得的Y3+/TiO2光催化剂负载于不同半径的塑料浮球上,分别在紫外光和模拟太阳光照射下处理养虾废水。采用纯TiO2和Y3+/TiO2为光催化剂在模拟太阳光下对废水中CODCr的去除率为14.7%和18.8%,而在紫外光下可以达到26.9%和37.5%。
(3)考察3种浮球的光催化效果,CODCr结果显示直径为2 cm小球的光催化效果最好。在4 h的光催化实验中,难氧化、难降解的有机物逐渐转化为易氧化的有机物,最终被降解去除。
