P2W18O626-@Tb3+溶液电致变色/荧光开关性质的可逆调控及对H2O2的光谱检测
2019-03-13郑金慧刘哲林王晓红段莉梅白锁柱刘宗瑞
王 斌 郑金慧 刘哲林 王晓红 段莉梅 白锁柱 许 良,2 刘宗瑞*,
(1内蒙古民族大学化学化工学院,通辽 028043)
(2天然产物化学及功能分子合成自治区重点实验室,通辽 028000)
(3长春理工大学化学与环境工程学院,长春 130022)
0 引 言
荧光开关是指发光分子在外界刺激下荧光信号发生可逆的发光与淬灭过程,在荧光成像、光学信息存储、生物及化学传感等领域有潜在的应用价值[1-2]。多金属氧酸盐(简称多酸)是由前过渡金属元素W、Mo、V、Nb、Ta的酸式盐脱水缩合而成的金属-氧簇合物,具有组成丰富、结构多样、纳米尺度可调控、可逆的氧化还原以及光、电、磁等性质,在催化、能源、材料、生物等领域有重要的应用前景[3-4]。在紫外/可见光照、电化学氧化/还原、化学氧化/还原等作用下,多酸会发生可逆的氧化还原反应并伴随着可逆的变色性质,还原态多酸在可见区有宽的吸收峰,可以作为能量受体被用于荧光开关的设计[5-7]。
目前,基于稀土多酸荧光开关的研究主要集中在化学响应、光调控、电化学调控荧光开关。在化学响应荧光开关方面,Liu等[8]通过Langmuir-Blodgett(LB)技术构筑了多酸红光薄膜4-hexadecylaniline/EuW10,在HCl与NH3刺激下实现了红光薄膜可逆的荧光开关性质,荧光开关的机理归属于O→W的激发态电子与H+之间的电子转移;Song等[9]利用旋涂法构筑了聚丙烯腈(PAN)、EuW10杂化自支持薄膜PAN-EuW10, 在 HCl、H2S、SO2刺激下薄膜的荧光淬灭,在NH3刺激下薄膜的荧光恢复,同时实现了对H2S、SO2等气体分子的荧光光谱检测;Wan等[10]利用自组装技术制备了稀土多酸/嵌段共聚物poly(ethylene oxide-b-N,N-dimethylaminoethyl methacrylate)(PEO-b-PDMAEMA)杂化超分子复合物DyW10/PEO-b-PDMAEMA,在CO2/Ar的刺激下,该稀土多酸复合物呈现出可逆的化学响应荧光开关性能,同时实现了对CO2分子的荧光光谱检测;Wang等[11]在维生素C/H2O2的作用下,对稀土多酸Eu-PMo12O40可逆的化学响应变色/荧光开关性质进行研究,实现了该稀土多酸对维生素C的紫外可见、荧光双光谱可逆检测。在光调控荧光开关方面,Yao等[12]利用Casting技术制备了[Eu(SiW10MoO39)2]13-/Agarose杂化自支持红光薄膜,在紫外、可见光刺激下,实现了稀土多酸红光薄膜可逆的荧光开关性质,光调控荧光开关的机理归属于分子内荧光共振能量转移。在电化学调控荧光开关方面,Bi等[13]利用Layer-By-Layer(LBL)技术制备了聚乙烯亚胺(PEI)、稀土多酸杂化红光薄膜[PEI/EuGeW11]34,在外加氧化还原电位-0.85/0.85 V下实现了多酸红光薄膜可逆的电致变色/荧光开关性质;随后,该课题组通过LBL技术构筑了一系列PEI、聚二甲基二烯丙基氯化铵(PDDA)与稀土多酸的发光薄膜[PEI/DyPW11]41、[PDDA/SmPW11]n,在外加氧化还原电位下实现了橙光及白光薄膜多色可调控荧光开关性能[14-15];Dong等[16]基于多酸(Na-POM)/稀土上转换纳米粒子 (UCNPS)复合物UCNPS@Na-POM可逆的电致变色/荧光开关性质,实现了对抗氧化剂谷胱甘肽的荧光光谱检测;Wu等[17]将电化学还原与化学氧化法相结合实现了稀土多酸[(CH3)4N]2.5H7.5[Eu(GeW11O39(H2O)2]2可逆的变色/荧光开关性质,同时实现了稀土多酸对H2O2的紫外可见、荧光双光谱检测。
我们基于分子设计思想及分子间荧光共振能量转移,以可逆电致变色性质的多酸阴离子P2W18O626-为能量受体(receptor),以优异绿光性质的Tb3+为能量给体(donor),在外加氧化还原电位下对P2W18O626-@Tb3+绿光体系电致变色/荧光开关性能进行调控;考察不同氧化还原电位对混合溶液着色程度及荧光开关能量转移效率的影响,获得多酸还原电子数与荧光开关能量转移效率的内在联系。在此基础上,基于还原态多酸与H2O2的氧化还原反应,利用电化学还原态多酸P2W18O6212-@Tb3+溶液对H2O2进行紫外可见、荧光双光谱检测。
1 实验部分
1.1 试剂与仪器
硝酸铽(Tb(NO3)3·6H2O,99.9%)购买于江西赣州稀土集团有限公司;钨酸钠(Na2WO4·2H2O,99.5%)、过氧化氢(H2O2,30%)等试剂购买于国药集团化学试剂有限公司,均为分析纯。实验过程中使用的二次水由Millipore Milli-Q净化水系统处理(18.2 MΩ·cm)。
X射线衍射仪 (D8 Focus,德国布鲁克有限公司),测试电压40 kV,电流40 mA,辐射源为Cu Kα(λ=0.154 1 nm)测试范围 3°~80°;傅立叶红外光谱仪(Nicolet-5700,美国尼高力公司);电化学工作站(CHI660e,上海辰华仪器有限公司),采用三电极体系 (1 cm×1 cm的铂片为工作电极和对电极,Ag/AgCl为参比电极),电解液为pH=1的 0.5 mol·L-1H2SO4/Na2SO4缓冲溶液 (用 0.5 mol·L-1H2SO4将 0.5 mol·L-1Na2SO4溶液的pH调节到pH=1);紫外可见光谱仪(UV-670,上海美普达仪器有限公司),紫外可见光谱与动力学曲线分别通过Scan、Kinetics方法测得,比色皿厚度为1 cm;荧光光谱仪(F-4600,日本日立公司),比色皿厚度为1 cm,狭缝大小均为10 nm,激发波长 λEx≈377 nm。
1.2 K6P2W18O62的合成与结构

图1 P2W18O626-多酸阴离子的球棍模型 (左)和多面体结构 (右)Fig.1 Ball-stick representation(left)and polyhedral structure of the polyoxoanion P2W18O626-(right)
根据文献方法合成了Dawson型多酸K6P2W18O62·14H2O(简写为P2W18)[18]。在Dawson型多酸阴离子P2W18O626-中存在4种不同配位氧原子,即中心氧(Oa)、共点相连桥氧(Ob)共边相连桥氧(Oc)、端氧(Od),其中极位上的3个WO6八面体共边相连形成三金属簇W3O10,而赤道位上的6个WO6八面体通过共点、共边交替连接形成六元环,极位三金属簇与赤道位六元环通过PO4四面体共点相连形成PW9O349-,上下2个PW9O349-共点相连形成了Dawson型多酸阴离子P2W18O626-(图1)。
1.3 K6P2W18O62的结构表征
利用粉末X射线衍射与红外光谱对K6P2W18O62的结构进行表征。在K6P2W18O62的XRD图中出现了一系列Dawson型多酸的特征衍射峰,与文献报道基本一致[19](图2a);在红外光谱中,波数为1 085、961、910、777 cm-1处出现了 K6P2W18O62的特征吸收峰,分别归属于 P-Oa、W-Od、W-Oc、W-Ob的对称或不对称伸缩振动[20],结果表明已成功合成了Dawson型多酸 K6P2W18O62(图 2b)。
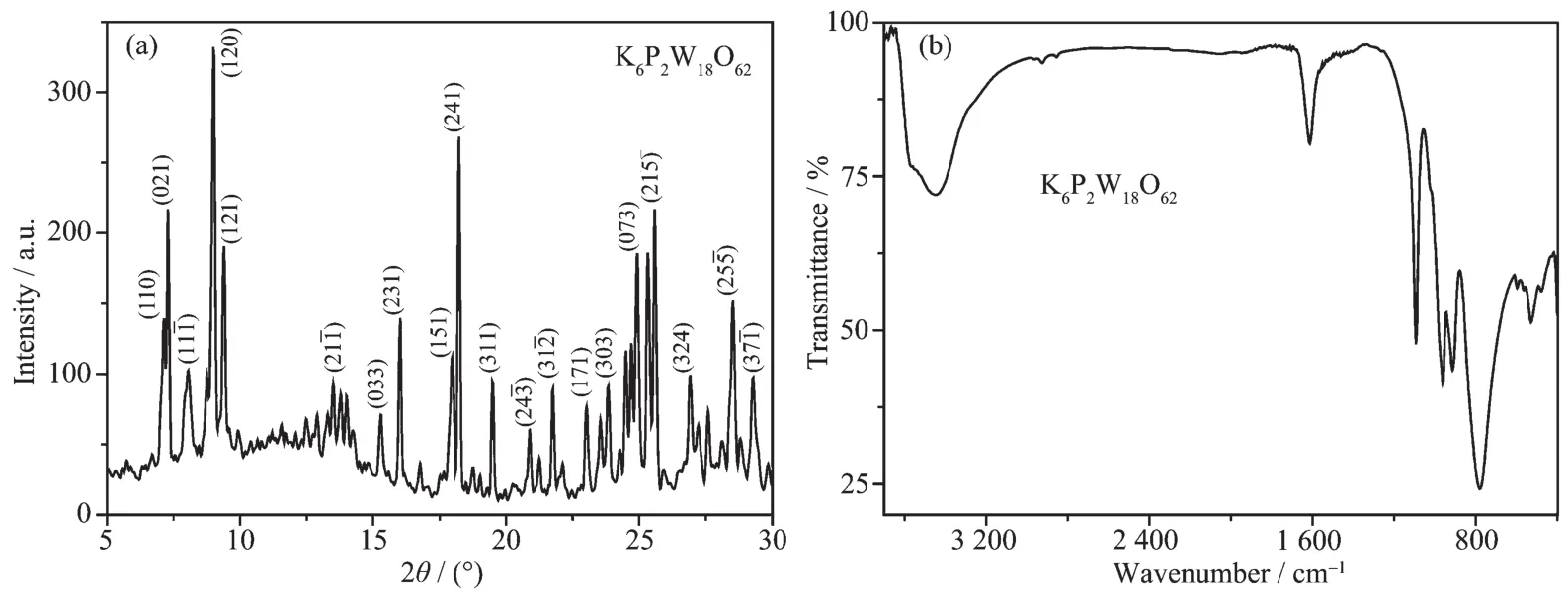
图2 K6P2W18O62的XRD(a)和红外光谱图 (b)Fig.2 XRD patterns(a)and FTIR spectra(b)of K6P2W18O62
1.4 K6P2W18O62溶液的循环伏安曲线
图3 为 0.6 mmol·L-1的 K6P2W18O62在 pH=1 的0.5 mol·L-1H2SO4/Na2SO4缓冲溶液中的循环伏安曲线,半波电位E1/2=(Ea+Ec)/2(其中Ea为阳极峰电位,Ec为阴极峰电位)在-0.04(Ⅰ-Ⅰ′)、-0.22(Ⅱ-Ⅱ′)、-0.53(Ⅲ-Ⅲ′)、-0.75 V(Ⅳ-Ⅳ′)处出现了 4 对 Dawson型多酸的特征氧化还原峰,分别对应于1e、1e、2e、2e可逆的氧化还原过程[21];通过对不同扫描速度50、100、150、200、250、300 mV·s-1下循环伏安曲线的比较,发现氧化峰Ⅱ、还原峰Ⅱ′的峰电流与扫描速度的平方根成正比,表明多酸在溶液中的电化学行为属于扩散控制过程[22]。
1.5 K6P2W18O62溶液的紫外可见光谱

图3 K6P2W18O62溶液在扫描速度为 50、100、150、200、250和300 mV·s-1下的循环伏安曲线Fig.3 Cyclic voltammetry curves of K6P2W18O62solution with the scan rate 50,100,150,200,250 and 300 mV·s-1
图4为 10-5mol·L-1K6P2W18O62溶液的紫外可见吸收光谱,在紫外区190~380 nm范围内出现了Dawson型多酸的特征吸收峰,分别归属于Od→W(196 nm)、Ob/Oc→W(250、300 nm)配体到金属的电荷迁移跃迁(LMCT)[23]。

图4 K6P2W18O62溶液的紫外可见光谱图Fig.4 UV-Vis spectra of K6P2W18O62aqueous solution
2 结果与讨论
2.1 浓度对着色程度及荧光强度的影响
在外加还原电位-0.85 V下,对浓度为0.2、0.4、0.6、0.8 mmol·L-1的 K6P2W18O62溶液进行电解,随着还原时间的延长,溶液由无色变为深蓝色,在700 nm处的吸光度逐渐增大、着色程度逐渐增强,1.5 h后吸光度不再变化,表明K6P2W18O62溶液着色已达到饱和(图5a);同时,在可见区400~800 nm 的范围内出现宽的吸收峰,归属于W5+/W6+分子内价电子转移吸收带(IVCT)[24],随着多酸溶液浓度的增大,着色平衡时750 nm处吸光度呈线性增加(图5b)。
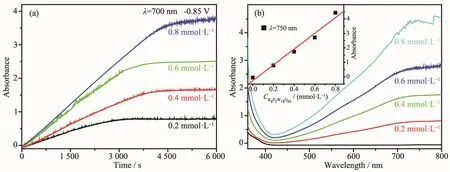
图5 外加还原电位-0.85 V下,不同浓度K6P2W18O62溶液在700 nm处的吸光度随时间的变化曲线(a)及着色平衡时的紫外可见光谱(b)Fig.5 Curves of the absorbance at 700 nm versus time(a)and the corresponding absorption spectra at coloring equilibrium(b)of K6P2W18O62solution with different concentrations when applied a reduction potential-0.85 V
图6a 为 0.6 mmol·L-1的 K6P2W18O62与 10、20、30、40、50、60、70、80、90、100 mmol·L-1的 Tb(NO3)3混合溶液P2W18O626-@Tb3+的荧光光谱,在491、547、588、624 nm处出现了一系列Tb3+的特征发射峰,分别归属于5D4→7F6、5D4→7F5、5D4→7F4、5D4→7F3的轨道能级跃迁[25];同时随着Tb3+浓度的增大,547 nm处的荧光发射峰线性增强(图6b)。

图6 P2W18O626-@Tb3+混合溶液的荧光光谱 (a)及547 nm处的荧光强度对Tb3+浓度作图 (b)Fig.6 Fluorescence spectra of the mixed solution P2W18O626-@Tb3+(a)and the fluorescence intensity at 547 nm with different Tb3+concentrations(b)
2.2 P2W18O626-@Tb3+可逆电致变色及荧光开关性能
在外加氧化还原电位-0.85/0.85 V下,对0.6 mmol·L-1K6P2W18O62与 100 mmol·L-1Tb(NO3)3混合溶液的电致变色及电化学调控荧光开关性能进行研究。在外加还原电位-0.85 V下,随着还原时间的延长,750 nm处的吸光度逐渐增大,在可见区400~800 nm范围内出现宽的吸收峰;而在外加氧化电位0.85 V下,随着氧化时间的延长750 nm处的吸光度逐渐降低,在可见区400~800 nm范围内的吸收峰消失,溶液呈现出可逆的电致变色性质(图7(a,b))。与此同时,在外加还原电位-0.85 V下,随着还原时间的延长547 nm处的荧光强度逐渐降低,在460~700 nm范围内的荧光发射峰减弱,荧光淬灭;而在外加氧化电位0.85 V下,随着氧化时间的延长547 nm处的荧光强度逐渐增强,在460~700 nm范围内的荧光发射峰恢复,溶液呈现出可逆的电化学调控荧光开关性质(图 7(c,d))。
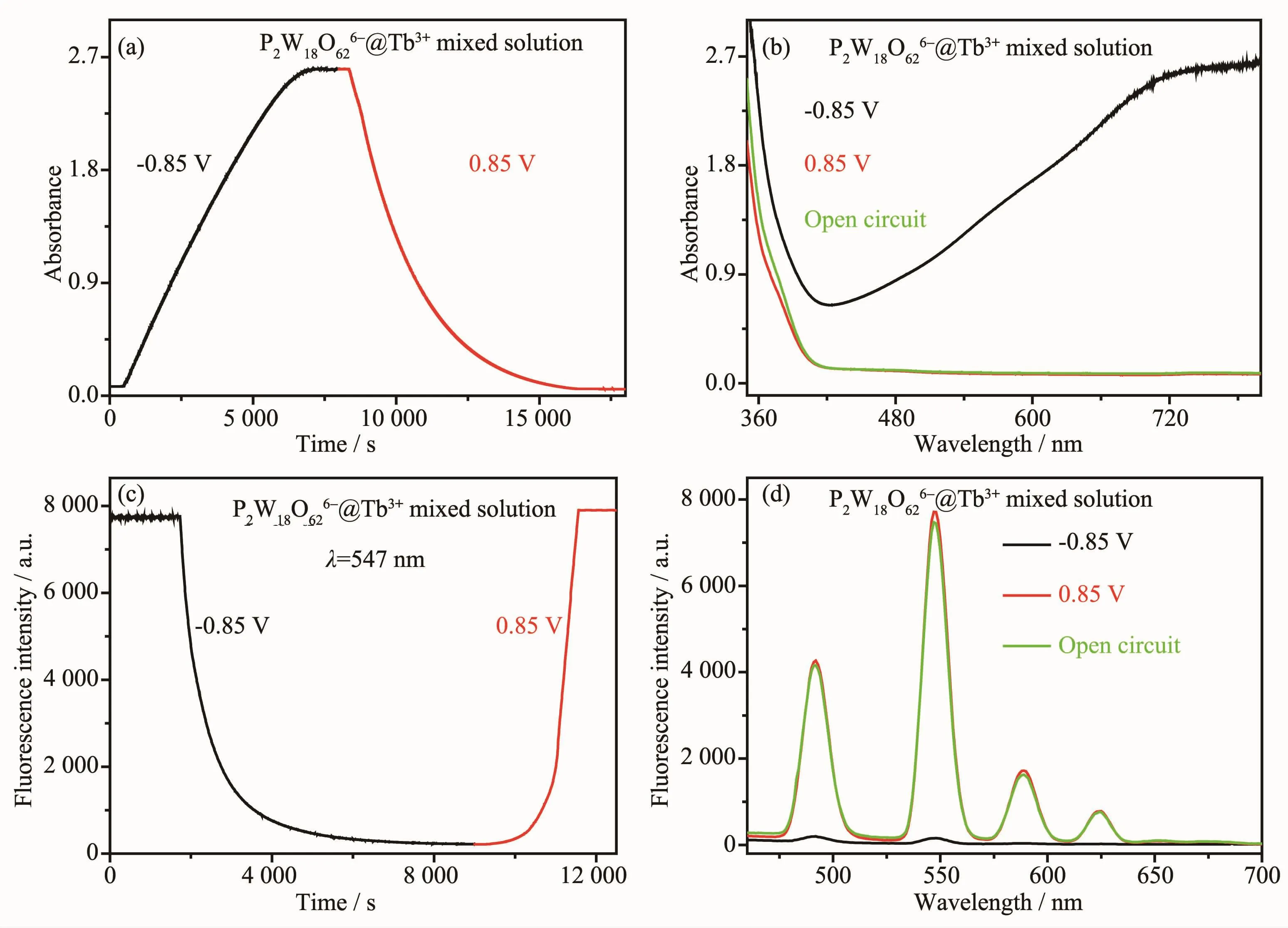
图7 在-0.85/0.85 V下,混合溶液P2W18O626-@Tb3+的紫外可见动力学曲线 (a)、紫外可见光谱 (b)、荧光动力学曲线 (c)和荧光光谱 (d)Fig.7 UV-Vis kinetic curves(a),UV-Vis absorption spectra(b),fluorescence kinetic curves(c)and fluorescence spectra(d)of the mixed solution P2W18O626-@Tb3+when applied redox potential-0.85/0.85 V

图8 多酸阴离子P2W18O6212-、P2W18O626-的紫外可见吸收光谱与Tb3+的荧光光谱 (a)及电致变色/荧光开关过程的机理示意图 (b)Fig.8 UV-Vis spectra,fluorescence spectra of Tb3+(a)and the mechanism of electrochromic and luminescent switching process(b)of the polyanions P2W18O6212-and P2W18O626-
将Tb3+离子的荧光发射光谱与多酸阴离子的可见吸收光谱重叠,在外加还原电位-0.85 V下,多酸阴离子P2W18O626-得到6个电子被还原成P2W18O6212-,同时在可见区出现宽的吸收峰(图8a,蓝线),而Tb3+的荧光发射峰完全被P2W18O6212-的吸收光谱所覆盖(图8a,绿线),二者可以发生分子间荧光共振能量转移(fluorescence resonance energy transfer,FRET)[26],能量给体Tb3+将辐射出的能量转移给能量受体P2W18O6212-,进而导致Tb3+的荧光淬灭;而在外加氧化电位0.85 V下,电化学还原态多酸阴离子P2W18O6212-失去6个电子重新被氧化成P2W18O626-,可见区的吸收峰消失(图 8a,黑线),此时 P2W18O626-不能吸收Tb3+所辐射的能量,Tb3+的荧光恢复,溶液P2W18O626-@Tb3+呈现出可逆的电致变色及电化学调控荧光开关效应。图8b为P2W18O626-@Tb3+混合体系电致变色/荧光开关能量转移过程示意图,在外加还原电位-0.85 V下,多酸得到电子被还原成P2W18O6212-,由无色变为蓝色,能够吸收Tb3+发射出来的绿光,导致Tb3+的荧光淬灭;而在外加氧化电位0.85 V下,P2W18O6212-失去电子被氧化成P2W18O626-,由蓝色变为无色,此时P2W18O626-与Tb3+之间不发生能量转移,Tb3+的荧光恢复。
2.3 氧化还原电位对电致变色及荧光开关性能的影响
在外加不同氧化还原电位±0.38、±0.69、±0.85 V下,对P2W18O626-@Tb3+混合溶液的电致变色及电化学调控荧光开关性质进行研究。利用紫外可见动力学方法对溶液的电致变色响应速度进行考察,随着还原电位的减小(-0.38、-0.69、-0.85 V),多酸阴离子P2W18O626-得电子数增大,分别获得2e、4e、6e的还原产物,溶液着色平衡所需的时间逐渐缩短 (图9a),着色平衡时750 nm处的吸光度逐渐增强;随着氧化电位的增大,溶液褪色过程所需的时间逐渐缩短(图9b)。同时,随着还原电位的减小,着色平衡后溶液的蓝色逐渐加深,在可见区400~800 nm区间内的吸收峰逐渐增强(图9c);而随着还原电位的减小,溶液在460~700 nm区间的荧光发射峰逐渐降低,荧光淬灭程度逐渐增大 (图9d),在还原电位-0.38、-0.69、-0.85 V下溶液的荧光开关能量转移效率分别为85.97%、87.53%、93.42%。
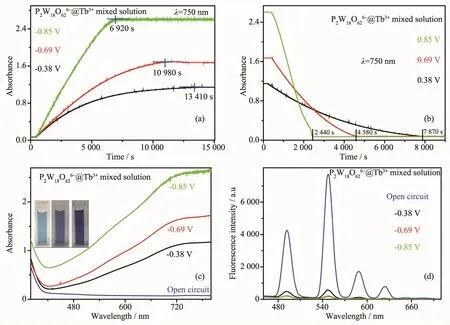
图9 混合溶液P2W18O626-@Tb3+在不同还原电位 (a)、氧化电位 (b)下的紫外可见动力学曲线;混合溶液P2W18O626-@Tb3+在不同还原电位下的紫外可见光谱 (c)、荧光光谱(d)Fig.9 UV-Vis kinetic curves of P2W18O626-@Tb3+mixed solution at different reduction potentials(a)and oxidation potentials(b);Corresponding UV-Vis spectra(c)and fluorescence spectra(d)of P2W18O626-@Tb3+mixed solution at different reduction potentials
2.4 基于P2W18O6212-@Tb3+溶液电致变色-荧光开关性质对H2O2的光谱检测
将电化学还原与H2O2氧化法相结合,基于P2W18O626-@Tb3+溶液可逆变色-荧光开关性质实现了对H2O2紫外可见、荧光双光谱检测(图10)。在外加还原电位-0.85 V下,P2W18O6212-@Tb3+溶液在可见区400~800 nm范围内出现宽的吸收峰(图10a);与此同时溶液在460~700 nm范围内的荧光发射峰降低,荧光淬灭(图 10c)。 而在 0.04、0.08、0.12、0.16、0.20、0.24、0.28 mmol·L-1的 H2O2作用下,P2W18O6212-被氧化成P2W18O626-,溶液的蓝色逐渐消失,随着H2O2浓度的增大可见区的吸收峰逐渐降低,以750 nm处的吸光度对H2O2的浓度作图,得到吸光度(A)对H2O2浓度(C)的线性检测方程A=-8 956.5C+2.636 8(线性相关系数r=99.4%),该紫外可见光谱法对 H2O2浓度检测的线性范围为 1.76×10-5~0.28 mmol·L-1,检出限 CL=kSN/m=1.76×10-2μmol·L-1(其中m为标准曲线的斜率,值为-8 956.5 L·mol-1;SN为标准偏差,值为 5.42×10-5;k为置信因子,值为 3)(图10b);与此同时,随着H2O2浓度的增大溶液在460~700 nm范围内的荧光发射峰逐渐增强、荧光恢复,以547 nm处荧光强度的对数对H2O2浓度作图,获得荧光检测的线性方程lnI=12 849.9C+4.955 1(线性相关系数r=96.5%),该荧光光谱法对维生素C浓度的线性检测范围为 3.04×10-3~0.28 mmol·L-1,检出限 CL=kSN/m=3.04 μmol·L-1(其中 m=12 849.9 L·mol-1;SN=1.30×10-2;k=3)(图 10d)。
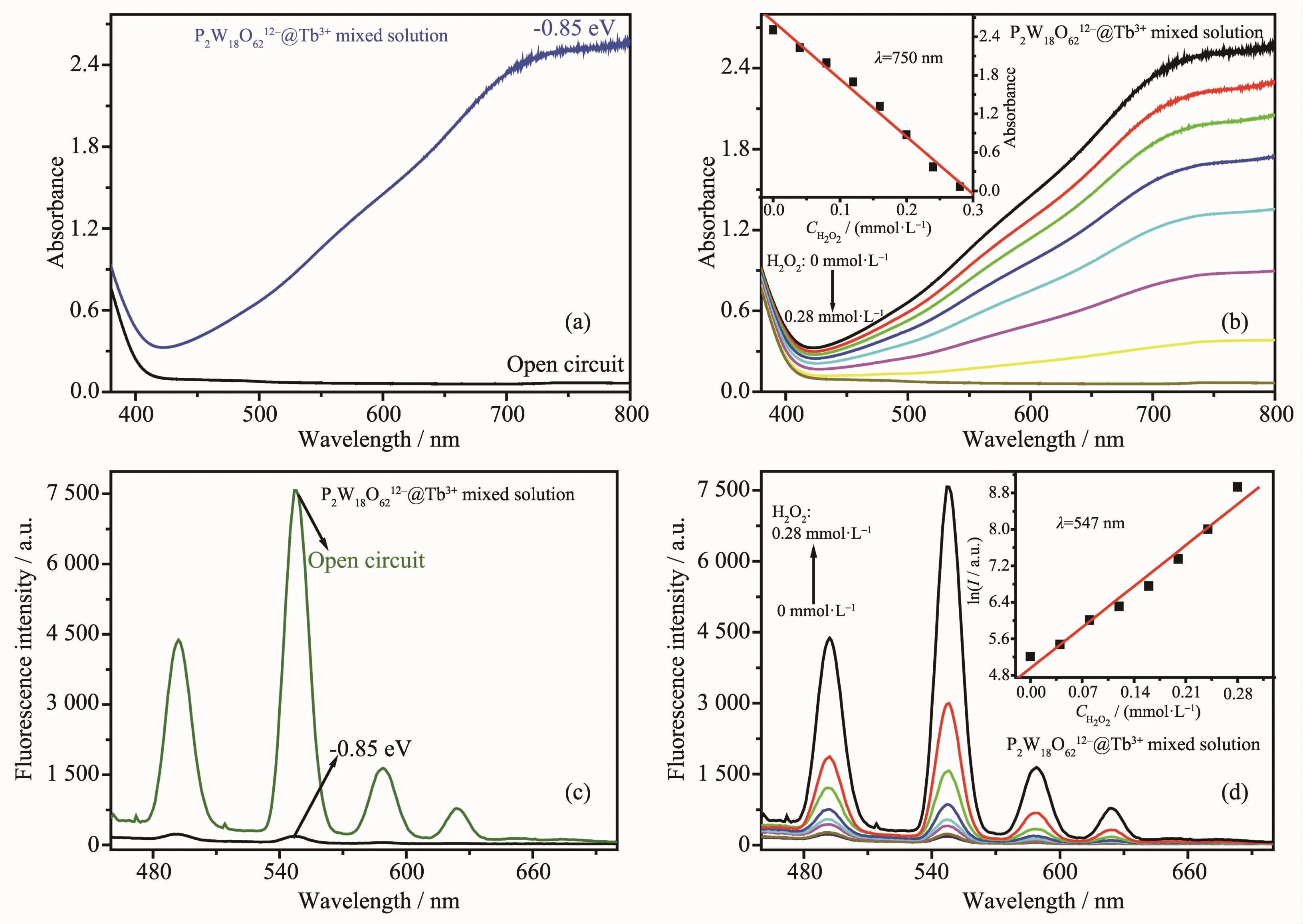
图10 在-0.85 V下P2W18O6212-@Tb3+溶液的紫外可见光谱 (a)及荧光光谱 (c),在不同浓度H2O2下溶液的紫外可见光谱 (b)及荧光光谱 (d)Fig.10 UV-Vis spectra(a)and fluorescence spectra(b)of P2W18O626-@Tb3+mixed solution when applied a reduction potential-0.85 V;UV-Vis spectra(c)and fluorescence spectra(d)of P2W18O6212-@Tb3+mixed solution with different H2O2concentrations
3 结 论
在外加氧化还原电位±0.85 V下,实现了P2W18O626-@Tb3+混合溶液可逆的电致变色及荧光开关双功能性质,荧光开关的机理归属于变色多酸P2W18O626-与绿光Tb3+分子间荧光共振能量转移。通过控制还原电位-0.38、-0.69、-0.85 V分别获得多酸阴离子P2W18O626-的2e、4e、6e还原产物,随着还原电子数的增加P2W18O626-@Tb3+混合溶液电致变色着色能力增强、响应速率加快;同时,溶液的荧光淬灭程度逐渐增大,荧光开关能量转移效率分别为85.97%、87.53%、93.42%。最后利用电化学还原态P2W18O6212-@Tb3+溶液对H2O2紫外可见、荧光双光谱检测,紫外可见光谱法对H2O2检测的线性方程为A=-8 956.5C+2.636 8, 线性检测范围为 1.76×10-5~0.28 mmol·L-1,检出限为 1.76×10-2μmol·L-1;荧光光谱法对H2O2检测的线性方程为lnI=12 849.9C+4.955 1,线性检测范围为 3.04×10-3~0.28 mmol·L-1,检出限为 3.04 μmol·L-1。该研究对多酸基变色/荧光开关体系的设计及其在生化传感领域的应用具有一定的理论及实际意义。
