磺胺类药物代谢与残留消除以及检测方法研究进展
2019-03-12孙亚奇郭京超潘源虎刘振利袁宗辉
孙亚奇,郭京超,潘源虎,刘振利* ,王 旭* ,袁宗辉
(1.华中农业大学动物医学院,武汉430070;2.华中农业大学国家兽药残留基准实验室(HZAU)、农业部食品兽药残留检测重点实验室,武汉430070)
磺胺类药物(Sulfonamides,SAs)通常是指一类在其化学结构中含有对氨基苯磺酰胺结构的人工合成抗菌药物,用于治疗和预防人类及动物的感染性疾病。磺胺类药物通过干扰敏感菌的叶酸代谢而抑制细菌的生长繁殖,由于具有抗菌谱广、性质稳定、价格低廉、便于大量生产等优点,已被广泛应用于临床多年[1]。在畜牧业和水产养殖业中,磺胺类药物通常作为饲料添加剂用于促进动物的生长[2-3]。尽管磺胺类药物广泛应用于临床,但也存在一些毒副作用,例如,它能够引起过敏反应甚至甲状腺疾病[4-5],抑制骨髓细胞、红细胞或血小板的生成,造成造血系统损害,对动物的肾脏产生毒害作用等。过度使用此类药物,不仅会在动物源性食品中产生残留,而且会对人类的身体健康产生危害[6]。为了确保消费者食品安全,中国及欧盟等都提出了食品中允许的磺胺类药物的最大残留限量(MRL)不应超过 100 μg/kg[7]。近年来,国内外有很多关于磺胺类药物代谢与残留的研究,其主要集中于磺胺类药物代谢动力学方面,而关于磺胺类药物代谢方面的研究鲜有报道。因此,了解并掌握磺胺类药物在动物体内的代谢、消除及残留分布规律,不仅对安全用药,制定合理的休药期具有重要的意义,而且有助于对磺胺类药物的监管工作。本文综述了国内外有关动物中使用磺胺类药物代谢与残留消除以及检测方法最新进展,以期为磺胺类药物的合理使用及开发新的残留检测技术提供理论依据。
1 磺胺类药物代谢动力学研究进展
磺胺类药物在体内主要是通过N4-乙酰化,羟基化和N1-葡萄糖醛酸化3种途径进行代谢[8],这主要取决于药物的化学结构以及不同物种中酶的组成的不同(其分子结构及主要代谢途径如图1所示)。由N-乙酰基转移酶(NAT2)催化磺胺类药物形成乙酰化代谢物,由CYP2C9催化磺胺氧化成羟胺代谢物[9],由葡萄糖醛酸转移酶催化形成N1-葡萄糖醛酸结合物。N4-乙酰化代谢物和葡萄糖醛酸代谢物均无抗菌活性,而羟化的代谢物具有抗菌活性且与甲氧苄啶合用时抗菌活性增强。磺胺类药物的代谢周期因结构不同而差异较大,短效磺胺类药物,如磺胺二甲基嘧啶的半衰期小于8 h,中效磺胺类药物,如磺胺嘧啶的半衰期在10 h以上,长效磺胺类药物的半衰期大于30 h,如磺胺邻二甲氧嘧啶的半衰期达到1周。
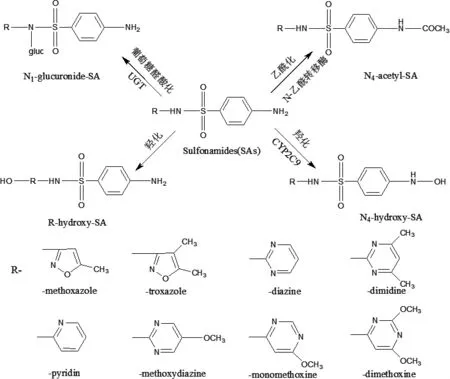
图1 磺胺类药物的分子结构及代谢途径Fig 1 Molecular structure and metabolic pathway of sulfonamide antibiotics
1.1 磺胺类药在各种属体内的代谢研究 磺胺间二甲氧嘧啶(Sulphadimethoxine,SDM)又称磺胺地索辛,属于长效类磺胺药。其主要代谢方式有:N4-乙酰化和N1-葡萄糖醛酸化,另外在有些物种的尿液中发现有少量的N4-葡萄糖醛酸结合物和N4-硫酸盐。在人体内,N1-葡萄糖醛酸结合是主要的代谢方式,占代谢比例的61%,N4-乙酰化占21%,还有8%的N4-葡萄糖醛酸结合产物以及N4-硫酸盐产物。在豚鼠体内,N4-乙酰化是主要的代谢方式,占66%,除此之外还有少量的葡萄糖醛酸结合产物。
磺胺二甲嘧啶(Sulfadimidine,SM2)属于短效类磺胺药,抗菌作用稍弱,其乙酰化衍生物均易于溶解,毒性较低[10]。SM2主要的代谢方式有:乙酰化、羟化以及葡萄糖醛酸结合。其中羟化包括嘧啶环的5位和侧链甲基上的羟化,羟化代谢物可再进行葡萄糖醛酸化和乙酰化。SM2在人、兔、猴、鱼体内的的主要代谢方式是乙酰化,其次是羟化。猪体内只发生乙酰化,检不出羟化代谢物。在反刍动物、家禽、龟和蜗牛体内的羟化大于乙酰化。狗的血和尿中能检出羟化物,不能检出N4SM2[11]。
磺胺甲噁唑(Sulfamethoxazole,SMZ)在人和动物(猪、蜗牛、牛、鱼等)体内的代谢研究已经完成,发现其代谢方式主要有乙酰化和羟化两种。据报道,SMZ 的消除半衰期在人 9.5 h,狗 8 h,马 5 h,牛2.5 h,水牛 7 h,猪 3 h,绵羊 2 h,猫 10 h。SMZ 在人、猫、猪、反刍动物中的代谢方式主要是乙酰化,但在狗、归巢鸽、蜗牛和水龟体内羟基化占优势。SMZ在猪体内主要通过乙酰化进行代谢,在猪的血浆和尿液中不能检测到羟基和葡糖苷酸衍生物[12]。
综上所述,磺胺类药物在人和在不同种属动物体内的代谢途径和代谢产物不同。这可能是因为不同种属动物体内参与磺胺类药物代谢酶(P450酶)的组成以及它在不同种属体内基因表达上存在差异[13]。
1.2 磺胺类药物在不同动物体内的代谢动力学研究 目前对于磺胺类药物的代谢动力学研究主要集中于水产动物,因此,本文主要就水产动物的代谢动力学进行综述。
同一种磺胺类药物在同种动物体内不同组织的代谢情况不同。邓建朝等[14]研究了SMZ在青石斑鱼各组织中代谢动力学的不同。试验中一次性投喂含有200 mg/kg SMZ的饲料,结果表明,SMZ在青石斑鱼肝脏中的含量最高,其次是背肌、血浆、肾脏,鳃中的含量最低。SMZ在青石斑鱼肾脏中的半衰期最长,其次是鳃、背肌、血浆,肝脏中SMZ的半衰期最短。SMZ在青石斑鱼肾脏中代谢速度最慢,肝脏中代谢速度最快。
环境温度改变会引起磺胺类药物在水产动物体内药代动力学参数的改变。Ginneken等[15]研究了温度对SM2在鲤鱼中的药代动力学的影响。在10℃、20℃下以100 mg/kg的剂量单次尾静脉注射SM2,试验结果表明,与10℃相比,在20℃时SM2的表观分布容积(Vd)显著降低,消除半衰期(t1/2β)显著缩短,体清除率(CL)显著升高。林伟[16]也研究了温度对SMZ在长丝鲈体内药动学的影响。与25℃相比,在30℃时SMZ在鱼体血浆和肌肉中的分布较慢,而消除也慢。这种现象表明环境温度对水产动物的药代动力学参数有显著影响。在一定温度范围内,温度越高,与药物代谢相关的酶的活性越强,药物在动物体内的代谢也就越快。因此在水产动物给药时应考虑到环境温度这个因素,尤其是当水温较低时应适当延长休药期。
动物年龄会影响磺胺类药物在体内的代谢。Janus等[17]研究了年龄对犊牛中SM2药代动力学的影响。试验选取10日龄犊牛和20日龄犊牛各10只,以44 mg/kg的剂量单次口服给药。结果表明,犊牛的年龄对磺胺二甲嘧啶的药代动力学参数有显著影响。观察到与10日龄犊牛相比,20日龄犊牛中SM2的Vd显著增加,平均停留时间(MRT)显著降低,CL显著升高。参与磺胺二甲嘧啶代谢的酶的含量和活性随着犊牛的年龄而增加。
同一种磺胺类药物随给药次数的不同而代谢不同。王伟利等[18]研究了给药次数对吉富罗非鱼(Oreochromis niloticus)中磺胺嘧啶(SD)药代动力学的影响。试验分为120 mg/kg单次饲喂组和连续5 d饲喂组,结果表明,单次给药下磺胺嘧啶在吉富罗非鱼肾脏中的消除半衰期最长,其次是血浆、肝脏、肌肉,在肾脏中的消除最慢。连续给药情况下磺胺嘧啶在吉富罗非鱼体内的浓度显著高于单次给药。
给药方式会影响磺胺类药物在动物体内的代谢。艾晓辉等[19]研究了给药方式的不同对SMZ在草鱼体内的药代动力学的影响。试验中分别采用口灌和腹腔注射的给药方式,以100 mg/kg剂量单次给药,结果表明,相较于口服给药,腹腔注射给药时SMZ在草鱼血浆和肌肉中的吸收、分布与消除速度都更快。血浆中SMZ的分布半衰期(t1/2α)为0.596±0.117 h,t1/2β为 9.85±0.64 h,肌肉中 SMZ 的t1/2α为 0.535±0.421 h,t1/2β为 9.73±0.58 h。
同品种鱼类不同组织对不同种磺胺类药物的吸收、分布、代谢及消除存在较大差异。李金宝等[10]研究了SM2、SD 及磺胺对甲氧嘧啶(SMD)这3种磺胺类药物在中国对虾体内的药代动力学特征。试验期间,以100 mg/kg的剂量单次口服3种磺胺类药物。结果表明,CYP2C参与磺胺类药物在中国对虾体内的代谢,是磺胺类药物的一个主要代谢酶;SMD在中国对虾体内分布比SM2、SD更广泛,且吸收量最多,消除半衰期最长,清除率最低,表明SMD的药效更加持久。
综合以上分析,同种磺胺类药物在不同种动物不同组织的代谢不同,不同种磺胺类药物在同种动物不同组织的代谢不同。磺胺类药物在动物体内的吸收、分布、代谢及消除与动物的年龄、性别以及投喂次数、不同给药途径还有环境温度都有关。因此在实际生产中要根据药物使用情况和自身养殖条件灵活地把握休药期。
2 残留消除规律及检测方法研究
2.1 磺胺类药物在动物体内的残留消除规律研究我国农业部235号公告规定,磺胺类药物在所有食品动物的肌肉、脂肪、肝、肾和牛奶中的最高残留限量为100μg/kg。通常磺胺药在肝脏和血液中浓度最高,在脂肪和肌肉中的含量较低[10]。磺胺类药物的残留标示物为原形药物,残留靶组织为肝脏。对于磺胺类药物的残留消除研究,目前研究最多的是水产动物,因此,本文着重介绍水产动物的残留消除规律。
侯延龙等[20]在(18±1)℃水温条件下,对彭泽鲫采用多剂量混饲和口灌两种方式给药,研究了SMZ在彭泽鲫体内的残留消除规律,剂量为150 mg/kg,连续给药10 d。结果表明:SMZ在彭泽鲫肌肉中浓度最高,肾脏中最低。口灌给药需要22 d各组织中的残留量才满足要求,而混饲给药则需要24~25 d。与口灌给药相比,混饲给药各组织中的SMZ残留量要低,且残留消除速度要慢。这说明给药方式不同残留消除速度不同,从而休药期不同,因此在实际养殖用药时应注意给药方式对休药期的影响。
陈进军等[21]研究了在(27±1)℃水温条件下,以100 mg/kg单剂量口灌给药复方磺胺嘧啶后,SD在拟穴青蟹(Scylla paramamosain)体内的分布和残留消除规律。结果显示:SD在肝胰腺中含量最高,消除最为缓慢,需要6 d才能满足最大残留限量,而肌肉和鳃仅需4 d即可满足要求,说明药饵或口灌给药途径下,肝胰腺可能是残留靶器官。
鞠晶等[22]在(28±2)℃水温条件下,对吉富罗非鱼分别采用单次给药和连续给药,研究了磺胺间甲氧嘧啶(SMM)在罗非鱼体内的药代动力学及残留消除规律。结果显示:以200 mg/kg剂量单次混饲给药后,SMM在各组织中的含量依次为,肝脏>肾脏>血液>肌肉,并且在肌肉和血液中的消除快于肝脏、肾脏。按200 mg/kg的剂量连续5 d给药后,SMM在肌肉中的含量降低到0.1 mg/kg的时间约为120 h,建议休药期不低于5 d。
孙晨明等[23]采用高效液相色谱法研究复方磺胺氯吡嗪钠混悬液在鸡体内的残留消除规律。实验以300 mg/L饮水连续7 d混饮给药,对每只鸡的肌肉、肝脏、肾脏和皮脂进行残留量的检测。结果表明:磺胺氯吡嗪在肌肉中的消除要快于其他组织,而在皮脂中消除最为缓慢,在停药第7天低于最大残留限量,休药期为7 d。徐维等[24]采用高效液相色谱-串联质谱法研究SMD和二甲氧苄啶(DVD)预混剂在白羽肉鸡体内的残留消除规律。实验以添加1000 mg/kg SMD和DVD预混剂的全价饲料连续饲喂10 d,结果表明,SMD在白羽肉鸡肾脏中残留量最高,其次是肝脏,肌肉中残留量最低,建议休药期为7 d。
韩冰等[25]在(20±0.5)℃水温条件下采用高效液相色谱法研究了复方磺胺甲噁唑在松浦镜鲤体内的残留消除规律。实验以50 mg/kg的剂量连续5 d口灌给药,结果表明:SMZ在肌肉中的消除要快于血浆和皮,在停药第9天开始所有检测组织中SMZ已全部低于最大残留限量,建议休药期至少为15 d。
综合以上分析,磺胺类药物在不同水产动物体内消除速度不同,并且不同组织消除速度也不同,相比较而言肌肉中的消除速度最快。磺胺类药物在水产动物上的消除也因给药方式、给药剂量、环境水温、动物种属和药物种类等有很大的差别,因此,在实际生产时应根据自身的养殖条件去灵活的把握药物的休药期。
2.2 磺胺类药物残留检测方法研究 目前,磺胺类药物的检测方法主要有微生物学法、理化分析方法和免疫法等。
微生物学法的原理是利用微生物与药物的作用来检测样品中磺胺药的种类和含量。该法简便、费用低,一般实验室都可操作。磺胺类药物的微生物检测方法有很多,包括STOP法、CAST法、FAST法等。目前应用最多的是FAST法,因为相较于另外两种方法,FAST法具有高敏感性和检测分析快速性且最低残留限量更低[26]。
理化分析法常作为确证方法检测动物组织中磺胺类药物的残留,主要有高效液相色谱法(HPLC)、液相色谱-串联质谱法(LC-MS)、气相色谱法(GC)、气相色谱-质谱法(GC-MS)、高效毛细管电泳法(HPCE)等。
高效液相色谱法是实验室最为普遍的磺胺类药物检测方法,最常用的有紫外检测器(UVD)、荧光检测器(FLD)、电化学检测器(ECD)以及二极管阵列检测器(DAD)等[27]。由于磺酰胺具有苯环结构,因此可用紫外检测器进行检测。Ke-jun Deng[28]采用HPLC-UV测定鸡肝中磺胺醋酰,磺胺噻唑(STZ),SM2和磺胺甲氧基哒嗪(SMP)残留量,该方法使用固相萃取(SPE)和分散液液相微萃取(DLLME)技术进行样品前处理,C18液相色谱柱进行分离。检测限为 0.4~8.4 μg/kg。加标回收率范围为70.2%~91.4%,相对标准偏差小于5.35%。在有许多杂质峰干扰的情况下,可用二极管阵列检测器进行检测,可以有效避免样品基质中杂质的干扰。Premarathne等[29]报道采用 HPLC-DAD 检测方法可同时测定鸡和鸡蛋中的七种磺胺类药物(SD,STZ,磺胺吡啶(SPD),磺胺甲基嘧啶(SMR),SM2,SMZ和SMP)。样品用蒸馏水:乙酸乙酯(1∶3)液-液萃取进行提取,正庚烷脱脂,平均回收率在86%~108%之间,检测限为129至140 ppb。磺胺类药物结构中含有氨基,也可采用衍生技术进行荧光在线衍生,荧光检测器检测。许旭[30]建立了HPLC-FLD测定牛肉中16种磺胺残留量的方法。该方法采用改良QuEChERS进行样品前处理,然后取上清液与荧光胺柱后在线衍生,荧光检测器检测。检测限为 1.6~8.2 μg/kg,加标回收率范围为66.6%~109.5%。由于 HPLC 分析速度较慢,对中药等组分较复杂的样品分离比较困难,筛查效率较低。近几年来超高效液相色谱法(Ultra Performance Liquid Chromatography,UPLC)逐渐发展起来。UPLC的色谱柱采用小粒径填料,更小的孔径有利于物质的分离,也有利于缩短分析时间,提高分析通量。相较于HPLC,UPLC的分离效率、峰容量以及灵敏度都更高[31]。
液质联用技术目前也被广泛地应用于磺胺类药物的分离检测,与液相色谱相比具有分离效率高、分析时间短、准确率高等优点[32]。程国栋等[33]采用超高效液相色谱-串联质谱(UPLC MS/MS)测定调制乳中三种磺胺类药物的残留量,该方法使用乙酸水溶液和甲醇进行提取,提取液经HLB固相萃取柱净化。该方法的定量限为1μg/kg,平均加标回收率为76.5%~101.9%,此方法适用于调制乳中磺胺类药物残留的确证检测。Abdallah[34]开发了一种LC-MS/MS方法,用于测定23种磺胺类药物在可食性组织中的残留。使用QuEchers方法进行样品前处理,Zorbax Eclipse XDB-C8色谱柱(100 mm×2.1 mm,3.5 μm) 分离,采用电喷雾正离子电离,多反应监测模式检测。该方法的检测限和定量限范围分别为 0.5~14.5 μg/kg 和 1.8~48.4 μg/kg。Xiaojing Li等[35]建立了一种 QuEChERS-分散液液微萃取结合超高效液相-串联质谱快速检测猪肉样品中19种磺胺类药物残留的检测方法。样品经QuEChERS前处理,分散液液微萃取富集,BHE C18柱分离,以乙腈和0.1%甲酸作为流动相梯度洗脱,采用多反应监测正离子模式测定,检出限为0.04~0.49 μg/kg,平均加标回收率在 78.3% ~106.1%范围内。Haixiang Zhao等[36]建立了多壁碳纳米管为吸附剂的固相萃取净化-高效液相色谱-紫外检测测定猪肉和鸡肉中12种磺胺类药物多残留的方法。样品采用乙腈提取,多壁碳纳米管固相萃取净化。检测限为 0.003 mg/L,定量限为 0.01 mg/L,9 种磺胺类药物的回收率高于70%。
气相色谱-质谱联用法是将气相色谱和质谱通过接口连接起来,将复杂化合物分析分离成单组分之后进入质谱进行成分检测的方法。赵晓凤等[37]利用气相色谱-串联质谱法检测猪肉组织中的磺胺二甲嘧啶残留量。样品脱脂后,采用二氯甲烷提取样品中的目标化合物,经萃取、硅烷化衍生后,用气相色谱-串联质谱法检测。该方法快速准确,干扰较少。检测限为0.01 mg/kg,加标回收率为76%~110%。
近几年来,由于磁性功能材料的讯速发展,将磁性功能材料与固相萃取技术相结合用于磺胺类药物的残留检测已有报道。与传统固相萃取相比较,磁性固相萃取(MSPE)最主要的优势是不需要萃取柱,容易吸附,并且目标化合物能从固定相上简单、快速地分离,能大大缩短分析时间[38]。Pengzhi Shi等[39]制备了 Fe3O4-氧化石墨烯(Fe3O4-GO)纳米复合材料,并将其作为磁性吸附剂进行样品前处理,再用HPLC-DAD对水中的三种磺胺类化合物(SD、SM2、STZ)进行检测。测得检测限在 0.05~0.10 μg/mL 之间,回收率在 67.4% ~119.9%之间。Hongyuan Yan等[40]采用微型化石墨烯管尖萃取(M-G-PTE)方法,结合 HPLC-UV 检测技术,对牛乳中的SM2、磺胺氯哒嗪 、SMM、磺胺氯吡嗪进行了残留检测。与C18、HLB和多壁碳纳米管相比,M-GPTE对磺胺类化合物的吸附性能更好。检测限为0.004~0.012 μg/g,加标回收率在 90.1%~113.5%。该方法简单、经济、灵敏,产生的有机污染少,可用于复杂牛乳样品中磺胺类药物的快速筛选。Mengyu Qi等[41]建立了一种基于氧化石墨烯/聚吡咯(GO/PPy)的管尖固相萃取技术(PT-SPE),与高效液相色谱相结合,用于检测蜂蜜和牛奶样品中的磺胺类化合物。测得检测限为1.04~1.50 ng/mL,平均回收率为 62.3%~109.0%。该方法快速、灵敏、准确,适用于复杂成分中的磺胺类药物分析。
高效毛细管电泳法是近年来发展的一种新的检测技术,具有高效、快速、微量和环境污染小等优点。张琳婧等[42]采用固相萃取-毛细管电泳法同时检测牛奶中5种磺胺类药物的含量。该方法能使5种磺胺类药物在16 min内得到完全分离,检测限为 4 mg/L,平均加标回收率为 100.8%~104.1%。该法简单、可靠,灵敏度高,适用于牛奶中磺胺类药物残留的检测。
免疫分析法主要为酶联免疫法(ELISA)与化学发光微粒子免疫分析法(CMIA)[43],胶体金免疫层析技术[44],该法灵敏度高、操作简单、检测成本低、可批量检测,具有较好的发展前景。
酶联免疫吸附法的特点是操作简便、灵敏度高、可实现大量样品的通量化检测。Wenxiao Jiang等[45]开发了一种新的双比色酶联免疫吸附法(DCELISA),可同时检测牛奶中22种磺胺类药物。该方法将两种不同的酶(碱性磷酸酶和辣根过氧化物酶)同时用于单次免疫测定的每个孔中,用于检测多种低分子量化合物。磺胺类药物的检测限为5.8 ng/mL。何进等[46]采用化学发光微粒子免疫分析法对鸡肉、鱼肉、虾肉中的磺胺类药物残留进行检测,方法灵敏度为1μg/kg,3类样品的最低检测限均为0.864μg/kg。磺胺类药物在鸡肉中添加回收率为 94.36%~100.11%,RSD 为 1.2%~6.5%;与液相色谱串联质谱相比,检测结果一致,但检测时间短、前处理简单、成本低、批次检测量大。Haasnoot[47]建立了一种生物传感器免疫测定法(BIA)来检测鸡血清和血浆中的SMZ和SD。该方法分析速度快(每个样品5 min),样品制备容易(仅在含有抗体的缓冲液中稀释),并且两种磺胺类药物的检测限均低于 10 ng/mL。Dapeng Peng[48]利用分子印迹聚合物(MIP)作为人工识别元件,结合SPE建立了一种分子印迹-酶联免疫分析法(MI-ELISA)。该方法用于检测SM2在猪肌肉中的残留量,检测限和定量限分别为 6.8 μg/kg、20.4 μg/kg,是一种快速有效的检测方法。
3 展望
本文着重总结了近年来磺胺类药物在水产动物体内的代谢与残留消除研究进展,表明环境温度、动物的种属、年龄以及投喂次数、不同给药途径等都会对其在动物体内的代谢与消除造成明显影响,这也使得磺胺类药物在动物体内的休药期会因养殖条件不同而有所变化。磺胺类药物的代谢存在明显的种属差异性,而目前对于磺胺类药物的代谢研究仅仅局限于畜禽中的几种动物,但实际用药中,仍有许多其他特种动物也在使用,而磺胺类药物在这些动物体内的代谢途径尚不清楚,代谢物不明确,有可能会产生毒性效应和残留。因此,有必要扩大磺胺类药物在各种属动物上的代谢研究。另外,目前对于磺胺类药物代谢酶尚未开展系统的研究。研究磺胺类药物代谢酶有助于明确和其他药物之间在体内的相互作用,同时有助于指导磺胺类新药的开发。
磺胺类药物的残留与代谢密不可分,剂型、给药途径、剂量、种属、年龄以及联合用药等影响代谢的因素均能影响其在动物体内的残留消除。现如今磺胺类药物在食源性动物体内残留超标严重,寻找一种快速有效的残留预测方法就显得尤为重要。已有研究表明生理药动学(physiologically based pharmacokinetics,PBPK)模型可用于预测药物在动物体内的残留[49],因此基于PBPK模型的特点和优势结合计算机技术开发一种磺胺类药物残留预测模型在指导磺胺类药物的合理使用以及残留监管上具有实际意义。
基于现场监控和基层检测磺胺类药物的残留需要,开发更加简便、快速、灵敏,适合基层的临床检测技术尤为重要。近些年来随着纳米材料、免疫生物材料等新型材料的快速发展而发展起来的简便快速甚至自动化的样品前处理方法将是检测磺胺类药物残留的重要发展趋势。
