猪繁殖与呼吸综合征病毒N蛋白间接ELISA方法的建立
2019-03-12陈汉锶林旭埜田允波齐冬梅邹伟斌胡美容
陈汉锶,林旭埜* ,田允波,齐冬梅,邹伟斌,胡美容
(1.仲恺农业工程学院动物科技学院,广州5102252;2.广东永顺生物制药股份有限公司,广州511356)
猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)是单股正链不分节段的RNA病毒,属于动脉炎病毒科、动脉炎病毒属;即是作为全球猪业疾病的猪繁殖和呼吸综合征(PRRS)的病原[1]。PRRSV于1987年在美国爆发随后相继在其他国家蔓延[2-3];2006 年,PRRSV在中国爆发。PRRSV目前分为欧洲型(基因Ⅰ型)和美洲型(基因Ⅱ型)两个血清型,中国主要流行的是美洲 型 PRRSV(NA - PRRSV)[4-5]。PRRSV基因组全长15 kb左右,至少由ORF1a、ORF1b、ORF2a、ORF2b、ORF3~ORF7 等 9 个开放阅读框(ORF)组成,其中 ORF7编码GP7蛋白(又名 N 蛋白)[6-8]。N 蛋白含量较高,占 PRRSV 病毒蛋白达 20%~40%[9];N蛋白具有较强的免疫原性,在感染后的早期阶段就可刺激机体产生持续期比较长的特异性抗体,这对PRRSV的早期诊断具有重要意义[10-12]。
ELISA方法具有成本低、安全、特异性和灵敏度较高、方便在基层推广应用的优点,临床检测PRRSV抗体一般都是采用ELISA方法[13]。目前国内普遍采用国外的ELISA试剂盒进行PRRSV抗体的检测,但价格昂贵,大大提高了PRRSV的流行病学监测和诊断成本,不利于推广。本试验以表达纯化的PRRSV-N蛋白为包被抗原,优化ELISA检测方法的各种条件建立了检测PRRSV抗体的间接ELISA检测方法,通过进一步优化工艺,期望能开发出特异性、敏感性、稳定性均较好的猪呼吸与繁殖综合征抗体检测间接 ELISA试剂盒,降低PRRSV的监测和诊断成本。
1 材料
PRRSV-GDr180、伪狂犬病毒(PRV)、猪瘟病毒(CSFV)、猪肺炎支原体(MHP)、口蹄疫病毒(FMD)、猪细小病毒(PPV)、猪乙型脑炎病毒(JEV)、猪圆环病毒2型病毒(PCV2)标准阳性血清,PRRSV-GDr180标准阴性血清,由广东永顺生物制药股份有限公司中心实验室提供;HRP酶标羊抗猪二抗购自abcam公司;酶标板购自广州洁特生物过滤股份有限公司;显色底物购自康为世纪生物科技有限公司。
2 方法
2.1 重组蛋白基因质粒的构建
2.1.1 N基因片段的 pcr扩增 从 GenBank上下载PRRSV GD株(GenBank登录号:EU825724)的基因组序列,设计一对引物并加上Bam HⅠ限制性酶切位点和Hin dⅢ限制性酶切位点,送上海生工合成引物后,以PRRSV病毒CDNA为模板进行PCR扩增,1%琼脂糖凝胶电泳观察目的片段并回收保存。
2.1.2 pET32a-PRRSV-N 重组载体的构建与鉴定利用Bam HⅠ和Hin dⅢ分别对pET32a(+)载体和回收的N基因片段进行双酶切,将酶切回收产物pET32a(+)载体和N基因片段用T4连接酶连接后转化DH5α大肠杆菌感受态细胞,然后将细胞涂在氨苄霉素抗性的LA平板上,37℃过夜培养,从平板上挑取单菌落并过夜培养,提取质粒进行双酶切鉴定,再把pET32a-PRRSV-N重组质粒转进BL21(DE3)大肠杆菌感受态细胞,然后按同上的方式培养以及鉴定,并将阳性重组质粒送往上海生工生物技术有限公司进行测序。
2.2 重组蛋白的表达及纯化
2.2.1 重组N蛋白表达及SDS-PAGE鉴定 取阳性重组质粒的表达菌37℃振荡培养至OD600为0.6左右时,加入终浓度为1 mmol/L IPTG于37℃诱导5 h,10000 r/min离心收菌,超声破碎,然后离心收集上清裂解液和沉淀,通过 SDS-PAGE电泳分析,确定重组蛋白是可溶性表达还是包涵体表达。
2.2.2 重组蛋白的 Ni-NTA树脂纯化 重组蛋白大量表达后,利用HIS蛋白纯化试剂盒进行纯化,并用SDS-PAGE电泳鉴定纯化的效果,用BCA试剂盒测定纯化后的蛋白浓度。
2.3 重组蛋白的Western blot分析 纯化的重组N蛋白,pET32a空载体诱导表达菌经过SDS-PAGE电泳,再转印至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,1%BSA 37℃封闭 1 h,PBST洗膜3次,加prrsv-GDr180阳性猪血清(1∶200稀释)于37℃孵育1 h,洗膜3次,再加HRP标记的羊抗猪IgG(1∶10000稀释)于室温孵育1 h,PBST洗膜3次后用HRP-DAB底物显色试剂避光显色10 min,观察结果。
2.4 ELISA反应条件的优化
2.4.1 通用的ELISA程序 以抗原包被液稀释抗原,100μL/孔4℃包被过夜;PBST洗板3次,加入封闭液200μL/孔,37℃封闭1 h,PBST洗板4次,拍干。加入稀释的一抗血清100μL/孔,37℃反应1 h,用 PBST洗板 4次;加入稀释的酶标抗体100μL/孔,37℃作用1 h,取出后用PBST洗液洗板5次;加入TMB显色液100μL/孔,室温避光反应15 min;加入终止液50μL/孔;酶标仪450 nm处读取各孔读数。
2.4.2 抗原最适包被浓度和待检血清最佳稀释浓度的确定 采用方阵滴定法,用包被液将纯化后的N 蛋白梯度稀释成 8.0、4.0、2.0、1.0 和 0.5 μg/mL,96孔板上每个梯度包被2列孔;横向使用PBS将PRRSV GDr180株阴阳性血清作 1∶50、1∶100、1∶200、1∶400稀释,使用酶标抗体在建议工作浓度下进行 ELISA测定,选择阳性血清OD450mm值在1.0 左右,且阳性 OD450mm值/阴性 OD450mm值(P/N)比值最大时的抗原包被浓度和抗体稀释度为最佳工作浓度。
2.4.3 包被方式的优化 将确定的最适抗原浓度分别以4℃过夜、37℃作用1 h后4℃过夜、37℃作用2 h后4℃过夜和37℃作用2 h这4种包被条件进行包被,然后进行ELISA测定,以P/N最大者确定为最佳包被方式。
2.4.4 封闭液的选择 用BSA和脱脂奶粉分别按1%、2%、5%三种浓度作为封闭液按照优化的试验条件进行ELISA测定,以P/N最大者确定为最佳封闭液。
2.4.5 抗原抗体最佳作用时间的确定 阴阳性血清在37 ℃分别按15 min、30 min、45 min、60 min、75 min、90 min进行ELISA测定,以P/N最大者确定为一抗最佳反应时间。
2.4.6 酶标抗体最佳作用时间确定 酶标抗体在37 ℃按 15 min、30 min、45 min、60 min、75min、90 min进行ELISA测定,以P/N最大者确定为酶标抗体最佳反应时间。
2.4.7 酶标抗体工作浓度优化 酶标抗体分别做1 ∶2500、1 ∶5000、1 ∶10000、1 ∶15000、1 ∶20000、1∶25000和1∶30000 7个稀释度进行ELISA测定,以P/N最大者确定为酶标抗体工作液最佳反应时间。2.4.7 TMB底物反应时间的确定 加入TMB底物后,分别避光反应 5 min、10 min、15 min、20 min、25 min和30 min进行ELISA测定,以P/N值最大者判定TMB底物最佳反应时间。
2.5 临界值的确定 用建立的ELISA检测方法检测52份已判定为PRRSV抗体阴性的猪血清(IDEXX试剂盒检测确定),根据阴性血清样品OD450值计算其SP值的平均值(x)和标准差(s),以统计学原理确定ELISA阴阳性临界值。为了减少误差采用S/P值:S/P=(样品测定孔OD450值-阴性对照孔平均OD450值)/(阳性对照孔平均OD450值-阴性对照孔平均OD450值),根据统计学原理,确定阴阳性临界值,CP=x +3s;CN=x +2s,当待测样品的SP值≥CP时为阳性,<CN时为阴性,介于两者之间为可疑。
2.6 特异性检测 利用优化后的条件,对猪伪狂犬病毒(PRV)、猪瘟病毒(CSFV)、猪支原体(MHP)、口蹄疫病毒(FMD)、猪细小病毒(PPV)、猪流行性乙型脑炎(JE)等对进行检测,判定上述血清是否会与试剂盒的抗原起交叉反应。
2.7 批内重复试验 用同一批次的PRRSV N蛋白包被酶标板,对16份血清进行检测,分别在第1、3、7天进行测定,每份血清做3个重复,结果取平均值。2.8 批间重复试验 使用3批蛋白抗原分别包被ELISA板,对16份血清进行检测,每份血清做3个重复,结果取平均值;计算标准差和变异系数,分析其批间重复性。
2.9 与同种其他试剂盒之间的比较 利用建立的ELISA方法对临床送检的196份猪血清进行检测,同时用商品化IDEXX PRRSV抗体检测试剂盒做平行检测,对两种方法的结果进行比较。
3 结果
3.1 重组蛋白基因质粒的构建 通过RT-PCR成功扩增到N蛋白的基因片段,大小为372 bp,见图1。重组阳性质粒PCR鉴定,双酶切均鉴定为阳性,通过比对测序结果,确定重组蛋白基因质粒构建成功。

图1 N蛋白的基因片段凝胶电泳分析Fig 1 Gene fragment gel electrophoresis analysis of N protein
3.2 重组蛋白的表达及纯化 对表达产物进行SDS-PAGE鉴定分析后,确认重组蛋白是以可溶性蛋白方式存在的,通过Ni-NTA树脂纯化后,SDSPAGE鉴定分析后,确认纯化效果良好,并用BCA法测定纯化后蛋白浓度,约为0.25 mg/mL。
3.3 重组蛋白的Western blot分析 重组蛋白在PVDF膜上,与PRRSV GD株高免阳性血清进行反应,显色后 PVDF膜上可见到明显的目的条带(图2),表明重组蛋白跟PRRSV阳性血清能发生特异性反应,有良好的反应原性,可作为包被抗原进行下一步方法的建立。

图2 重组蛋白的Western blot分析Fig 2 Western blot analysis of recombinant protein
3.4 ELISA反应条件的优化
3.4.1 抗原最适包被浓度和待检血清最佳稀释浓度的确定 由表1可知,当抗原包被浓度为1μg/mL,血清以1∶50稀释时,阳性OD值在1.0左右,且P/N值较大。
3.4.2 包被方式的优化 由表2可知,采取37℃2 h+4℃过夜包被时,阳性OD值接近1.0左右,P/N值最大,从而确定此为最佳包被方式。
3.4.3 封闭液的选择 由表3可知,采用2%脱脂奶粉作为封闭液时,P/N值最大,故此为最佳封闭液。
3.4.4 抗原抗体最佳作用时间确定 当血清反应条件为37℃ 60 min时,P/N值最大,此时条件为最佳。
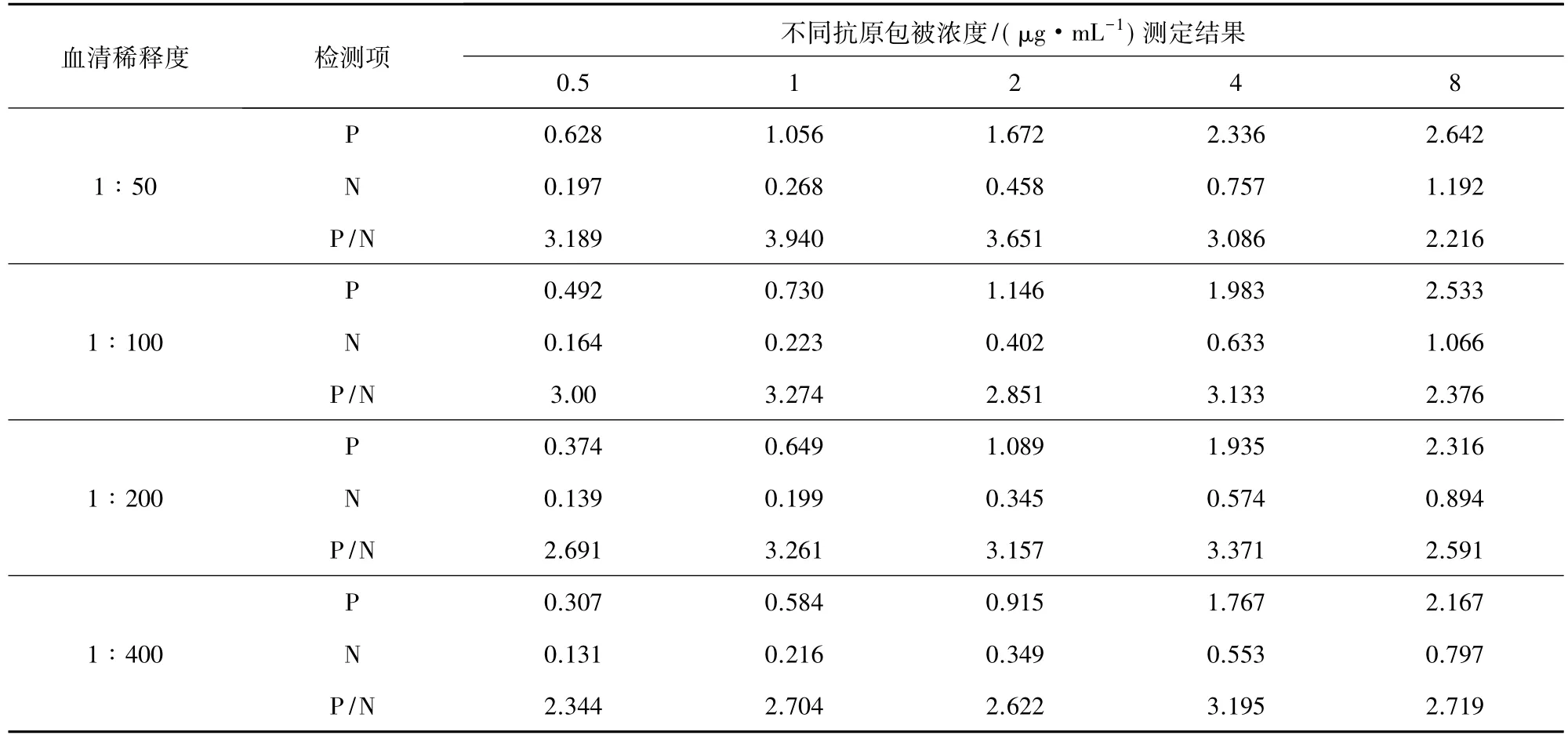
表1 抗原包被浓度和血清稀释倍数的优化结果Tab 1 Optimized results of antigen coating concentration and serum dilution factor

表2 包被方式的优化结果Tab 2 Optimized results of coating mode
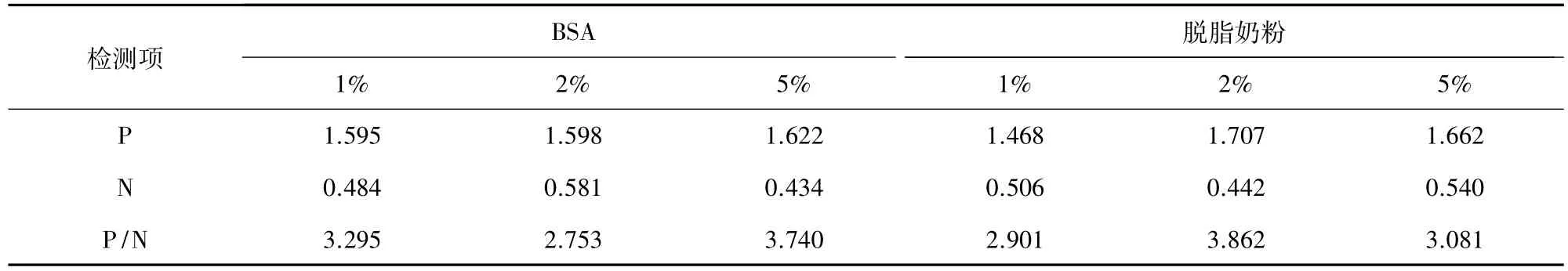
表3 封闭液的优化结果Tab 3 Optimized results of closed liquid
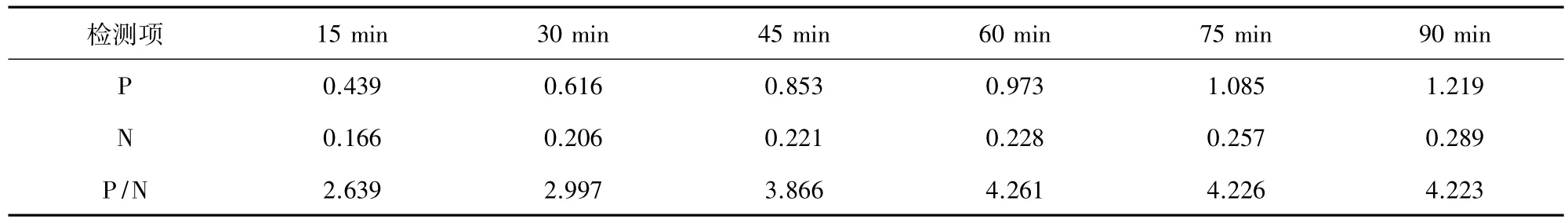
表4 抗原抗体作用时间的优化结果Tab 4 Optimized results of antigen-antibody action time
3.4.5 酶标抗体最佳作用时间确定 由表5可知,当二抗反应条件为37℃ 90 min时,P/N值最大,此时条件为最佳。
3.4.6 酶标抗体工作浓度优化 由表6可知,当稀释度为15000倍时,P/N值最大,此时为最优。
3.4.6 TMB底物反应时间的确定 由表7可知,当显色条件为室温下15 min时,P/N值最大,此时条件最佳。
3.5 临界值的确定 用优化的试剂盒检测52份阴性血清及标准阳性血清和标准阴性血清,其中测的标准阳性血清 OD450值为 1.157,标准阴性血清OD450值为0.269;结合表8结果,根据统计学原理确定其临界值是:当待测样品的SP值≥0.172时为阳性,SP值<0.085时为阴性,介于两者之间为可疑。
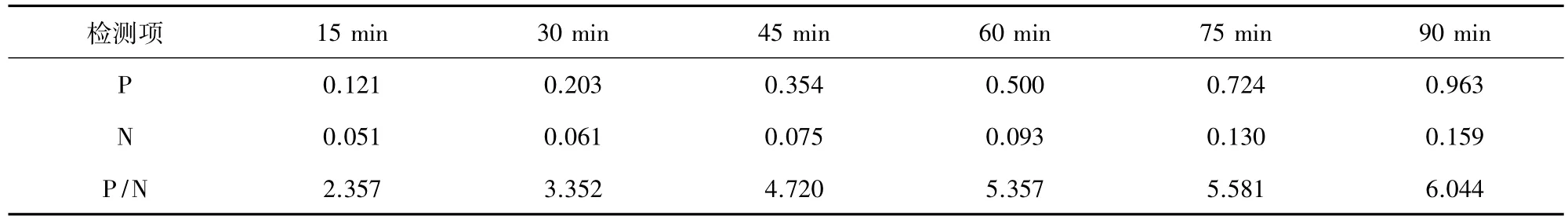
表5 酶标二抗作用时间的优化结果Tab 5 Optimized results of enzyme-labeled antibody action time

表6 酶标二抗工作浓度的优化结果Tab 6 Optimized results of enzyme labeled antibody action time

表7 TMB底物反应时间的优化结果Tab 7 Optimized results of TMB substrate reaction time
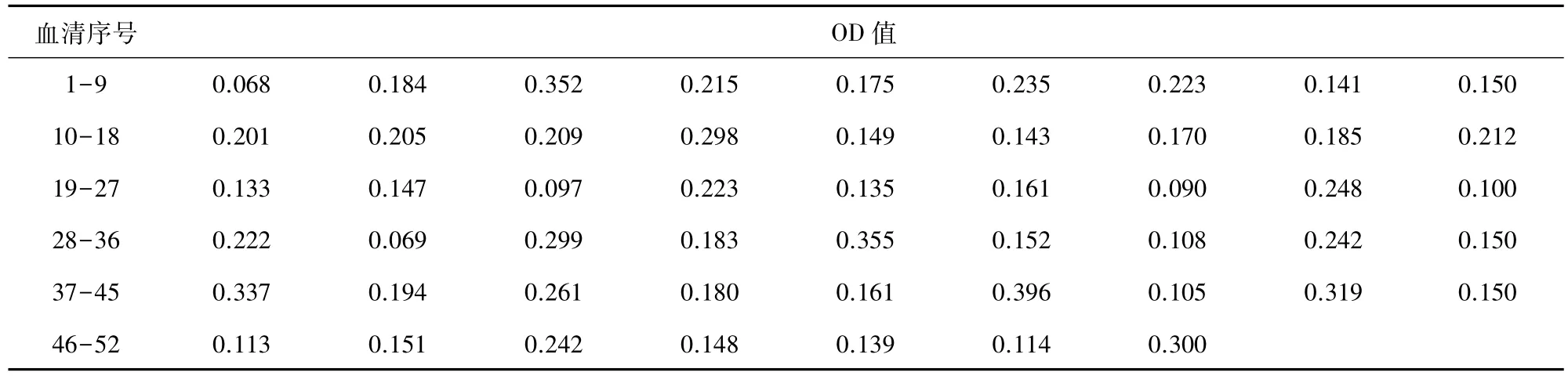
表8 52份阴性血清的检测结果Tab 8 Detection results of 52 negative sera
3.6 特异性检测 ELISA检测伪狂犬病毒(PRV)、猪瘟病毒(CSFV)、猪肺炎支原体(MHP)、口蹄疫病毒(FMD)、猪细小病毒(PPV)、猪乙型脑炎病毒(JEV)、猪圆环病毒2型病毒(PCV2)标准阳性血清,结果各个血清的 SP值均小于0.085(表9),表明上述血清与建立的PRRSV抗体试剂盒不发生交叉反应,证明建立的ELISA检测方法特异性较好。
3.7 批内重复试验 对于同一份血清,分别在第1、3、7天检测,试验一共选取16份血清,结果见表10。可以看出,每份血清检测结果的变异系数在1.0%~8.8%之间,均小于 10%,表明建立的 ELISA检测方法批内稳定性较好。
3.8 批间重复试验 同一份血清均用3个不同批次蛋白包被的ELISA板进行检测,一共选取16份血清进行检测。表11结果显示,其变异系数在1.1%~9.3%之间,均小于 10%,表明建立的 ELISA检测方法批间稳定性较好。
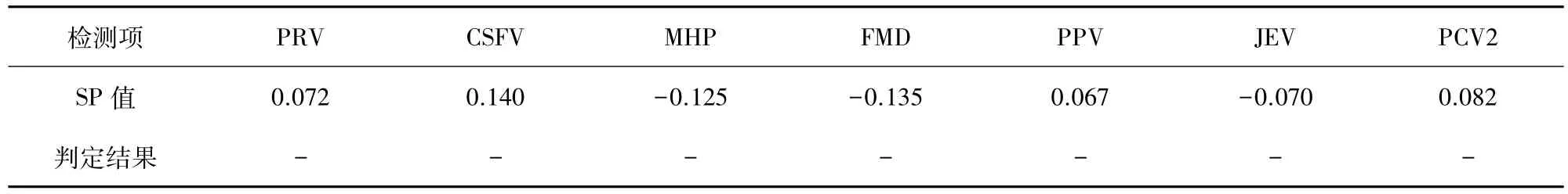
表9 特异性检测结果Tab 9 Specific test result

表10 批内重复试验结果Tab 10 Repeated test results within the batch
3.9 与同种其他试剂盒之间的比较 利用本试验建立的间接ELISA方法和IDEXX PRRSV ELISA抗体检测试剂盒同时检测196份血清样品,结果见表12。本试验建立的间接ELISA检测方法检测出阳性血清28份,阳性率为14.2%;用 IDEXX PRRSV ELISA试剂盒检出阳性血清34份,阳性率为17.3%;两者均检出阳性的样品为22份,均阴性的样品156份,两者的符合率为 91%,表明本实验建立的ELISA检测方法具有较高的准确性。

表12 两种检测方法的符合率比较Tab 12 Comparison of two test methods
4 分析与讨论
目前常通过PRRSV血清抗体检测及时进行流行病学监测来控制该病。而在中和试验(SN)、免疫过氧化物酶单层试验(IPMA)、间接免疫荧光(IFA)及多种ELISA抗体检测方法中,ELISA是最为常用的PRRS抗体检测方法。
本研究首次以PRRSV GDr180毒株作为模板,顺利表达出了具有良好抗原性的PRRSV重组N蛋白。选用N蛋白作为ELISA方法的包被抗原是因为在PRRSV几种蛋白中,PRRSV N蛋白在不同型毒株中有很高的同源性,是保守性很好的蛋白,以重组N蛋白作为诊断抗原建立的ELISA试剂盒,其生物安全性好,不会有散毒的危险,相对生产成本较低,方便规模化生产。大肠杆菌表达系统具有比较清楚的遗传背景、培养周期短、表达量高、抗污染能力强等优点[14]。PET系统是在大肠杆菌中表达外源蛋白最高效、产量最高、成功率最高的表达载体。其是利用与启动子配套并且能高效转录特定基因的外源RNA聚合酶构建的T7RNA聚合酶/启动子系统,可以从各种基因生产大量的目的蛋白[15]。另外,pET-32a(+)载体的 SD 序列下游有TrxA基因与外源插入基因相连,外源基因表达时,表达产物融合了TrxA基因编码的硫氧还蛋白,从而不易被大肠杆菌蛋白酶降解,有利于外源蛋白的稳定存在。融合蛋白含有His组氨酸标签结构,可与镍亲和树脂吸附,便于后续的蛋白质纯化。本研究即是用pet-32a(+)表达载体,顺利表达出了具有良好抗原性的PRRSV重组N蛋白。
用重组N蛋白作为包被抗原,通过优化ELISA检测方法的各种条件,建立了检测PRRSV抗体的间接ELISA检测方法,建立的方法特异性试验检测CSFV、JEV、FMDV、PRV、PPV、PCV2 等多种常见猪病病原的阳性血清均为阴性,表明建立的ELISA方法特异性很好,批内与批间重复性试验的变异系数均小于10%,表明建立的ELISA检测方法稳定性较好。而且同IDEXX公司ELISA检测试剂盒进行了对比,相对特异性高达96%,两者之间符合率达到91%;国内也有相应的试剂盒已开发出来,但与IDEXX试剂盒相比,主要问题是批间差异较大,稳定性不佳,包被蛋白的纯度直接影响方法的特异性,不同批次的包被蛋白的纯度差异是影响批间差异的主要因素,所以优化蛋白纯化条件及确定稳定的蛋白纯化工艺可以有效解决目前试剂盒存在的主要问题,针对本次建立的方法,在接下来的实验中,会在蛋白纯化,抗原保护剂,抗体稀释液等等关键工艺上进行筛选优化,期望能使建立的方法在特异性,稳定性方面有所提升,以开发出发稳定性更好,灵敏性更强,检测结果更准确的PRRSV抗体检测试剂盒。
