响应面法优化郫县豆瓣中有机酸的提取工艺及HPLC 定量分析
2019-03-11于筱雨方佳兴车振明林洪斌
于筱雨,方佳兴,向 琴,车振明,刘 平,林洪斌,2,*
(1.西华大学食品与生物工程学院,四川 成都 610039;2.四川大学轻纺与食品学院,四川 成都 610065)
郫县豆瓣作为“川菜之魂”,其制作工艺被列为第二批国家级非物质文化遗产名录[1-2]。郫县豆瓣由红辣椒(二荆条)、蚕豆、小麦粉和盐,经传统工艺发酵而成,色泽红润且酱香味十足,是川菜中最重要的调味料[3-5]。尽管郫县豆瓣具有悠久的历史和较高的知名度,深受大众喜爱,但在国际市场上的竞争力仍无法与日本、韩国、美国等发达国家的发酵调味品相媲美[2],主要因为郫县豆瓣传统生产模式,导致产品质量稳定性差及产品质量标准不完善等。由于地域限制,国外对郫县豆瓣的研究几乎没有,国内对郫县豆瓣的研究主要集中在香气成分分析[6]及后发酵期真菌细菌的演替变化分析[7-8]。郫县豆瓣酱在日晒夜露的陈酿过程中,通过酶促和非酶促作用,形成了其独特的风味体系,且随着陈酿时间的延长,酯类组分含量先增后减[9]。郫县豆瓣中主要香气化合物的鉴定有助于衡量豆瓣产品风味品质的优劣和划分产品的质量等级,同时促进郫县豆瓣生产企业更有效地控制和优化产品的风味品质[10]。想要得到完善的产品质量标准体系,需要综合考虑呈香呈味物质,因此本实验立足于此,研究郫县豆瓣中呈味有机酸的种类及含量。
有机酸主要在发酵过程中,由大分子物质水解以及微生物作用产生,为发酵食品提供独特的风味[11],因此是发酵食品一大重要研究方向。Choi等[12]研究不同原料的韩国酱油中有机酸含量的变化;Park等[13]研究大豆酱中有机酸的种类及含量。然而鲜见关于郫县豆瓣中有机酸的研究,因此有机酸的定性定量分析在郫县豆瓣呈味研究中具有重要意义。测定有机酸常用方法有滴定法、毛细管电泳法、气相色谱-质谱法(gas chromatographymass spectrometry,GC-MS)以及高效液相色谱(high performance liquid chromatograph,HPLC)法[14]。本研究针对郫县豆瓣中呈味有机酸,采取响应面法优化其提取工艺,并通过准确度高且易操作的HPLC法分析呈味有机酸种类及含量。有机酸作为郫县豆瓣中一种重要的呈味物质,是重要的产品属性之一,因此,定性及定量分析郫县豆瓣中含有的呈味有机酸,为系统研究郫县豆瓣呈味及风味优化研究奠定基础,也为制定更加完善的产品质量标准提供数据支撑,对郫县豆瓣产业健康发展具有十分重要的意义。
1 材料与方法
1.1 材料与试剂
6 种市售不同品牌(丹丹、鹃城、川老汇、川骄、川郫、旺丰)的一级郫县豆瓣,置于4 ℃保存。
草酸、柠檬酸、酒石酸、苹果酸、琥珀酸、富马酸、乳酸标准品(纯度≥99.5%),氢氧化钠、乙醇成都市科龙化工试剂厂。
1.2 仪器与设备
KH3200E超声波清洗器 昆山禾创超声仪器有限公司;TDZ5-WS离心机 上海卢湘仪器有限公司;BSA224S分析天平 赛多利斯科学仪器(北京)有限公司;pHS-3C酸度计 成都市世纪方舟科技有限公司;MVS-1旋涡混合器 北京金紫光科技发展有限公司;e-2695 HPLC系统 日本Waters公司。
1.3 方法
1.3.1 乙醇溶液浸提有机酸的技术路线
郫县豆瓣样品→研磨→加溶剂旋涡振荡→超声浸提→离心→洗涤沉淀2 次→定容→待测液
1.3.2 有机酸提取量的确定
用移液管吸取待测液20 mL于50 mL烧杯中,用已标定的NaOH溶液进行滴定。滴定至pH计示数为8.2,记录NaOH滴定液用量,根据消耗的标定NaOH溶液量求出样品中可滴定酸的含量[15]。计算公式如下:

式中:NaOH当量浓度为0.101 3 mol/L;以柠檬酸作为其换算系数即0.064。
1.3.3 有机酸提取工艺优化
根据相关文献[16-18]有机酸提取工艺优化,选择乙醇体积分数、料液比、超声时间3 个对郫县豆瓣中有机酸提取量有较大影响的因素进行单因素试验,在单因素试验结果的基础上,采用中心组合设计响应面试验优化有机酸提取工艺。
1.3.3.1 单因素试验
研究乙醇体积分数(40%、50%、60%、70%、80%)、料液比(1∶5、1∶10、1∶15、1∶20、1∶25(g/mL))、超声时间(15、30、45、60 min)对郫县豆瓣中有机酸提取量的影响。
取5.0 g郫县豆瓣充分研磨置于烧杯中,分别用一定体积分数一定比例的乙醇,旋涡振荡1 min,室温超声提取一定时间,3 500 r/min离心10 min,上清液收集于50 mL容量瓶中,分别用15、10 mL相对应的乙醇溶液2次洗涤沉淀,离心,将上清液合并于容量瓶中,定容得到待测液。
1.3.3.2 响应面试验
根据单因素试验结果进一步优化范围,参考响应面分析因素与水平(表1),进行响应面试验。

表1 响应面分析因素与水平Table 1 Coded levels and corresponding actual levels of factors used for response surface analysis
1.3.4 有机酸定性及定量分析[19-20]
标准溶液的制备:分别配制单一标品及混合标品。配制草酸、琥珀酸、富马酸和乳酸标品质量浓度为0.5 g/L;配制酒石酸和苹果酸标品质量浓度为1 g/L;配制柠檬酸标品质量浓度为2 g/L。然后配制与之相同质量浓度的混合标品。
样品的制备:取待测液5 mL,过强阴离子(SAX)小柱(预先用3 mL甲醇,3 mL去离子水活化),控制流速1~2 mL/min,弃去流出液。用5 mL蒸馏水淋洗净化柱,再用5 mL 20%盐酸溶液以不超过1 mL/min的流速洗脱,收集洗脱液5 mL过0.22 μm微孔滤膜后,供HPLC分析。
色谱条件:色谱柱Aminex HPX-87H Ion Exclusion column(300 mm×7.8 mm,3 μm);柱温60 ℃;流动相为0.005 mol/L H2SO4溶液;流速0.5 mL/min;采用光电二极管阵列检测器;检测波长210 nm。
1.4 数据处理与统计
采用Design-Expert v8.0.6软件进行响应面中心组合试验设计,采用SPSS 17.0软件对数据进行整理统计分析,各项指标结果以 ±s表示,采用S-N-K法进行差异显著性分析(P<0.05),采用Excel作图。
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇体积分数对有机酸提取量的影响
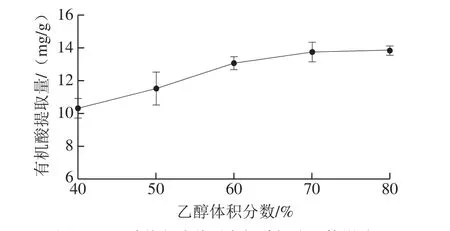
图1 乙醇体积分数对有机酸提取量的影响Fig. 1 Effect of ethanol concentration on extraction of organic acids
由图1可知,有机酸提取量随乙醇体积分数增加呈增加趋势,但增加程度越来越小。有机酸多溶于水或乙醇,随着乙醇含量的增加,会使一些脂溶性的色素或者亲脂性强的成分溶出量增加,这些成分会与乙醇-水分子结合,使得有机酸溶出率受到阻碍,同时考虑到乙醇成本,最终选定60%~80%乙醇体积分数作为进一步优化的范围。
2.1.2 料液比对有机酸提取量的影响
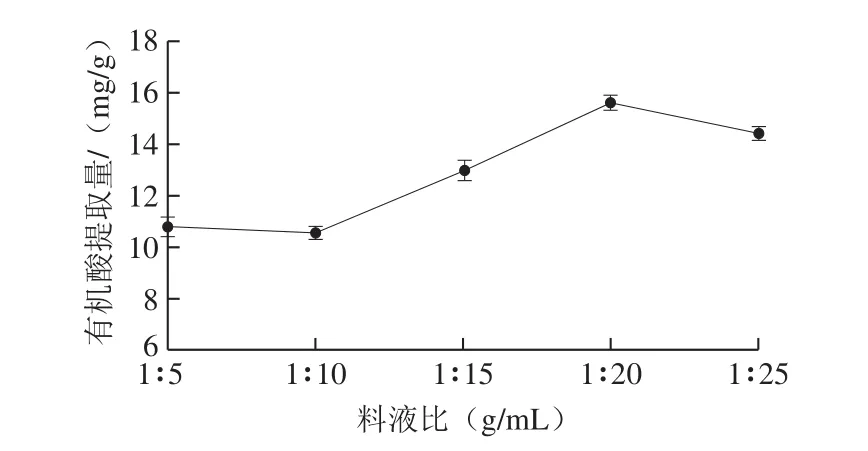
图2 料液比对有机酸提取量的影响Fig. 2 Effect of solid-to-solvent ratio on extraction of organic acids
由图2可知,有机酸提取量随提取试剂用量的增加,呈现先增加后减少的趋势。一般来说,随着溶剂的增多,提取率也会增加,但当增加到一定量时,溶剂趋于饱和,此时再增加溶剂用量,不会增加有机酸的提取,反而可能使其他水溶性物质溶出增加,阻碍有机酸与乙醇-水的结合。因此考虑有机酸提取率,选择1∶15~1∶25(g/mL)料液比作为进一步优化的范围。
2.1.3 超声时间对有机酸提取量的影响
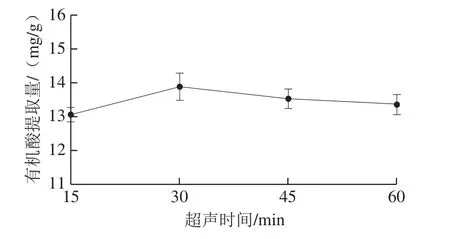
图3 超声时间对有机酸提取量的影响Fig. 3 Effect of ultrasonication time on extraction of organic acids
由图3可知,随超声时间的延长,有机酸提取量呈现先增加后减少的趋势。超声有助于有机酸的提取,所以一定程度上,超声时间越长,有机酸提取量越大,在超声时间为30 min时有机酸提取量达到最大,超过30 min后,提取量随时间延长而减小,可能因为长时间超声处理使得挥发性有机酸含量减少,此外,超声时间过长,能源消耗过大。综上,选择超声时间20~40 min作为进一步优化的范围。
2.2 响应面试验设计与结果
根据单因素试验结果选定因素与水平,以有机酸提取量为响应值,采用中心组合设计响应面试验优化有机酸提取工艺,设计与结果见表2。
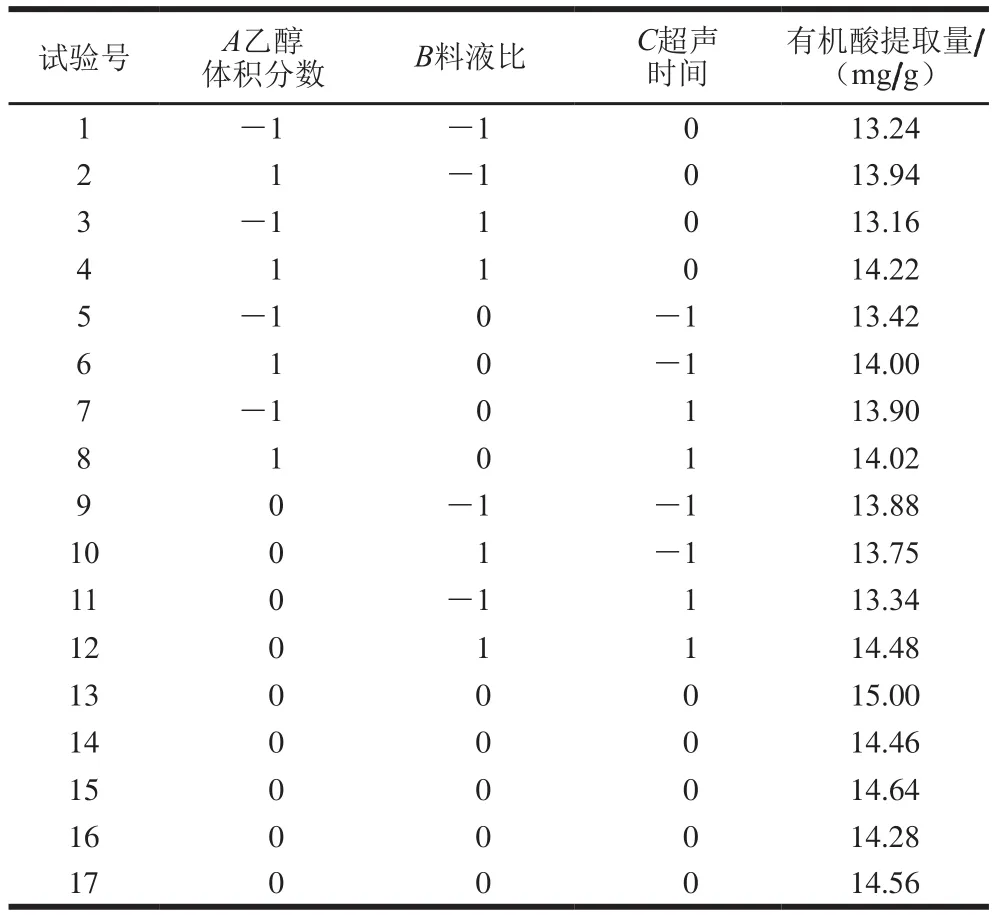
表2 有机酸提取的响应面试验设计与结果Table 2 Experimental design and results for response surface analysis
2.3 模型的建立及方差分析
对表2中的试验数据进行多元二次多项式回归拟合,得到的三元二次回归方程为:Y=7.294×10-3+1.538×10-4A+1.125×10-5B+1.075×10-4C+4.500×10-5AB-5.750×10-5AC+3.750×10-5BC-3.045×10-4A2-1.695×10-4B2-7.200×10-5C2。
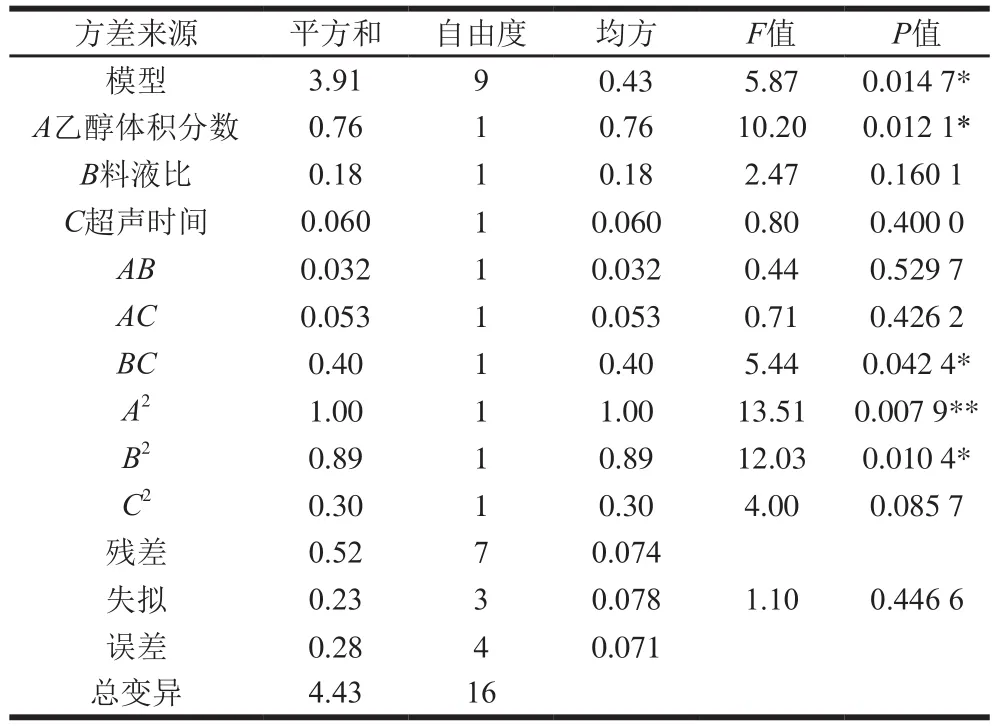
表3 回归方程的方差分析Table 3 Analysis of variance (ANOVA) for regression equation
由表3可知,模型P值为0.0147,该模型显著,表明回归模型达到显著水平[21]。失拟项不显著,相关系数R2值为0.4466,说明该模型与实际情况接近,即试验误差小[22],能充分反映出各因素之间的关系,因此,可用该方程对试验结果进行分析。由方差分析可知,因素A2影响极显著(P<0.01),A、BC、B2影响显著(P<0.05),模型中二次项系数均为负数,表明该模型抛物面开口向下,有极大值点,也就是有机酸最优提取点。
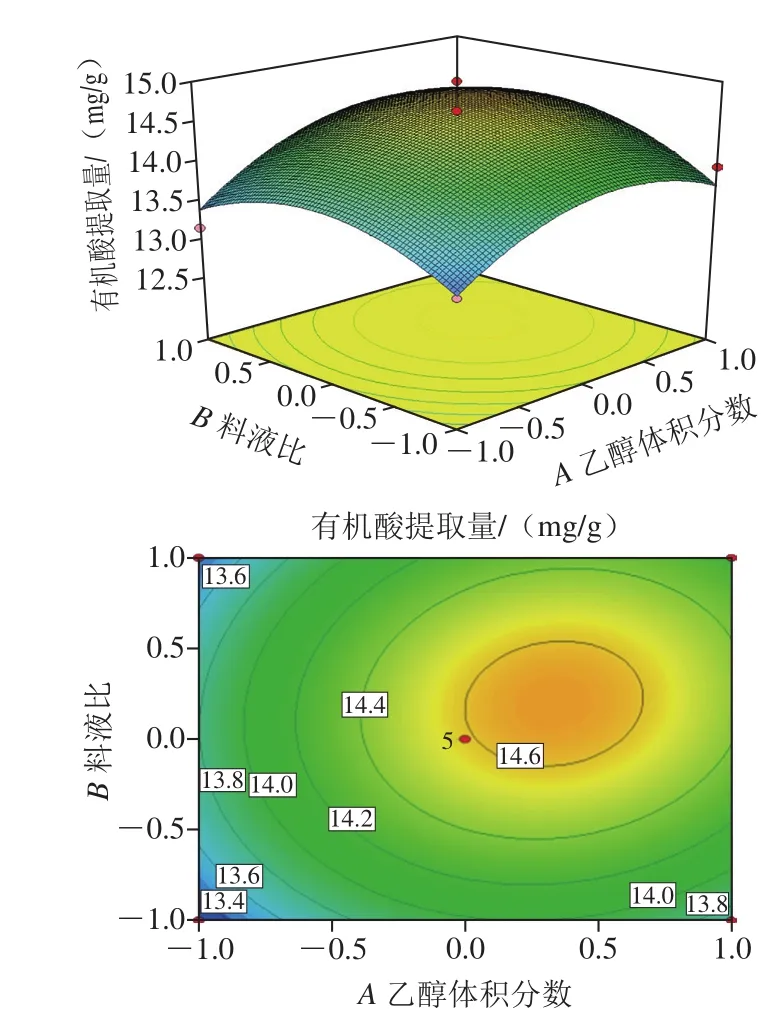
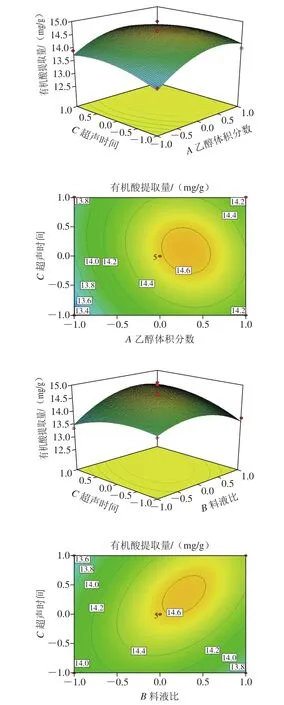
图4 各因素交互作用对有机酸提取量影响的响应面和等高线图Fig. 4 Response surface and contour plots showing the interactive effects of variable variables on organic acid extraction
各因素显著程度依次为乙醇体积分数>料液比>超声时间,通过优化分析,最佳的提取条件为乙醇体积分数71.96%、料液比1∶20.68(g/mL)、超声时间37.04 min,预测有机酸提取量可达到14.7 mg/g,考虑到实际操作的局限性,将提取工艺条件优化为乙醇体积分数72%、料液比1∶21(g/mL)、超声时间37 min,在此条件下,重复实验5 次,郫县豆瓣酱中有机酸提取量为14.58 mg/g,与预测值基本符合,证实该方程的准确性和实用性[23]。
2.4 有机酸定性及定量分析
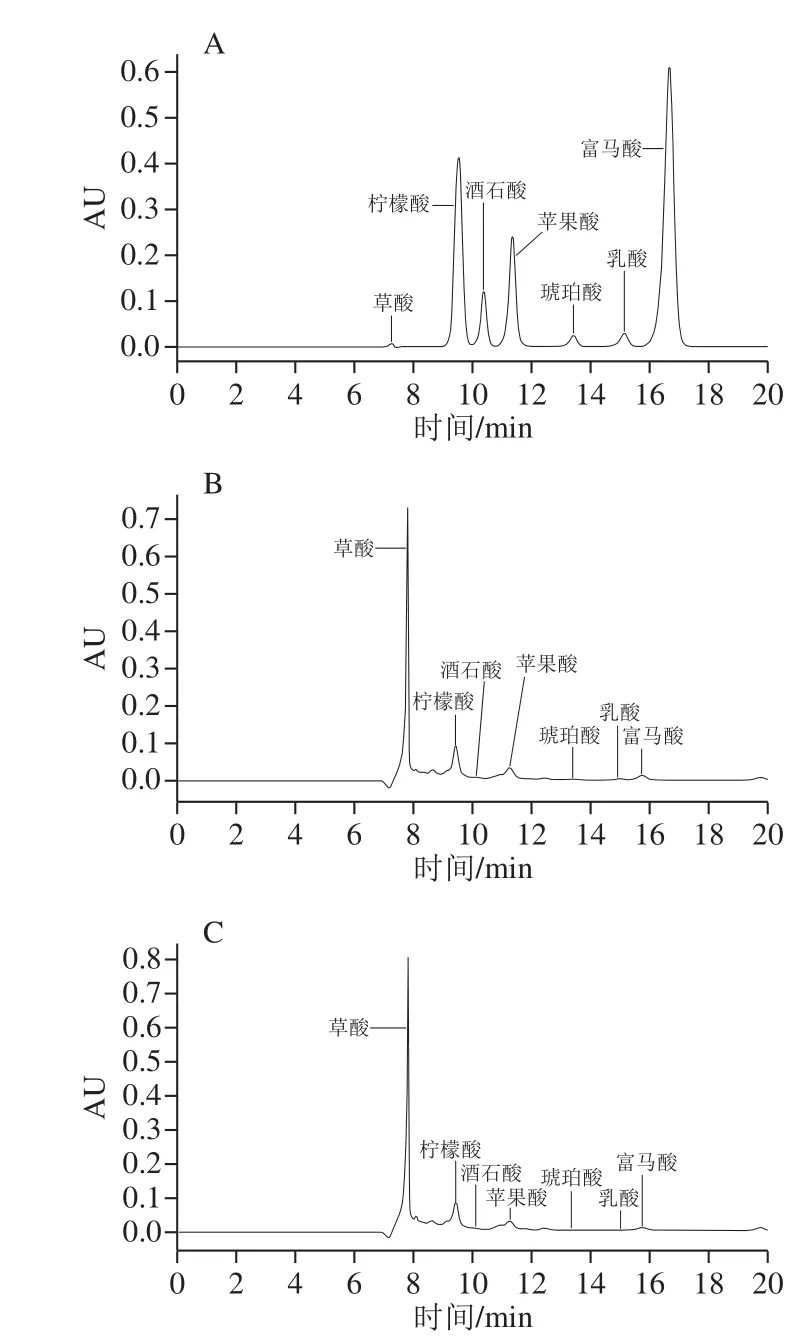
图5 7 种有机酸标准品和2 种样品HPLC图Fig. 5 HPLC chromatograms of mixed standard solution of 7 organic acids and two samples
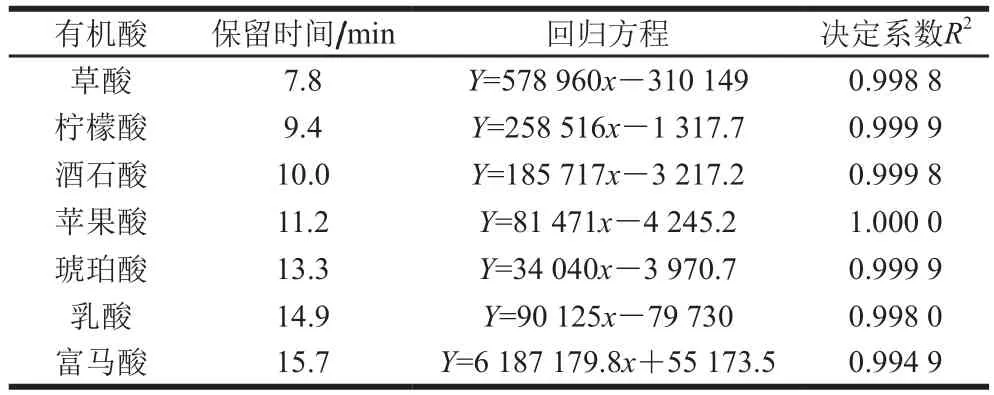
表4 有机酸保留时间及响应值Table 4 Retention times and regression equations for organic acids
由图5和表4可知,草酸、柠檬酸、酒石酸、苹果酸、琥珀酸、乳酸和富马酸的保留时间分别为7.8、9.4、10.0、11.2、13.3、14.9 min和15.7 min。有机酸作为郫县豆瓣中呈酸味的主要呈味物质,在6 种样品中测得总有机酸含量分别为11.3(丹丹)、12.355(鹃城)、10.869(川老汇)、9.661(川骄)、9.278 mg/g(川郫)和12.031 mg/g(旺丰)。根据已有研究发现,发酵环境、微生物群体和原料大豆的来源都会对产品的有机酸种类与含量有重要影响[24]。如表5所示,6 种郫县豆瓣样品中柠檬酸含量最高,含量分别为4.828 3(丹丹)、6.3(鹃城)、5.134 2(川老汇)、4.197 8(川郫)、5.252 3 mg/g(川骄)和4.364 5 mg/g(旺丰),这个结果与Park等[13]在发酵酱制品中实验结果相似。郫县豆瓣中柠檬酸可能由于曲霉的作用,有报道使用同位素标记方法证明曲霉可以诱导某些酶和一些代谢途径合成柠檬酸[25-27]。苹果酸和草酸含量排在第2和第3,6 种样品中苹果酸含量在2.1~3.6 mg/g之间,草酸含量在1.7~2.4 mg/g之间。苹果酸可能来自于郫县豆瓣酱在发酵过程中,酶与糖发生复杂反应产生苹果酸[28]。韩国大豆酱中检测出乳酸、草酸、丙二酸、琥珀酸、戊二酸和柠檬酸等非挥发性有机酸[12]。与之相似,本研究在6 种郫县豆瓣样品中也检测到一定量的乳酸、酒石酸和琥珀酸,并且同其他酱制品不同,在郫县豆瓣中检测出了富马酸,但没有检测到丙二酸和戊二酸,这可能是因为发酵环境的不同以及产品类型的差别导致其中有机酸种类的不同[29]。
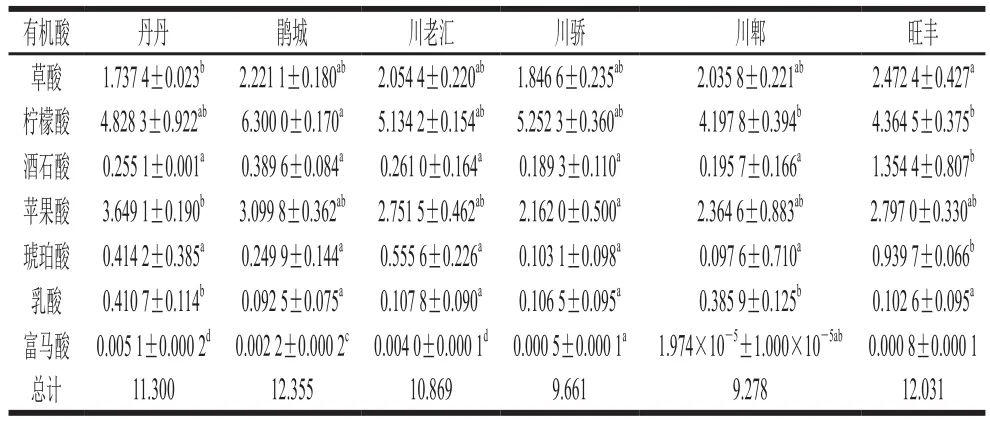
表5 郫县豆瓣样品中有机酸含量分析Table 5 Analysis of organic acid contents in commercial samples by HPLC mg/g
3 结 论
利用响应面试验设计优化郫县豆瓣中重要呈味物质有机酸的提取工艺,建立多元二次优化模型,并对郫县豆瓣中有机酸进行定性定量分析。结果显示,乙醇体积分数对有机酸提取量影响最大,结合实际操作,最终确定有机酸提取工艺条件为乙醇体积分数72%、料液比1∶21(g/mL)、超声时间37 min,实际值与预测值相符,该方案准确可行。
另外通过HPLC法定性及定量分析郫县豆瓣中呈味有机酸,6 种郫县豆瓣中,检测到有机酸7 种,分别为草酸、柠檬酸、酒石酸、苹果酸、琥珀酸、乳酸和富马酸,其中柠檬酸含量最高,其次为苹果酸和乳酸。该结论可为郫县豆瓣中特征呈味酸进一步研究提供数据基础,同时为郫县豆瓣质量标准的进一步完善及风味优化提供数据参考。研究发酵制品中常见的呈味有机酸并进行定性及定量分析,还可以通过高效液相色谱-质谱联用、红外、核磁等分析手段结合,鉴定郫县豆瓣中是否存在特征呈味有机酸。
