带电纳米颗粒与相分离的带电生物膜之间相互作用的分子模拟*
2019-03-11梁燚然梁清
梁燚然 梁清
(浙江师范大学物理系, 统计物理与凝聚态理论研究中心, 金华 321004)
(2018 年10 月23日收到; 2018 年11 月27日收到修改稿)
纳米颗粒在纳米医药、细胞成像等领域有着非常广泛的应用, 深入理解纳米颗粒与生物膜之间相互作用的微观机制是纳米颗粒合成与应用的重要基础. 本文采用粗粒化分子动力学模拟的方法研究了带电配体包裹的金纳米颗粒与相分离的带电生物膜之间的相互作用. 结果表明, 通过改变金纳米颗粒表面的配体密度、配体带电种类和比例, 以及膜内带电脂分子的种类, 可以方便地调控纳米颗粒在膜表面或膜内停留的位置和状态. 进一步从自由能的角度分析了带电纳米颗粒与带电生物膜之间相互作用的微观物理机制. 本文对纳米粒子在纳米医药、细胞成像等领域的应用具有一定的理论参考意义.
1 引 言
纳米颗粒因其独特的物理与化学性质而被广泛应用于药物输送、癌症的靶向治疗、细胞成像等领域[1-6]. 另一方面, 有些纳米颗粒可能会损坏细胞质膜或细胞器, 甚至杀死细胞, 产生不同程度的细胞毒性[7-12]. 所以, 如何提高纳米颗粒的利用效率, 同时降低某些纳米颗粒的细胞毒性是纳米颗粒在纳米医药等相关领域应用所面临的难题和人们关注的焦点.
改良纳米颗粒的物理化学性质最有效的方法之一是表面功能化, 即在纳米颗粒表面嫁接各种不同性质的聚合物或多肽等生物分子[13-16]. 现有的大量研究表明, 表面功能化不仅可以提高纳米颗粒在药物输送时的效率和生物稳定性,而且还可以降低纳米颗粒所造成的细胞毒性, 提高纳米颗粒的生物安全性[17-19].
无论是纳米颗粒的相关应用还是纳米颗粒的细胞毒性, 都与纳米颗粒与生物膜之间的相互作用密切相关[20-22]. 近几年来, 随着超高分辨率显微技术的不断发展, 大量的实验工作研究了各种类型的纳米颗粒与生物膜相互作用[23-27]. 另一方面, 随着计算机计算能力的不断提高和各种分子模拟模型的不断完善与发展, 分子模拟方法也成为了研究纳米颗粒与生物膜之间相互作用的一种非常有效的方法, 它能够非常方便地从分子层次上研究尺寸较小的纳米颗粒与生物膜相互作用的微观过程, 从而揭示纳米颗粒与生物膜相互作用的微观物理机制[28-34]. 例如, van Lehn等[35-37]利用全原子分子模拟方法发现表面嫁接上疏水配体的小尺寸金纳米颗粒可以自发且较快地渗透到脂质双层膜中.Lin等[38,39]利用粗粒化力场参数模拟发现金纳米颗粒表面嫁接的配体的亲疏水性质以及带电性质都对金纳米颗粒和脂质双层之间的相互作用有着一定的影响, 嫁接带正电配体的颗粒更易吸附于生物膜上, 但也会对膜造成较大的破坏. 研究人员还发现纳米颗粒的大小、形状以及与膜的接触面积都对其与生物膜的相互作用有着不同的影响[9,28,29,34,40,41]. 此外, Simonelli等[42]发现金纳米颗粒表面带电和中性配体的分布也会显著影响颗粒往生物膜内渗透的难易程度.
在这些相关的分子模拟研究中, 大多数的生物膜都是单组分膜或单相膜[35-39]. 但是真实的生物膜都是由多组分脂分子和膜蛋白构成的, 不同脂分子之间会发生相分离, 形成物理和化学性质不同的微观畴结构[43-45]. 纳米颗粒与不同性质的脂质畴之间相互作用的微观机制人们还知之甚少.
在最近的一个研究工作中, 采用粗粒化的分子动力学方法研究了配体包裹的金纳米颗粒的配体密度及配体带电比例对纳米颗粒与相分离的电中性生物膜之间的相互作用的影响[46]. 发现同一种颗粒与不同脂质畴之间的相互作用具有显著的区别,而且通过改变配体的嫁接密度和带电比例可以很容易地调节颗粒与膜之间的相互作用.
实际上, 在真实的生物膜中, 除了电中性的脂分子, 还存在着许多带电脂分子, 它们可能会对带电的纳米颗粒与生物膜之间的相互作用产生重要影响. 本文将在我们前期工作的基础上进一步研究含有带电脂分子的相分离生物膜与带电纳米颗粒之间的相互作用, 揭示带电脂分子的种类, 纳米颗粒表面配体的嫁接密度以及带电种类和比例对纳米颗粒与生物膜之间相互作用的影响.
2 方法与模型
2.1 模拟方法
本文所采用的模拟方法为粗粒化的分子动力学模拟. 脂分子、水分子、离子以及纳米颗粒表面嫁接的配体都用粗粒化的MARTINI力场来描述[47,48], 在这一力场里, 平均每4个非氢原子被看作一个粗粒化的粒子, 这样就明显减少了计算量,从而可以考虑更大尺寸的生物膜在更长时间内的动力学行为. 不同分子之间非键合相互作用的参数与我们前期的工作保持一致, 即非键合的粗粒化粒子之间的Lennard-Jones势在0.9—1.2 nm间衰减为0, 库仑相互作用势在0—1.2 nm之间衰减为0[49-51]. 所有的模拟都采用NPT系综, 膜的平面(xy平面)和法向 (z轴)方向的压强均采用Parrinello-Rahman方法固定在1 bar (1 bar =105Pa)[52,53], 同时系统的温度采用V-rescale方法保持在305 K[54]. 所有的分子动力学模拟都通过Gromacs 5.0运行, 模拟时间步长为20 fs. 为了考察系统在较长时间内的动力学行为, 每一个系统都模拟了15 μs以上.
2.2 理论模型
本文所模拟的系统主要由纳米颗粒和脂质双层膜构成, 除此之外, 还有一定数量的水分子和用来中和脂分子及纳米颗粒所带电荷的反离子(Na+或 Cl-). 系统的尺寸约为 18 nm × 18 nm ×28 nm.
2.2.1 金纳米颗粒
本文所采用的纳米颗粒模型是我们前期的一个模拟工作所建立的[46], 由金(Au)内核与配体两部分组成(如图1所示). 颗粒的内核由314个中性的粒子(代表Au原子)按照面心立方的结构排列而成, 形状为截角八面体. 内核表面均匀地嫁接着中性或带电的配体, 每个配体均由4个粗粒化粒子通过化学键连接而成. 配体分子的尾部通过化学键连接在Au核的表面(如图1所示). 配体分子固定端的粗粒化粒子是中性的, 中间2个粒子是疏水性的. 配体的带电性质和种类主要由自由端的粗粒化粒子决定, 若自由端的粒子带正电, 则配体为正电配体; 若自由端粒子带负电, 则配体为负电配体;若自由端为中性粒子, 则配体为中性配体.
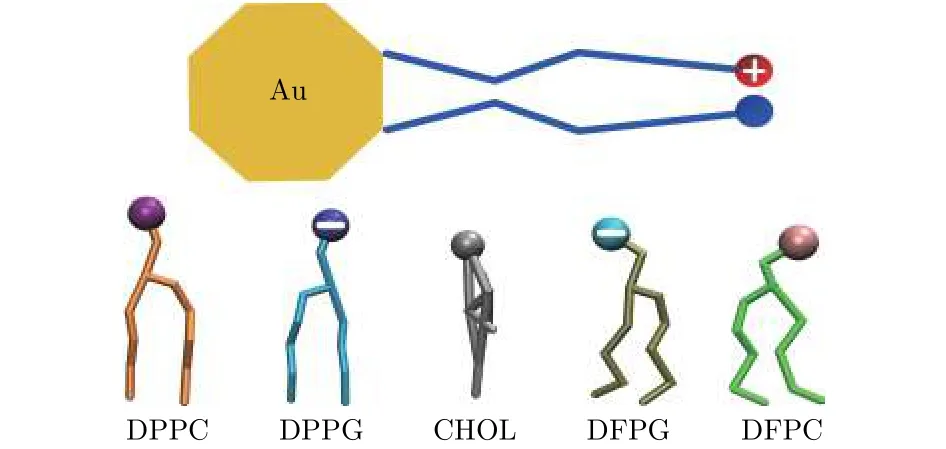
图1 金纳米颗粒和脂分子的分子结构示意图 其中DPPC, DFPC以及CHOL (胆固醇)为不带电的脂分子,而DPPG和DFPG为头部带负电的脂分子; 另外DPPC和DPPG为饱和脂分子, 而DFPC和DFPG为不饱和脂分子; 颗粒和各种脂分子的各部分颜色表示通用于全文Fig.1. Molecular schematic illustrations of Au nanoparticle and lipids. Here, DPPC, DFPC and cholesterol (CHOL)are electrically neutral, while DPPG or DFPG has a negatively charged headgroup. Additionally, DPPC and DPPG are fully saturated, while DFPC and DFPG are poly-unsaturated. The coloring scheme of the nanoparticle and lipids is used throughout the whole paper.
在本文中主要考察了纳米颗粒表面配体的嫁接密度、带电种类以及带电比例对颗粒与含不同种类带电脂分子的相分离脂质双层膜之间相互作用的影响. 选取了3种不同的配体嫁接密度, 分别占金核表面原子总数的40%, 60%和100%, 相应的配体数目分别为70, 104和174, 相对应的实际面密度为1.07 nm-2, 1.62 nm-2和2.67 nm-2. 需要说明的是, 配体嫁接密度为40%和60%的情况实验上是很容易实现的[55,56], 而配体嫁接密度为100% (即174个配体)的情况是一种理想的情况,实验上可能较难实现, 只是理论模拟的一种参考系统. 这些配体有些是全部带电的, 有些是部分带电的. 为方便起见, 我们用符号Aun/+(-)m表示某一个总共嫁接了n个配体, 其中m个为带正电(+)或带负电 (-)的配体的纳米颗粒. 例如,Au104/-70表示配体总数为104, 其中的70个配体为带负电的配体的纳米颗粒. 本文所考察的所有纳米颗粒如表1所示.

表1 本文所研究金纳米颗粒的类型Table 1. Types of Au nanoparticles in this work.
2.2.2 脂质双层膜
本文所研究的脂质双层膜为由饱和脂分子、不饱和脂分子及胆固醇组成的三元双层膜. 饱和脂分子, 不饱和脂分子和胆固醇的摩尔比为4∶3∶3, 在这一组分比例和305 K温度的条件下, 该脂质双层膜会发生相分离, 形成富含饱和脂分子和胆固醇的流体有序(Lo)畴和富含不饱和脂分子的流体无序(Ld)畴(如图2所示). 膜脂的种类和结构如图1所示, 其中, DPPC和DPPG为饱和脂分子,DFPC和DFPG为不饱和脂分子, 每一个尾链含有3个不饱和键. PC为中性脂分子, 而PG的头部则带有一个单位的负电荷, 即可认为PG为带电脂分子. 本文主要考察了两种脂质双层膜, 具体组分见表2. 第一种膜内, Lo畴带负电(含有带负电的DPPG脂分子), 第二种膜内, Ld畴带负电(含有带负电的DFPG脂分子). 在这两种膜内, PG脂分子的含量分别占Lo畴或Ld畴中脂分子总数的30%.

图2 由 DPPC (紫色), DFPC (粉红色)及 CHOL (灰色)按4 ∶ 3 ∶ 3摩尔比组成的三组分相分离脂质双层膜的侧视图(上)和俯视图(下). 其中, Lo畴富含DPPC和CHOL, Ld畴富含DFPCFig.2. Phase-separated lipid bilayer composed of DPPC(purple), DFPC (pink) and CHOL (gray) with the molar ratio of 4 ∶ 3 ∶ 3. Here, Lo domain is enriched in DPPC and CHOL, while Ld domain is enriched in DFPC.

表2 脂质双层膜及脂质畴的组分Table 2. Components of lipid bilayers and lipid domains.
2.3 纳米颗粒与脂质畴之间的自由能计算
为了深入理解分子动力学模拟的结果及纳米颗粒与脂质双层膜之间相互作用的微观物理机制,采用伞形抽样的方法计算了纳米颗粒与Lo畴及Ld畴之间相互作用的自由能, 即平均力势(potential of mean force, PMF). 主要比较了 Au70/+70和Au174/+174与电中性的Lo畴和Ld畴以及带电的Lo畴和Ld畴之间的PMF (Au104/+104的情况应介于Au70/+70和Au174/+174之间, 为了节约计算资源, 没有计算), 还比较了Au70/-70与电中性的Lo畴和Ld畴以及带电的Lo畴和Ld畴之间的PMF.在计算PMF的时候, Lo畴由饱和的脂分子DPPC(或 70% DPPC加 30% DPPG)和 CHOL按照4∶3的摩尔比例构成, Ld畴则全部由不饱和脂分子 DFPC (或 70% DFPC加 30% DFPG)构成.具体计算方法可参考我们前期的一个研究工作[46].
3 结果与讨论
3.1 带正电的颗粒与带负电的相分离膜之间的相互作用
首先研究了嫁接有带正电的配体的纳米颗粒与含有带负电的脂分子(DPPG或DFPG)的相分离膜之间的相互作用. 分别考察了不同配体嫁接密度的纳米颗粒与Lo畴带电和Ld畴带电的膜之间的相互作用.
图3给出了3种不同配体嫁接密度的纳米颗粒吸附于Lo畴含有带负电的DPPG脂分子的相分离膜的动力学过程. 发现这3种纳米颗粒最终都吸附于带负电的Lo畴的表面, 只是吸附的动力学过程有一些差别. Au70/+70大约在1.01 μs开始吸附于膜的表面, 并在3.20 μs左右移动到两畴的交界面处, 这一状态在随后大约12 μs的模拟中保持稳定, 颗粒的位置没发生明显的改变. Au104/+104吸附到膜表面所需时间更短些, 大约在0.31 μs就吸附于膜的表面并于1.80 μs时达到稳定状态.Au174/+174仅仅用了0.10 μs就吸附于膜的表面且在1.20 μs时达到稳定状态. 可以看出, 由于颗粒表面的正电荷与Lo畴内DPPG头部的负电荷之间的相互吸引作用, 颗粒带电越多, 颗粒与DPPG之间的吸引越强, 颗粒吸附并达到稳定状态的时间越短.

图3 3种不同带正电的纳米颗粒吸附于由DPPC&DPPG/DFPC/CHOL组成的相分离膜上的动力学过程 (a) Au70/+70;(b) Au104/+104; (c) Au174/+174Fig.3. Dynamic processes of adsorption of three different positively charged nanoparticles onto the surface of phase-separated lipid bilayer composed of DPPC & DPPG/DFPC/CHOL: (a) Au70/+70; (b) Au104/+104; (c) Au174/+174.
另一方面, 从图3可以看出随着颗粒带电量的改变, 颗粒的吸附状态、膜内脂分子的分布以及膜的形态也都呈现出一定程度的差别. 由于Au70/+70表面带正电的配体的嫁接密度比较小(40%), 配体分子链排列比较稀疏, 配体疏水部分很容易暴露于水中. 所以Au70/+70表现出一定的疏水性, 有部分的体积嵌入了膜内疏水区域(图3(a)), 这与我们前期关于Au70/+70和电中性膜之间相互作用的研究结果是不同的. 对于电中性膜, Au70/+70能够从Ld畴嵌入膜内[46].
Au104/+104和Au174/+174表面带正电的配体的嫁接密度比较大, 亲水性比较强, 所以它们几乎整体都暴露于水环境中或吸附于膜的表面(图3(b),(c)). 同时, 由于带正电的配体与带负电的DPPG之间的吸引作用, 大量的DPPG分子聚集于颗粒之下. 尤其是Au174/+174, 由于较强的库仑吸引作用, 膜的形态呈现出一定程度的弯曲, 颗粒的一部分被膜包裹(图3(c)). 由此可见, 在当前的系统中,静电相互作用对于颗粒在膜表面的吸附起着重要的作用.
图4给出了3种不同配体嫁接密度的纳米颗粒嵌入或吸附于Ld畴含有带电的DFPG脂分子的相分离膜的动力学过程. 与Lo畴带电的情况(图3)相似, 由于库仑吸引相互作用, 带正电的颗粒首先吸附于带负电的Ld畴表面. 但不同颗粒最终的分布情况却有所不同. 对于Au70/+70, 由于其表面配体的嫁接密度较低, 有一定的疏水性, 再加上Ld畴里脂分子排列比较松散无序, 所以表面部分疏水的Au70/+70最终嵌入到Ld畴内(图4(a)).对于Au104/+104和Au174/+174, 由于它们有较大的配体嫁接密度和亲水性且不易变形, 所以这两种颗粒很难嵌入膜内疏水部分, 最终只是吸附于带负电的Ld畴表面(图4(b), (c)). 与Lo畴带电情况不同, 由于Ld畴比较松散无序, 这两种颗粒有更多的体积嵌进了膜内, 其中, 带电较多的Au174/+174有大部分的体积被Ld畴包裹着(图4(c)).

图4 3种不同带正电的纳米颗粒吸附于由DPPC/DFPC&DFPG/CHOL组成的相分离膜上的动力学过程 (a) Au70/+70;(b) Au104/+104; (c) Au174/+174Fig.4. Dynamic processes of adsorption of three different positively charged nanoparticles into/onto the surface of the phaseseparated lipid bilayer composed of DPPC/DFPC&DFPG/CHOL: (a) Au70/+70; (b) Au104/+104; (c) Au174/+174.
进一步分别计算了Au70/+70和Au174/+174与带负电的Lo畴和Ld畴的PMF并与电中性的Lo畴和Ld畴的PMF做比较, 从而深入理解带正电的纳米颗粒与带负电相分离膜之间相互作用的微观机制(图5). 发现当这两种颗粒吸附于带负电的Lo畴表面时(对应图3的情况), 均出现一个明显的自由能极小值, 正是这个极小值使得带正电的两种颗粒都更倾向于吸附于带负电的Lo畴表面,形成一种比较稳定的结构(如图5内的插图). 另外, 从图5(a)可以看出, Au70/+70有嵌入Ld畴的可能. 但由于Au70/+70与带负电的Lo畴之间的库仑吸引作用, 颗粒将首先吸附于Lo畴表面, 因此并没有观察到Au70/+70嵌入电中性的Ld畴的情况. 如果增加抽样次数并延长足够的模拟时间, 有可能观察到Au70/+70嵌入Ld畴内的情况, 但这超出了现有的计算能力范围.
对于带负电的Ld畴(对应于图4的情况), 两种颗粒与Ld畴的PMF曲线比较相似, 系统的自由能都随着颗粒与畴之间距离的减小而降低, 两种颗粒均有嵌入膜内的倾向. Au70/+70由于配体嫁接密度较低, 容易变形, 带电的配体的头部均分布于脂质双分子层亲水的区域, 形成一种稳定的嵌入结构(如图4(a)所示). Au174/+174由于配体嫁接密度较高, 体积较大且不容易变形, 所以无法完全穿透膜, 只能部分嵌入膜, 形成被膜包裹的结构(如图4(c)所示).
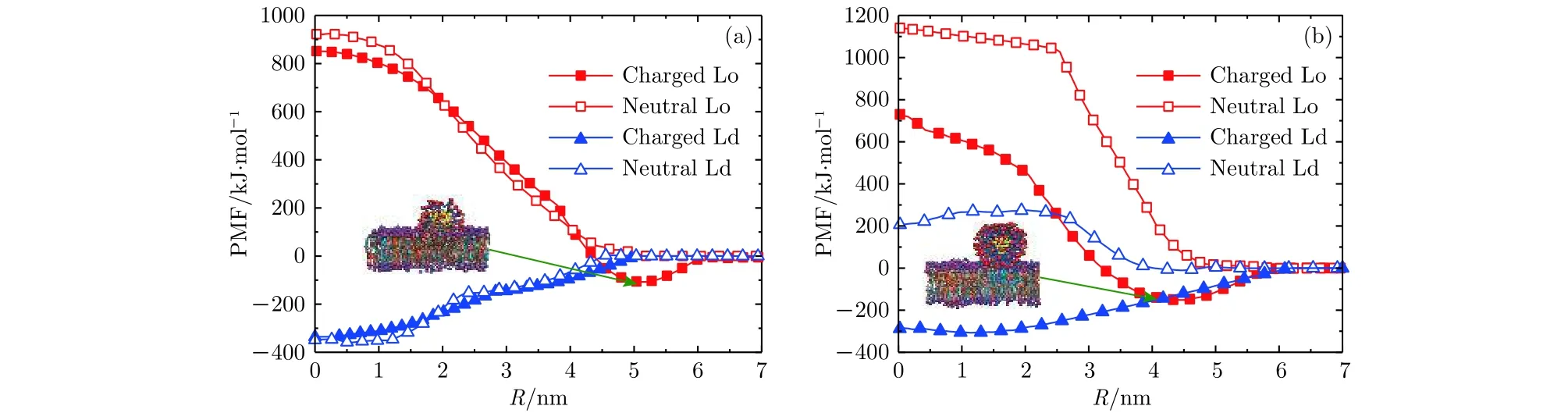
图5 两种带正电的颗粒与带电/中性的Lo/Ld脂质畴之间的PMF曲线 (a) Au70/+70; (b) Au174/+174Fig.5. PMF curves of two kinds of positively charged nanoparticles with charged/neutral Lo/Ld lipid domains: (a) Au70/+70; (b)Au174/+174.
3.2 带负电的颗粒与带负电的相分离膜之间的相互作用
接下来研究了带负电的颗粒与带负电的相分离膜之间的相互作用. 仍然分别考察了3种不同配体嫁接密度的纳米颗粒与Lo畴带负电和Ld畴带负电的膜之间的相互作用(图6). 结果表明, 不管是Lo畴带负电的膜还是Ld畴带负电的膜, 3种颗粒均吸附于两畴交界处(Au70/-70)或电中性畴的表面上且所有的颗粒均无法嵌入膜内. 相关的实验研究也表明带负电的纳米颗粒与生物膜之间的相互作用更弱, 细胞毒性更小[23]. 因此模拟的结果与实验结果是定性一致的.

图6 3种不同带负电的纳米颗粒吸附于DPPC&DPPG/DFPC/CHOL (a)—(c) 和DPPC/DFPC&DFPG/CHOL (d)-(f) 组成的相分离的膜表面上在模拟时间为15 μs时的稳定结构Fig.6. Final stable structures of adsorption of Au70/-70, Au104/-104, Au174/-174 onto the surface of DPPC&DPPG/DFPC/CHOL(a)-(c) and DPPC/DFPC&DFPG/CHOL (d)-(f) phase-separated lipid bilayers at the simulation time of 15 μs.
为了理解Au70/-70颗粒与Lo畴带电的相分离膜及Ld畴带电的相分离膜之间的相互作用, 计算了Au70/-70颗粒与这两种畴之间的PMF (图7).从曲线上可以看出, 由于颗粒和DPPG或DFPG均带负电, 为了中和负电荷, 系统里加入了相应数量Na+, 较多数量Na+的存在屏蔽了颗粒与带电畴之间的相互排斥作用[57], 从而使得颗粒与膜的表面接触时, 与两个畴的PMF的值都差不多, 没有表现出对某一个畴明显的亲和性. 而两畴交界面处脂分子比较无序, 存在一定的缺陷, 所以Au70/-70颗粒最终分布于两畴交界处且部分嵌入了膜内(如图6(a), (d)所示). 颗粒与Ld畴的PMF曲线也表明随着颗粒与畴之间距离的减少, 颗粒与带电或不带电畴之间的PMF值降低. 但由于颗粒表面吸附有一定量的Na+, 颗粒表面表现出较强的亲水性,所以颗粒完全嵌入Ld畴(对应图7中R= 0 nm处)与颗粒吸附于膜表面(对应图7中R≈ 5.0 nm处)的 PMF的差值 (≈ 100—200 kJ/mol)并不大, 则颗粒进入Ld畴的概率较低, 在我们的模拟中没有观察到Au70/-70嵌入Ld畴的情况. 如果抽样次数足够多且模拟时间足够长, Au70/-70也有可能嵌入Ld畴内.
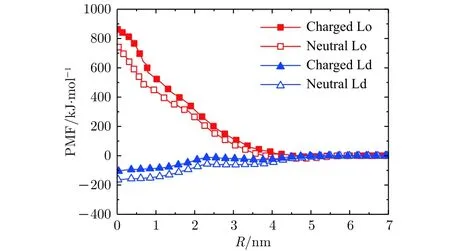
图7 Au70/-70与带电/中性的Lo/Ld脂质畴之间的PMF曲线Fig.7. PMF curves of Au70/-70 with charged/neutral Lo/Ld lipid domains.
对于Au104/-104和Au174/-174两种颗粒, 由于他们表面嫁接有较多的带电配体, 系统中相应的Na+浓度也增加, 颗粒与带负电的Lo或Ld畴表现出排斥相互作用, 所以他们倾向于吸附在中性畴的表面上(如图6(b), (c), (e), (f)所示). 另一方面,这些颗粒表面有较强的亲水性, 这些亲水的配体不喜欢与疏水的脂分子尾链接触, 所以即使它们吸附在脂分子排列较松散无序的Ld畴的表面, 也无法嵌入膜内. 与颗粒带正电的情况不同, 带负电的颗粒与Ld畴内的脂分子头之间不存在较强的吸引相互作用, 所以也无法形成如图4所示的颗粒被膜包裹的结构.
3.3 颗粒表面的疏水性对其与带电相分离生物膜之间相互作用的影响
通过改变颗粒表面带电配体的比例和配体嫁接密度, 研究了颗粒表面的疏水性对颗粒与带电相分离生物膜之间相互作用的影响.
首先, 研究了表面部分带正电的Au104/+70与Lo畴含带电DPPG (图8(a))和Ld畴含有带电的DFPG的相分离膜之间的相互作用(图8(b)).结果表明, 当Lo畴带电时, Au104/+70吸附于Lo畴的表面, 而当Ld畴带电时, Au104/+70则嵌入了Ld畴内. 其次, 研究了 Au174/+70和 Lo畴带电(图8(c))和Ld畴带电(图8(d))的相分离膜之间的相互作用. 在这两种情况下, Au174/+70颗粒都嵌入了Ld畴内.
对于Au104/+70, 由于颗粒表面大部分的配体带正电, 颗粒表面局域电荷密度较大, 颗粒受带负电的脂分子(DPPG或DFPG)的静电吸引力也比较大, 所以Au104/+70的最终分布主要由颗粒与带电畴之间的库仑吸引作用决定. 当Lo畴带电时,由于Lo畴内脂分子排列较有序, 颗粒很难嵌入畴内, 所以Au104/+70被吸附于Lo畴的表面(如图8(a)所示); 当Ld畴带电时, 由于Ld畴内分子排列较无序, 再加上颗粒表面还有一些疏水性的中性配体, 所以被带电脂分子吸引的Au104/+70颗粒最终嵌入Ld畴内(如图8(b)所示). 对于Au174/+70, 带电配体所占比例较小, 颗粒表面局域电荷密度也较小, 颗粒受膜内带负电的脂分子的影响较小. 另一方面, 由于不带电的配体是疏水性的, Au174/+70的表面有较强的疏水性, 所以它更倾向于从Ld畴嵌入膜内疏水的区域(如图8(c), (d)所示).

图8 两种不同的表面部分带正电的纳米颗粒吸附或嵌入DPPC&DPPG/DFPC/CHOL (a), (c) 和DPPC/DFPC&DFPG/CHOL (b), (d) 组成的相分离的膜表面或内部在模拟时间为15 μs时的稳定结构Fig.8. Final stable structures of adsorption/penetration of Au104/+70 and Au174/+70 onto/into the DPPC&DPPG/DFPC/CHOL (a), (c) and DPPC/DFPC&DFPG/CHOL(b), (d) phase-separated lipid bilayers at the simulation time of 15 μs.

图9 两种不同的表面部分带负电的纳米颗粒吸附或嵌入DPPC&DPPG/DFPC/CHOL (a), (c) 和DPPC/DFPC&DFPG/CHOL (b), (d) 组成的相分离的膜表面或内部在模拟时间为15 μs时的稳定结构Fig.9. Final stable structures of adsorption/penetration of Au104/-70 and Au174/-70 onto/into the DPPC&DPPG/DFPC/CHOL (a), (c) and DPPC/DFPC&DFPG/CHOL(b), (d) phase-separated lipid bilayers at the simulation time of 15 μs.
进一步考察了部分配体带负电的纳米颗粒与含有带负电脂分子的相分离膜之间的相互作用(图9). 与部分配体带正电的颗粒的情况不同, 对于Au104/-70, 无论是Lo畴还是Ld畴带负电, 颗粒总是吸附于膜表面两畴交界处, 不会嵌入膜内(如图9(a), (b)所示). 这种情况与前面讨论的Au70/-70与膜之间的相互作用类似, 由于较多Na+的存在, Au104/-70与带负电的Lo或Ld畴之间的排斥相互作用被屏蔽了一部分, 所以Au104/-70无论是对Lo畴还是Ld畴都不显示出明显的亲和性, 最终分布于两畴交界处. 对于Au174/-70, 颗粒表面的疏水性起主导作用, 所以不管是Lo畴还是Ld畴带负电, Au174/-70颗粒总是部分或全部嵌入Ld畴内(如图9(c), (d)所示).
4 结 论
本文采用粗粒化的分子动力学方法详细研究了带电纳米颗粒与含有带负电脂分子的相分离脂质双层膜之间的相互作用. 分别考察了颗粒表面配体的嫁接密度、配体带电种类和比例以及膜内带电脂分子的种类等因素对颗粒与膜之间相互作用的影响. 研究结果表明, 颗粒有两种分布状态: 一种是吸附于膜的表面, 另一种是嵌入膜内. 颗粒表面的亲疏水性决定了颗粒最终是吸附于膜表面还是嵌入膜内. 如果颗粒表面亲水性较强, 则颗粒倾向于吸附于膜的表面; 反之如果颗粒表面疏水性较强, 则颗粒倾向于嵌入膜内. 对于吸附于膜表面的颗粒, 它最终吸附于Lo畴还是Ld畴的表面主要由颗粒表面的电荷与带电脂分子头部电荷之间的相互作用决定. 对于能够嵌入膜内的颗粒, 它们总是嵌入脂分子排列比较无序的Ld畴. 颗粒表面的亲疏水性与其表面嫁接的配体密度, 电荷数目以及吸附的反离子数目有关.
本文的结果提供了一种通过改变纳米颗粒表面配体和膜内脂分子的带电性质来调节纳米颗粒与生物膜之间相互作用的方法, 这对于纳米颗粒在纳米医药、细胞成像等领域的应用具有一定的参考意义.
