一株发酵转化黄芩苷菌株的筛选及鉴定
2019-03-08马宗敏苗文丽段绪红孙国强
马宗敏,苗文丽,段绪红,何 培,孙国强,裴 林
河北省中医药科学院浊毒证重点实验室,石家庄 050031
黄芩为唇形科植物黄芩(ScutellariabaicalensisGeorgi)的干燥根,是清热燥湿、泻火解毒、消炎的常用中草药[1]。黄芩中含有多种黄酮类成分,主要成分是黄芩苷和黄芩素,二者均具有抗氧化、清除自由基、抗炎、抗病毒、抗过敏等多种药理作用,并对免疫、血管、神经等系统有保护作用[2-5]。大量研究表明,黄芩苷为复原型前体药物,黄芩苷在体内转化为黄芩素后才能发挥药效,黄芩素无论口服还是外用吸收情况均好于黄芩苷[6],更有研究显示黄芩素具有预防和治疗艾滋病的作用[7]。但黄芩药材中黄芩素含量相对较低,其黄芩苷含量大于10%,黄芩素含量仅为1%左右[8],因此黄芩素还远不能满足市场需求和临床应用,通过微生物发酵转化的方法将黄芩苷转化为黄芩素作为一种新兴的方法正受到广泛关注[6]。
微生物发酵中药在我国具有悠久的历史,现代微生物转化中药技术是传统中药炮制技术与现代生物技术相结合的产物,目前天然药物的生产主要是从天然植物中提取或通过化学方法合成,造成中药资源大幅消耗,野生资源消耗殆尽,而从植物中提取和化学合成都存在工序烦琐,劳动强度大,生产成本高的问题,通过生物转化可以克服这些弊端[9]。微生物转化用完整的微生物细胞或其产生的酶作为催化剂进行生物反应,具有优良的化学选择性、区域选择性和立体选择性,同时反应效率高、条件温和、副产物少、不造成环境污染、后处理简单[10],且能完成一些有机化学合成难以进行的反应,受到有机化学家,药物化学家和微生物学家们的极大重视,成为生物转化技术中发展最迅速的分支之一[9]。
微生物转化黄芩苷为黄芩素的本质是利用微生物产生的酶将黄芩苷的糖苷键水解生成黄芩素,酶催化反应针对特定位点得到特异性产物,反应条件温和,基本没有副产物,清洁环保。近年来有文献报道利用肠道菌[11]、黑曲霉[12,13]、米曲霉[14],白腐真菌[8],纳豆菌[15],固定化酵母菌和米曲霉[16]等转化黄芩苷为黄芩素的研究,但是利用青霉菌转化仅有一篇报道[17],且该报道对菌株转化产物只进行了初步的分光光度法分析。本研究从新鲜黄芩植株根部附生菌毛中分离得到一株青霉菌RM3,高效液相色谱定性定量分析表明该菌能够转化黄芩苷为黄芩素,在未经任何优化情况下,摩尔转化率达到83.87%,是一株极有应用前途的黄芩素生产菌。
1 材料和方法
1.1 材料
1.1.1 样品来源
菌株源自野生黄芩新鲜植株根部在空气中自然发毛后的样品,黄芩植株采自河北承德市滦平县,经河北师范大学赵建成教授鉴定为唇形科植物黄芩(ScutellariabaicalensisGeorgi)。
1.1.2 培养基
土豆汁:新鲜马铃薯200 g(去皮),水1 L。
制备方法:新鲜市售马铃薯,去皮后称取200 g,切小块,加水煮沸30 min,4层纱布过滤后补足水分至1 L。
菌种富集培养基(PDB):土豆汁1 L,葡萄糖20 g,自然pH,分装后121 ℃灭菌20 min。
菌种初筛培养基:黄芩药材粉末(药材60 ℃烘干5 h,粉碎,过40目筛)10 g,水1 L,自然pH,121 ℃灭菌20 min。
菌种分离培养基(PDA):土豆汁1 L,葡萄糖20 g,琼脂20 g,自然pH,121 ℃灭菌20 min。
菌种复筛培养基:灭菌的PDB培养基加入0.1%黄芩苷。
沙氏葡萄糖培养基:蛋白胨10 g,琼脂 20 g,葡萄糖40 g,水1 L,121 ℃灭菌20 min。
1.1.3 仪器
1260高效液相色谱仪(安捷伦公司,美国),THZ-98AB型恒温振荡器(上海一恒科学仪器有限公司),SPX-150型生化培养箱(北京市永光明医疗仪器有限公司),TBA-10B型洁净工作台(蚌埠净化仪器厂),LS-35HD型高压蒸汽灭菌器(江阴滨江医疗设备有限公司),BT125D型分析天平(赛多利斯公司,德国),DYCP-31D电泳槽(北京六一仪器厂),DYY-5稳压电泳仪(北京六一仪器厂),FR980 凝胶成像仪(上海复日科技有限公司),2720 thermal cycler PCR 仪(ABI公司,美国),HC-2518R冷冻高速离心机(BBI生命科学有限公司),DMBA300生物数码显微镜(厦门Motic有限公司),ELGA超纯水仪(威立雅公司,英国)。
1.1.4 试剂
黄芩素对照品(上海源叶生物科技有限公司,批号C02A6Y1,HPLC≥98%),黄芩苷对照品(北京盛世康普化工技术研究院,批号151121,HPLC≥99%),超纯水(自制),色谱甲醇(韩山公司,韩国),黄芩苷(上海源叶生物科技有限公司,批号C22J7Y9309, 纯度≥90%),黄芩药材购自河北安国药材市场,其余化学试剂均为分析纯。 DreamTaqTMDNA Polymerase(MBI公司,加拿大),琼脂糖(BBI生命科学有限公司),Ezup 柱式真菌基因组DNA 抽提试剂盒,SanPrep柱式DNAJ胶回收试剂盒,DNA Ladder Mix maker,PCR引物,dNTP及其他分子生物学试剂均购自生工生物工程(上海)有限公司。
1.2 方法
1.2.1 菌种的富集及初步筛选
新鲜黄芩植株根部自来水冲洗后自然风干,暴露于空气中,待根部发毛后挑取发毛部分转入富集培养基中,28 ℃,150 rpm培养5天后,按5%接种量接种到黄芩药粉筛选培养基中,28 ℃,150 rpm培养5~7天,再次转接至药粉筛选培养基中,如法传代培养3次。
1.2.2 菌株的分离纯化
将上述初筛菌液梯度稀释涂布于PDA平板,28 ℃静置培养5天,挑取完全分离的相异菌落进行再次分离,直至菌株为单菌,取得到的单菌进行下一步实验。
1.2.3 复筛
挑取上述单菌落,PDB培养基活化后按5%接种量转接至复筛培养液中,28 ℃,150 rpm培养5天后取出,提取后进行高效液相色谱分析,获得有转化能力的菌株。
1.2.4 转化产物高效液相色谱分析
样品制备:取菌液0.5 mL,加甲醇6~8 mL,超声10 min后取出,加甲醇定容至10 mL,0.22 μm滤膜过滤备用,以未接种的培养液同法处理作为空白对照。
对照品制备:精密称取一定量黄芩苷及黄芩素对照品于量瓶中,加甲醇配制成浓度分别为40.96 μg/mL的黄芩苷对照品溶液,10.00 μg/mL的黄芩素对照品溶液。
高效液相色谱法:色谱柱 Agilent ZORBAX Eclipse plus C18(4.6×250 mm,5 μm);VWD检测器;0.2%冰醋酸甲醇溶液(A)-0.2%冰醋酸水溶液(B)梯度洗脱(0~15 min:49%A,15~18 min:49%~61%A,18~35 min:61%A),柱温30 ℃,流速1.0 mL/min,检测波长275 nm,进样量10 μL。
1.2.5 标准曲线的绘制
黄芩苷标准溶液配制:精密称取黄芩苷对照品,加甲醇配制成浓度分别为102.4,81.92、61.44、40.96、20.48、10.24 μg/mL的黄芩苷标准溶液,进样前用0.22 μm滤膜过滤。
黄芩素标准溶的液配制:精密称取对照品黄芩素,加甲醇配制成浓度分别为40.00、30.00、20.00、10.00、5.00、1.00 μg/mL的黄芩素标准溶液,进样前用0.22 μm滤膜过滤。
标准曲线绘制:按上述1.2.4高效液相色谱法进行标准溶液测定,每浓度进样3次,以浓度及对应峰面积绘制标准曲线并得到线性回归方程,用于样品中对应成分含量计算。
1.2.6 转化率测定
根据1.2.5中线性回归方程计算样品及空白对照中黄芩苷、黄芩素的含量,微生物转化黄芩苷为目标产物的转化率按如下公式计算[14],公式中n表示物质的摩尔数,ρ表示物质的质量,M表示物质的摩尔质量)。

1.2.7 菌株形态学观察
将筛选得到的菌株接种到PDA平板和沙氏葡萄糖平板培养,观察菌落形态,用乳酸石炭酸棉蓝染色液染色,显微观察菌丝及孢子形态,进行初步形态学鉴定[18]。
1.2.8 菌株的分子生物学鉴定
提取菌体的全基因组DNA,利用引物ITS1,ITS4(ITS1:5′-TCCGTAGGTGAACCTGCGG -3′; ITS4:5′-TCCTCCGCTTATTGATATGC-3′)扩增菌体ITS序列(内转录间隔区1 和2);PCR扩增体系为25 μL,DNA模板0.5 μL,10x PCR buffer(with Mg2+)2.5 μL,dNTP(各2.5 mmol/L)1 μL,Taq酶0.5 μL;ITS1 0.5 μL,ITS2 0.5 μL,加双蒸水至25 μL;PCR扩增程序为:94 ℃预变性4 min,94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min;30个循环,72 ℃延伸10 min。扩增产物用1%琼脂糖电泳(150 V,100 mA,20 min)分离检验目的条带,用SanPrep柱式DNAJ胶回收试剂盒纯化回收ITS序列后进行测序(生工生物工程上海有限公司测序)。将测序结果提交NCBI数据库并登记获得登录号。Blast搜索出相似性高的序列,通过Mega7比对后用N-J法构建系统发育树。
2 实验结果
2.1 菌种的富集、初筛及初步分离
发毛后的黄芩根部菌种经富集后,接入黄芩药粉培养基中培养,经3次传代培养,能够代谢药粉为自身提供生长繁殖必需养分的优势菌株得以存活,而代谢缓慢或不能代谢黄芩药粉的菌株被淘汰。菌株可以以药粉为唯一营养源生长,即具有代谢转化黄芩活性成分的极大可能性,为下一步的筛选奠定良好基础。上述药粉发酵液经PDA平板分离得到菌株3株,3株菌均可在黄芩药粉培养液中正常快速生长,说明3株菌均可单独代谢黄芩药粉,即为候选菌株。
2.2 复筛及产物的高效液相色谱鉴定
将上述3株菌接种到含黄芩苷的PDB培养液中进行转化培养5~7天,转化产物提取后经液相色谱分析,得到一株能够转化黄芩苷为黄芩素的菌株RM3,该菌株转化黄芩苷得到的主要产物的出峰时间与黄芩素对照品出峰时间一致,转化后的培养液与空白对照相比黄芩苷含量大幅降低,出现了大量产物——黄芩素(图1),另外2株菌对黄芩苷也有一定程度的转化,但效果不明显。

图1 菌株RM3发酵转化样品(A),空白对照(B)及对照品(C,D)HPLC色谱图Fig.1 HPLC chromatogram of incubate sample(A)blank sample(B) and standard substance(C,D)注:1.黄芩苷;2.黄芩素。Note:1.Baicalin;2.Baicalein.
2.3 标准曲线
按1.2.5测定并绘制黄芩苷、黄芩素标准曲线(图2),得两种物质峰面积对应质量浓度的线性回归方程,黄芩苷(Y=32.045X-134.4;R2=0.995 3),黄芩素(Y=53.739X-78.4;R2=0.998 5)。黄芩苷、黄芩素分别在0.10~1.02 μg,0.01~0.40 μg范围内线性关系良好,可用于发酵液中各物质含量的计算。
2.4 转化率测定
将转化5天后的培养液提取后进行HPLC测定,根据标准曲线及转化率公式计算出菌株RM3在装量20 mL的PDB培养液中能将18.58 mg(0.042 mol)黄芩苷转化成9.43 mg(0.035 mol)黄芩素,摩尔转化率为83.87%,黄芩素浓度达到0.471 5 mg/mL,转化率高,转化稳定,具备产业化应用潜力。RM3在培养液中快速生长成白色致密小球,是理想的真菌发酵状态,利于大规模培养。
2.5 菌株形态学观察
将RM3分别接种到PDA及沙氏葡萄糖培养基上,逐日观察菌落形态。RM3在PDA培养基上生长较快,菌体绒状,中央有凸起,菌落正面墨绿色,边缘淡黄绿色,背面中央橙黄色,中心到边缘颜色逐渐变浅呈同心圆状,略有褶皱,培养7天后菌落直径约为3.0 cm(图3)。在沙氏葡萄糖培养基上生长略慢,与培养基接触紧密,菌落毯状,边缘不整齐,正面乳白色,背面乳黄色,有明显褶皱,培养7天后菌落直径约为2.2 cm(图3)。显微观察RM3菌丝较细,有横隔,孢子呈椭圆形或圆形,连成串珠状或分散状,分生孢子梗顶端生成帚状枝,单轮生(图4)。根据其形态特征初步将RM3归为半知菌门青霉菌属[19]。

图2 黄芩苷(A)和黄芩素(B)标准曲线Fig.2 Calibration curve of Baicalin(A) and Baicalein(B)
2.6 菌株分子生物学鉴定
PCR扩增ITS序列后电泳,结果显示500 bp左右有明显产物条带(图5),纯化后测序得到一556 bp的ITS序列,将该序列在Genebank上比对,菌株RM3与青霉菌(Penicilliumsclerotiorumstrain ZZ07-5)相似度达到99%,结合形态学及显微观察结果鉴定菌株为青霉菌,定名为Penicilliumsp.RM3。提交序列后得到Genebank登录号MH259810.1,N-J法绘制系统进化树如下图6。
3 结论
本研究通过菌种富集,黄芩药粉培养液初筛后分离单菌株,再将菌株接种至含0.1%黄芩苷的PDB培养液中进行转化实验,高效液相色谱法定性及定量分析后得到一株能够高效转化黄芩苷为黄芩素的菌株RM3。采用自然发毛的黄芩根部作为菌株来源,大大提高了获得黄芩活性成分转化菌株的几率,菌种经过富集后接种至黄芩药粉培养基继续筛选,能以药粉培养基为唯一营养成分快速生长的菌株,必然能够高效代谢药材中的成分获取自身营养,这又进一步增加了获取目的菌株的几率。最后经过黄芩苷转化实验得到了高效转化黄芩苷为黄芩素的菌株RM3。通过菌落的形态、显微结构观察及ITS序列分析比对显示该菌为青霉菌(Penicilliumsp)。未经任何优化,Penicilliumsp.RM3发酵黄芩苷的摩尔转化率即达到83.87%。
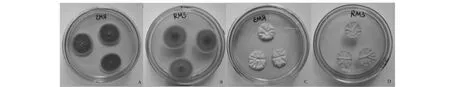
图3 PDA(A,B)及沙氏葡萄糖(C,D)平板上RM3菌落形态Fig.3 Colony morphologies of strain RM3 on PDA(A,B) and Shashi plates(C,D)
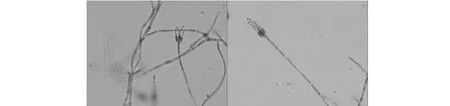
图4 菌株RM3显微观察(400×)Fig.4 Microscopic morphologies of strain RM3(400×)

图5 RM3的ITS扩增序列电泳Fig.5 Agarose gel electrophoresis of PCR production

图6 RM3系统进化树Fig.6 Phylogenetic tree of RM3
已有文献报道的黄芩苷转化为黄芩素转化率多是采用发生转化的底物与体系中添加的底物的比值得出[13-16],只能反应参与反应的黄芩苷的比率,并不能反映产物得率,在生物转化过程中参加反应的底物未必等摩尔的转化为产物。本文采用产物摩尔数与参加反应的底物摩尔数之比计算摩尔转化率,更真实的反映产物得率。报道的微生物转化黄芩苷为黄芩素的最高转化率为97%(优化后)[15],而该文献的转化率如采用本文公式计算,结果约为78%,可见菌株RM3转化效率较高,在生物转化应用上极有前景。
青霉菌因青霉素的发现闻名于世,其在生长过程中能够代谢产生多种活性化合物,成为研究最多应用最广泛的一类工业微生物[20]。本研究筛选得到了青霉菌,并成功实现了黄芩苷的生物转化。有前人对青霉菌完善而深入的研究及广泛工业化应用作为基础,青霉菌转化黄芩苷将更易于实现工业化。
生物发酵转化法作为中药增效减毒,结构修饰改造的优选方法,近年来受到广泛关注,成为天然药物开发的一条有效途径。然而作为生物科学与中药学的交叉学科,中药发酵转化并没有飞跃性的发展,还多数停留在实验室阶段,离真正的产业化还有很长的路要走。本课题组将在接下来的研究中优化转化条件,提高产量,探索稳定的发酵技术及产物分离方法,以期得到可以真正应用的产品,让生物技术为中药的发展应用提供强有力的支持。
