粘质沙雷氏菌S823次生代谢产物及其抗肿瘤活性研究
2019-03-08朱琳妍庞翠萍朱向东陈鲤群
朱琳妍,庞翠萍,朱向东,陈鲤群*
1福州大学生物科学与工程学院,福州 350116;2江南大学生物工程学院,无锡 214122; 3江西农业大学生物科学与工程学院,南昌 330045
甾体化合物通过微生物转化产生了新的产物,表现出抗肿瘤、抗菌等活性。匍匐根霉产生的孕烯醇酮转化产物对酪氨酸酶和胆碱酯酶的抑制活性明显高于母化合物[1]。1943年Turfitt[2,3]发现微生物能够降解胆固醇并生成C-19的甾体激素。利用生物转化技术能够得到前体所不具有的新特性化合物[4-6]。微生物的次生代谢产物也是抗肿瘤、抗菌等多种生物活性成分的来源。这些次生代谢产物具有重大的药用价值,引起学者们强烈兴趣。一些学者从沙雷氏属和链霉菌属细菌中分离到由3个吡咯环形成一个大的共轭体系构成分子骨架的抗菌活性成分[7,8],由Serratiamarcescens产生的Prodigiosin能抗耐甲氧西林金黄色葡萄球菌[9],Undecylprodiginine及其合成的衍生物23-hydroxyundecylprodiginine和2-ketoundecylprodiginine具有强烈抗疟原虫作用[10],以及从链霉菌属和沙雷氏属一些菌中分离出的Prodigiosin 25-C有免疫[11]和抗肿瘤活性[12]。
我们以胆固醇为唯一碳源筛选到一株菌株,该菌株能将胆固醇转化为7β-羟基胆固醇(7β-HC),目前没有文献报道。在此基础上,我们发现该菌提取物对Neuro-2a细胞(小鼠神经瘤细胞)有抑制作用,通过活性追踪,分离到活性成分灵菌红素,发现灵菌红素对细胞周期分裂蛋白25B (CDC25B)和含SH2结构域蛋白酪氨酸磷酸酶2(SHP2)这2个靶标蛋白具有强的抑制活性。SHP2的表达可以抑制肿瘤细胞的生长,此项研究在快速有效分离微生物中抗肿瘤活性成分方面是一种创新。大部分的SHP2细胞是通过靠近细胞膜促进酪氨酸的磷酸化而影响细胞生长,这些重要结论有助于抗肿瘤药物筛选,SHP2是潜在的靶分子。CDC25B在分裂的M和G1期存在于细胞核中,而到S期和G2期转移到细胞质中,CDC25B具有原癌基因性质,寻找到特异高效的抑制剂对癌症研究提供新的工具和手段。灵菌红素抑制Neuro-2a细胞(小鼠神经瘤细胞)的IC50值是0.05μM,此项研究为微生物资源利用,以及抗肿瘤药物研发提供科学依据。
1 仪器和材料
1.1 菌种来源
土样:采用同一地区多点取样,于2016年5月取自云南省昆明市市郊玉米田间红壤土。
菌种:以胆固醇为唯一碳源筛选得到。
1.2 培养基
富集培养基(g/L):土豆200、葡萄糖20、酵母膏3,pH7.0。
筛选培养基(g/L):胆固醇0.5+吐温80、MgSO40.25、K2HPO40.25、FeSO4·7H2O 0.001、NaCl 0.05、CaCl20.001、琼脂粉15,pH7.0。
斜面培养基(g/L):牛肉膏3、蛋白胨10、NaCl 5、琼脂粉15,pH7.0。
种子液培养基(BPDAg/L):牛肉膏3、蛋白胨10、NaCl 5,pH7.0。
转化培养基(g/L):酵母膏5、MgSO40.25、K2HPO40.25、FeSO4·7H2O 0.001、NaCl 0.05,CaCl20.001,pH7.0。
初始发酵培养基(BPDAg/L):牛肉膏3、蛋白胨10、NaCl 5,pH7。
1.3 供试细胞
Neuro-2a细胞(小鼠神经瘤细胞),来自江西农业大学生物科学与工程学院细胞生物学实验室所保存的细胞株。
1.4 试剂
胆固醇、氯仿、甲醇、石油醚、丙酮(国药集团);GF245硅胶层析板(青岛海洋化工有限公司);Sephadex LH20(Pharmacia公司,美国)。
胎牛血清(杭州四季青);0.25%胰蛋白酶-EDTA消化液、DMSO、MTT,PBS磷酸缓冲液干粉、DMEM高糖培养(北京索莱宝公司)。
1.5 仪器
PCR反应扩增仪(BBI公司,加拿大);高效液相色谱仪,Waters Symmetry C18色谱柱( 150 mm × 4.6 mm,5.0 m) (waters公司,美国);Agilent G6220A质谱仪(Agilent,美国);Avance 600核磁共振仪(Bruker公司,瑞士),RT-6000酶标仪(深圳雷杜)
2 实验方法
2.1 菌种初筛
取1 g土样放入装有50 mL已灭菌无菌水的三角瓶中,置于摇床振荡半小时,取土样水溶液1 mL于富集培养基中,28~30 ℃、180 rpm的摇床中培养24 h,从富集培养基中取200 μL加入到50 mL液体筛选培养基中,180 rpm 、30 ℃震荡培养48 h,共进行3次转移培养,然后取100 μL稀释度为10-6的菌液涂布于以胆固醇为唯一碳源的固体筛选培养基上,30 ℃倒置培养。菌落长出后根据形态挑取单菌落,在筛选培养基上纯化两次后将菌株转移至斜面上培养,编号并保藏。
2.2 复筛
将初筛得到的菌种接种于装有50 mL已灭菌发酵液的250 mL三角瓶中,180 rpm,28~30 ℃、摇床培养24 h后投入20 mL 0.5 g/L的胆固醇吐温80乳化液,相同条件下继续发酵培养4~7天。发酵液离心或过滤并用氯仿萃取,萃取液浓缩到一定体积,用硅胶板作薄层层析(TLC)进行检测分析,根据检测结果,筛选出具有转化胆固醇能力的菌株。
2.3 胆固醇转化产物的分离
转化发酵液离心后,将上清液与菌体分开,上清液浓缩至一定体积后用等体积氯仿反复萃取3次,然后用真空旋转蒸发仪50 ℃浓缩,用少量硅胶拌样,干燥后用100 g 200~300目硅胶装柱,用甲醇:氯仿=0~25%洗脱,每30 mL收集一流份,根据TLC检测。对含转化产物用Sephadex LH-20进行凝胶色谱,甲醇∶氯仿= 1∶1洗脱,再用Rp-C18反相色谱,水:甲醇=30∶70%~95∶5%洗脱,产物经波谱鉴定。
2.4 抑制肿瘤细胞活性检测
采用MTT法以Neuro-2a细胞(小鼠神经瘤细胞)作为供试细胞,通过对洗脱流份抗肿瘤活性检测,对含活性成的样品进行色谱分离,对分离到的活性化合物测定IC50值。
取在培养瓶中贴壁生长状态良好的细胞,弃去废培养基,每瓶加入PBS磷酸缓冲液,洗涤一遍弃去,除去衰老的细胞,每瓶(25 cm2)加入1 mL 0.25%胰蛋白酶消化,观察到培养瓶贴壁面有呈块细胞离散开来,弃去消化酶液,加入一定量的10%胎牛血清培养基配成3×104的细胞混悬液,接种于96孔板,每孔100 μL细胞悬液,(注意孔板周围一圈孔不加,而用PBS填充),待到细胞长到80%,弃去原来的培养基,加入供试样品溶液,浓度为80 μg/mL,每孔100 μL,同时用完全培养基作为空白对照,阳性参照化合物为阿霉素,溶剂对照(DMSO的浓度与最高浓度实验组中的DMSO的含量相当),每个实验组设立3个平行,放入培养箱中培养24 h,弃去培养基,加入100 μL 10%MTT的完全培养基,作用4 h,移去上清液,加入150 μL DMSO,摇床震荡30 min,待甲簪产物完全溶解后,用酶标仪在490 nm条件下测定OD值。根据公式(1)计算各组浓度组的细胞增殖抑制率:
细胞增殖抑制率=1-(OD实验组-OD空白对照组)/(OD溶剂对照组-OD空白对照组) ×100%
IC50值计算,根据测试活性剂量依赖关系,设5个浓度梯度,1、10、20、30、40 μg/mL,通过样品活性对样品浓度进行非线性拟和得到,计算所用软件为Graphpad Prism 4,拟合所使用的模型为Sigmoidal dose-response (varible slope)。
2.5 抗肿瘤活性成分分离
经过48 h发酵培养,发酵液合计2 L,经过离心去除上清液后,菌体用丙酮超声波进行浸提20 min,反复浸提3次,过滤,用真空旋转蒸发仪在50 ℃下浓缩得浸膏,用氯仿溶解,用适量硅胶拌样,干燥后进行硅胶柱层析,根据TLC检测,合并有相同组分的流份,以Neuro-2a细胞作为供试细胞,对洗脱流份进行抗肿瘤活性检测。上清液用氯仿萃取、浓缩后,得到的固体物质量很少,未做进一步实验。
2.6 转化产物和抗菌活性成分的结构鉴定
分离纯化的产物采用质谱和核磁共振波谱进行测定,溶剂为氘代氯仿,TMS作为内标。
2.7 菌种鉴定
2.7.1 形态及生理生化测定
通过形态学观察菌株在斜面培养基及筛选培养基上的菌落形态,电镜观察细胞形态,对菌株进行相关生理生化实验,参照东秀珠等编著的《常见细菌系统鉴定手册》[13]进行鉴定。
2.7.2 16S rDNA基因的克隆与测序
①基因组的提取:利用上海生工生物工程技术服务公司的Ezup 柱式细菌基因组 DNA 抽提试剂盒进行提取。
②以primerA (5′-AGTTTGATCMTGGCTCAG-3′) primerB(5′- GGTTACCTTGTTACGA CTT-3′)为上下游引物扩增菌株的16S rDNA。PCR反应体系(25 μL):0.5 μL Template (基因组 DNA 20~50 ng/μL),0.5 μL PrimerA(10 uM),0.5 μL PrimerB(10 uM),1 μL dNTP mix (2.5 Mm each),2.5 μL 10×Buffer(with Mg2+),0.2 μL 酶(5 u/μL),加水至25 uL。反应条件:预变性94 °C 4 min,循环94 °C 45 s,55 °C 45 S,72 °C 1 min,30个循环,延伸10 min。扩增的16S rDNA纯化后由上海生工有限公司直接测序。
③将序列上传到GenBank中进行比对,调取沙雷氏菌属(Serratia)12个标准菌株的16S rDNA序列,进行系统发育学分析。16S rDNA 序列用MEGA( 6.0) 软件排序,用Neighbor-Joining法构建系统发育树,用Kimura2-Parameter Distance模型计算进化距离,计算自引导值( Bootstrap,1 000次重复) 以评估系统发育树的置信度。
2.8 提取物抑制细胞周期分裂蛋白25B和含SH2结构域蛋白酪氨酸磷酸酶2(SHP2)活性测定
采用荧光底物OMFP,经CDC25B去磷酸化后得到的产物OMF在被485 nm激发光激发后可发射出波长为530 nm的可检测的荧光信号,从而观察酶的活性变化,以及化合物对其的抑制情况。阳性参照化合物为Na3VO4。
3 结果与分析
3.1 筛选结果
复筛得到16株呈深红色、圆形光滑形态的菌株,挑选一株,经过发酵培养,离心后上清液用氯仿萃取,并用硅胶板薄层层析法( TLC) 检测,展开剂为石油醚∶丙酮= 7∶3( v/v),用10%的H2SO4乙醇溶液作为显色剂。 样品用上述展开剂展开,喷雾、加热显色。发现这些菌株都能够转化胆固醇。其中一株菌,经上述实验,结果如图1。

图1 菌株发酵转化产物TLC检测Fig.1 TLC of strain of transformation注:1.接菌种的转化培养液;2.未接菌种的转化培养液;3.胆醇固标准品(A);4.分离纯化的7β-羟基胆固醇(B)。Note:Lane 1 is the bioconversion medium with inoculated strain;Lane 2 is the bioconversion medium without inoculated strain;Lane 3 is cholesterol(A);Lane 4 is 7β-dydroxycholesterol(B) separated from the extract of the strain S823.
3.2 菌株鉴定
3.2.1 菌落形态特征
菌株S828为革兰氏阴性短杆菌,电镜显示大小约大小为(1~1.3)μm×(0.7~1.0)μm,如图2所示,无荚膜,无芽孢,周生鞭毛。30 ℃在平板上培养36 h,菌落凸起,呈圆形光滑状,湿润,中心不透明,边缘整齐,深红色,易挑取,培养时间超过72 h,菌落易成树枝状,边缘不规则。在液体培养基中混浊,形成菌膜,在筛选平板上呈粉红色不透明菌落。

图2 菌株S823的电镜图Fig.2 Scanning electron micrograph of isolate S823
3.2.2 生理生化实验
通过部分的生理生化试验(表1),结果显示菌株S823与粘质沙雷氏菌非常相似。

表1 菌株S823的生理生化特征
续表1(Continued Tab.1)

项目Item标准反应Standard reaction结果Result项目Item标准反应Standard reaction结果ResultKNO3利用Use of KNO3 --(NH4)2HPO4利用Use of (NH4)2HPO4-+
注:“+”90%以上菌株阳性,“-”90%以上菌株阴性, “D”不同分类单位中的反应不同。
Note:“+”over 90% showing the positive bacteria strains;“-” over 90% showing the negative bacteria strains;D represent the different reaction in the different taxonomic unit.
3.2.3 16S rDNA鉴定
16S rDNA测序结果表明,16S rDNA序列有1434个碱基(如下),在Genebank中进行比对分析,并绘制系统发育树,见图3,确定该菌株为粘质沙雷氏菌属,并命名为Serratiamarcescenssp.S823,上传序列号为KR817904.1。
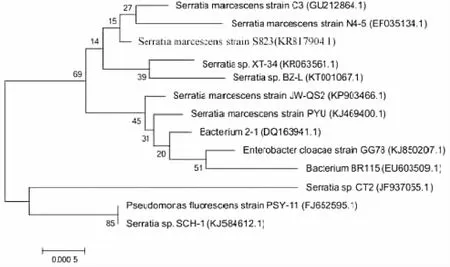
图3 基于16S rDNA序列的系统发育树Fig.3 Phylogenetic tree based on 16S r RNA sequences of selected strains.Numbers in parentheses represent the sequences paccession number in GenBank.The number at each branch points is the percentage supported by boot strap.Bar,0.5% sequence divergence
3.3 转化产物分离
转化发酵液合计1 L,离心后,上清液浓缩至一定体积后,用等体积氯仿反复萃取3次,合并萃取液,真空浓缩,经硅胶柱、凝胶柱、反相柱色谱进行分离,得到了化合物1,称重83 mg。
3.4 抗肿瘤活性物质的分离
经过48 h发酵培养,发酵液合计2 L,离心后,菌体用丙酮超声波进行浸提、浓缩得浸膏,用氯仿溶解,用适量硅胶拌样,干燥后用200克200~300目硅胶装柱(5×80),氯仿:甲醇=100∶0~70∶30洗脱,每瓶收集50 mL,共22个流份,根据TLC检测,展开剂为石油醚∶丙酮= 7∶3(v/v),10%的H2SO4乙醇溶液作为显色剂。 样品展开后,喷雾、加热显色。合并有相同组分的流份,得到7个部分F1-F7,浓缩干燥后用DMSO溶解,用蒸馏水配成80 μg/mL溶液,DMSO在最终体系中浓度控制在不影响检测活性的范围之内。经抑制肿瘤实验,F3显示了对Neuro-2a细胞有抑制作用(图4)。 TLC显示,F3只有一个红点,这表明F3可能是一个纯的化合物,其纯度用HPLC进行检测。F3真空干燥后,得到了化合物2,称重62 mg。准确称取化合物2样品3.6 mg用乙腈定容至10 mL,配制成0.36 mg/mL的溶液,取10 μL溶液进样进行HPLC测定。分析条件如下:色谱柱:Waters Symmetry C18色谱柱( 150 mm × 4.6 mm,5.0 m):温度:35 ℃;流速:0.45 mL/min;检测:RI2000示差检测器;流动相A:乙腈=10%,流动相B:水=90%。出峰时间为8.931 min,其峰面积比接近99%,说明其纯度达到99%(图4)。F1- F2和F4-F7对Neuro-2a细胞没有抑制作用,没有进一步分离。
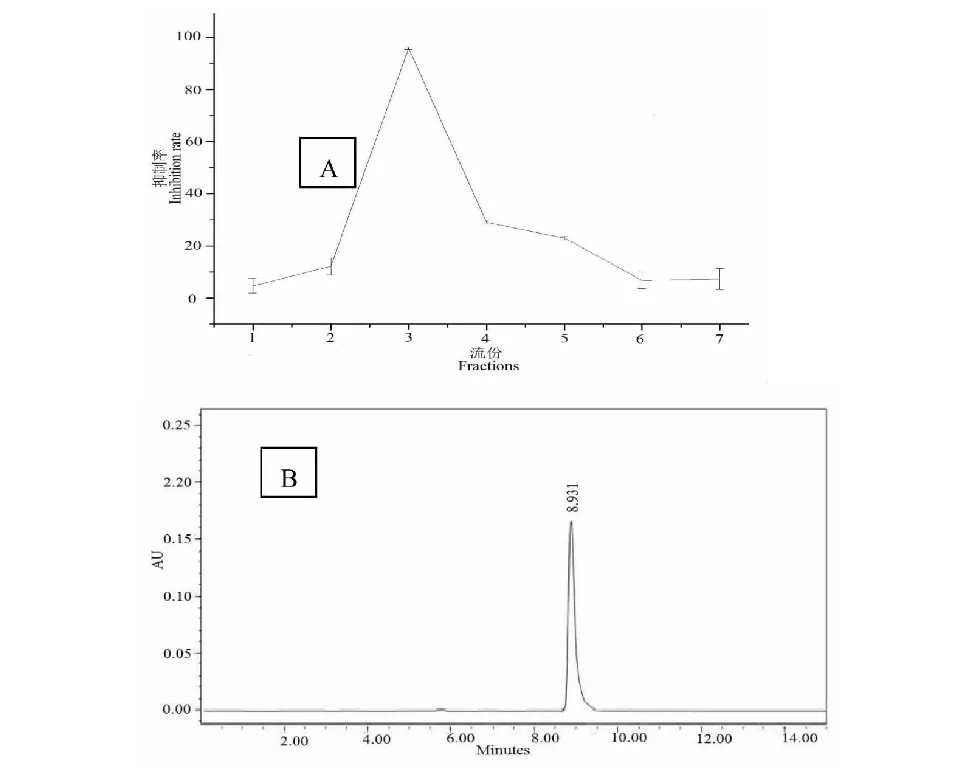
图4 菌株S823提取物柱层析洗脱组份对Neuro-2a细胞的抑制率(A)和F3(化合物2)HPLC图(B)Fig.4 The inhibition rate of different parts of the extract of the strain S825 against Neuro-2a cell (A) and the HPLC spectrum of F3 (compound 2)(B)
2.5 化合物鉴定
化合物1无色固体;1H NMR(CDCl3,600 MHz),δ:0.69(s,3H)、0.86(d,3H,J=2.4)、0.87(d,3H,J=3.0)、0.93(d,3H,J=6.6)、1.05(s,3H),δ5.28(1H,s,H-6),δ3.54(m,1H,3-βOH),3.84(d,1H,7-βOH);13C NMR (CDCl3,150MHz)δ:36.9 (t,C-1),31.6 (s,C-2),71.4 (d,C-3),41.7 (t,C-4),143.5 (s,C-5),125.5(d,C-6),73.4 (d,C-7),40.9 (d,C-8),48.3 (d,C-9),36.4 (d,C-10),21.1 (t,C-11),28.6 (t,C-12),42.9 (s,C-13),55.4 (d,C-14),26.4 (t,C-15),39.6 (t,C-16),54.9(d,C-17),11.8 (q,C-18),19.2 (q,C-19),35.7(d,C-20),18.7 (q,C-21),36.2 (t,C-22),23.9(t,C-23),39.5 (t,C-24),28.0 (d,C-25),22.6 (q,C-26),22.8(q,C-27)。数据与文献中的报道基本一致[14],由此,可判断该化合物为7β-羟基胆甾醇(7β-hydroxycholesterol,7β-HC)。
化合物2红色固体;UV (MeOH)λmax 535;1H NMR (CDCl3,600 MHz),δ:12.55 (s,NH),12.70 (s,NH),7.22 (s,1H,H-2),6.35 (t,J=1.8 Hz,1H,H-3),6.91 (m,1H,H-4),6.08 (d,J=1.8 Hz,1H,H-8),6.94 (m,1H,H-12),6.67 (s,1H,H-14),4.00 (s,3H,O-Me),2.38(t,2H,H-18),2.54 (s,3H,H-15),1.2- 1.4 (m,6H.H-19-21),0.89 (t,3H,H-22);13C NMR (CDCl3,150 MHz),δ:126.9(C-2),111.7(C-3),117.0(C-4),122.2(C-5),147.7(C-7),92.8(C-8),165.5(C-9),120.7(C-10),
58.7(C-1),116.0(C-12),125.1(C-13),128.5(C-14),128.5(C-15),147.0(C-16),12.4(C-17),25.3(C-18),29.8(C-19),30.6 (C-20),22.5(C-21),14.1(C-22);ESI-MS:m/z324.3[M+H]+( C20H25N3O)。数据与文献报道的灵菌红素(prodigiosin)一致[15],确定为灵菌红素,结构为(5[(3-methoxy-5-pyrrol -2- ylidene-pyrrol -2- ylidene) -methyl] -2- methyl- 3-pentyl-1 H pyrrole) (见图5)。

图5 底物、转化产物和次生代谢活性产物结构式Fig.5 Structures of substrate and biotransformation product and activity compound注:化合物A:胆甾醇,B:7β-羟基胆甾醇,C:灵菌红素。Note:Compound A,Cholesterol;B,7-β-hydroxycholesterol;C,prodigiosin.
3.6 灵菌红素抑制CDC25B和SHP2活性测定
实验以Na3VO4作为对照样品,实验结果显示,灵菌红素对细胞周期分裂蛋白25B(CDC25B)和含SH2结构域蛋白酪氨酸磷酸酶2(SHP2)有抑制活性,而7β-羟基胆甾醇对这2个靶标蛋白没有抑制活性(表2)。

表2 活性化合物对CDC25B和SHP2的抑制
3.7 抑制肿瘤细胞IC50值测定
以Neuro-2a细胞作为供试细胞,根据测试活性剂量依赖关系,测定了灵菌红素5个浓度梯度,1、10、20、30、40 μg/mL对Neuro-2a细胞的抑制率分别为29.9%、41.9%、55.2%、68.5%、81.8%,通过样品活性对样品浓度进行非线性拟和得到,测得IC50为0.05 μmol/L。
4 结论
在本研究中,我们通过微生物转化,首次用筛选的粘质沙雷氏菌转化得到7β-羟基胆甾醇,此化合物有重要的生物活性,其对体外培养的增殖分化的细胞及肿瘤细胞具有细胞毒性作用,诱导细胞凋亡,而对非增生的、缓慢分裂的神经元和星形胶质细胞,没有毒性作用[16]。并从该菌中分离得到灵菌红素,此代谢产物对细胞周期分裂蛋白25B (CDC25B)和含SH2结构域蛋白酪氨酸磷酸酶2(SHP2)有强的抑制活性,这是我们首次报道灵菌红素对这两种靶标有抑制作用。灵菌红素广泛的生物活性,包括抗菌活性[9]、抗疟疾活性[10,17]、免疫抑制活性[11,18],以及抗肿瘤活性[19,20]激发国内外学者强烈兴趣。一些学者对不同环境产灵菌红素菌株筛选[9]、灵菌红素的合成和结构进行了研究[20]。这些研究成果可为开发利用微生物,研制抗肿瘤药物提供科学依据。
