灵芝孢子油体外抗肿瘤活性比较研究
2019-03-08彭学翰谢文敏
彭学翰,谢文敏,李 霁,于 锋*
(1中国药科大学基础医学与临床药学学院,南京 211198;2南京绿叶制药有限公司,南京 210061)
灵芝是一种极具药用价值的担子菌多孔菌科灵芝属真菌[1],其主要活性成分为多糖,肽聚糖和三萜,灵芝的各个部分如:菌丝体、孢子和子实体均具有药用特性[2]。已有临床研究证实灵芝的菌丝体,孢子和子实体中富含多种生物活性物质使其具有免疫活性、抗肿瘤、抗衰老、抗病毒以及降血脂等多种生理功能[3-4]。灵芝孢子油是通过超临界CO2萃取技术从破碎的孢子中提取的,灵芝孢子油中的主要成分为灵芝三萜类化合物(GLT),是由一种或多种异戊二烯单元组成的化合物,具有抗炎和抗肿瘤活性,而灵芝拥有超过140种三萜类和三萜类化合物,研究证实,从灵芝中提取的三萜亚型可能会影响人肿瘤细胞的活力[5-6]。
肝癌、肺癌、结肠癌均属于全球发病率较高的肿瘤。1990- 2015年期间,全球肝癌病例数增加了75%[7];2008年以来,肺癌在中国取代肝癌成为肿瘤死亡的首要原因,发病率也位居第一[8];美国国家肿瘤研究所统计2017年美国有135430例结直肠癌新病例,相当于所有新发肿瘤病例的8%[9]。灵芝作为一种传统中药,广泛用于医疗保健领域,而已有相关研究表明灵芝三萜类化合物具有一定的抗肿瘤活性[10],因此本研究选用富含灵芝三萜类化合物的灵芝孢子提取物灵芝孢子油对人肝癌细胞(HepG2)、人非小细胞肺癌细胞(A549)、人结肠癌细胞(HCT116)进行抗肿瘤活性比较,并对其抗肿瘤机制进行初步探讨。
1 材 料
1.1 药品与试剂
灵芝孢子油(GSO,100 mg/mL,南京中科药业有限公司);噻唑蓝,BCA蛋白浓度检测试剂盒,SDS-PAGE上样缓冲液,Caspase-3活性检测试剂盒(碧云天生物技术研究所);醋酸纤维素膜(0.22 μm,武汉博士德生物工程有限公司);牛血清白蛋白(生工生物工程上海股份有限公司);ECL高敏显影液(上海天能科技有限公司);NF-κB抗体,p-NF-κB抗体(美国Cells Signaling Technology公司)。
1.2 细胞株
人肝癌细胞(HepG2)、人非小细胞肺癌细胞(A549)、人结肠癌细胞(HCT116)购自中国科学院上海细胞库。
1.3 仪 器
多功能酶标仪(美国Molecular Dvices公司);BS124型电子天平(北京赛多利斯科学仪器有限公司);Mini-Protein 3型垂直电泳仪、半干式转膜仪(美国Bio-Rad公司)。
2 方 法
2.1 细胞培养
将HepG2,A549,HCT116细胞复苏后,使用含有10%胎牛血清的DEME培养基将细胞置于37 ℃、5% CO2的细胞培养箱中进行培养,当细胞的生长密度达到70%~80%时,使用0.25%胰蛋白酶进行消化并传代培养。
2.2 MTT法检测细胞活力
将GSO母液(100 mg/mL)用含2.5%血清的培养基稀释至GSO质量浓度为0.1,0.5,1,2,5 mg/mL 5种浓度。待细胞贴壁后,将96孔板内的培养基弃去,选取药物质量浓度为0.1,0.5,1,5 mg/mL 的DMEM培养基100 μL继续培养细胞24 h。设置空白对照组,实验组根据不同浓度分为4组,每组设置6个复孔。
将药物质量浓度为2 mg/mL的培养基按如上给药方式加入到96孔板中,按培养时间分为3组,每组6个复孔,每组设置相应对照组,分别培养24,48,72 h。培养结束后,将MTT 15 μL加入到培养基中继续培养4 h,4 h后弃去培养基,每孔内加入DMSO 150 μL将结晶溶解,摇床振荡10 min后用酶标仪在490 nm处检测吸收度。
2.3 Western blot蛋白印迹法检测NF-κB通路激活程度
将3种细胞培养于细胞培养瓶中,待生长面积达到80%后,进行给药处理。分别设置空白组与实验组,实验组按照不同给药浓度分为3组,药物质量浓度梯度为0.125,0.25,0.5 mg/mL。给药完毕后继续培养24 h。
向每个培养瓶中加入裂解液100 μL,用细胞刮刀刮下贴壁细胞,收集至1.5 mL离心管中,振荡器上振荡10 min后,12 000 r/min 4℃下离心10 min,吸取上清液,采用BCA法检测蛋白含量。取总蛋白30 g进行聚丙烯酰胺凝胶电泳(SDS-PAGE),浓缩电压选取80 V,浓缩40 min,分离电压选取120 V,分离60 min。4 ℃ 300 mA恒流条件下转膜60 min,脱脂奶粉封闭90 min,一抗孵育(NF-κB,p-NF-κB,GAPDH),4 ℃ 过夜,TBST洗膜3次,每次15 min,二抗孵育90 min,TBST洗膜3次,每次15 min,将覆盖有ECL发光液的NC膜放置于凝胶成像仪中发光成像,并用Gel-Pro analyzer 4软件进行灰度分析。
2.4 Caspase-3活性检测
使用Caspase-3活性检测试剂盒对样品进行检测,设置空白组与实验组,实验组按照不同给药浓度分为3组,药物质量浓度梯度为0.125,0.25,0.5 mg/mL。
收集样品,测定pNA(p-nitroaniline)标准曲线并进行样品Caspase-3酶活性的检测。取出适量的Ac-DEVD-pNA(acetyl-Asp-Glu-Val-Asp p-nitroanilide)(2 mmol/L)置于冰浴上备用。设置反应体系,依次加入检测缓冲液,待测样品,适当混匀,避免在混匀时产生气泡,随后再加入Ac-DEVD-pNA(2 mmol/L)10 μL,摇匀,再在37 ℃孵育60 min。发现颜色变化比较明显时即可测定,并计算样品中Caspase-3的酶活性。
3 结 果
3.1 MTT法检测细胞活力
由图1可知3种细胞培养24 h后,随着给药剂量的增加,细胞活力均呈现下降趋势,其中A549细胞和HepG2细胞细胞活力下降较HCT116明显,由表1可知将3种细胞在不同培养时间下的IC50进行比对显示灵芝孢子油对A549的IC50最低,抑制活性最强。

Figure 1 Cell viability of HepG2,A549 and HCT116 cells treated with Ganoderma lucidum spore oil (GSO) for 24,48 and 72 h

Table 1 Antiproliferative activity of GSO against HepG2,A549 and HCT116 cells for 24,48 and 72 h
将3种细胞在同一给药浓度下分别培养24,48,72 h后发现,培养24,48,72 h后3种细胞的的细胞活力曲线均呈下降趋势,说明灵芝孢子油其抗肿瘤活性呈时间依赖性。
3.2 Western blot检测NF-κB通路激活程度
Western blot法检测NF-κB及p-NF-κB的表达。由图2可知NF-κB的表达量均随给药浓度增加而逐渐降低,p-NF-κB的表达量均随给药浓度增加而逐渐升高,p-NF-κB/NF-κB比值均随给药浓度增加而逐渐升高,由表2可知,将3种肿瘤细胞的p-NF-κB/NF-κB比值进行对比发现A549P比值最高,HepG2细胞次之,HCT116细胞最低。
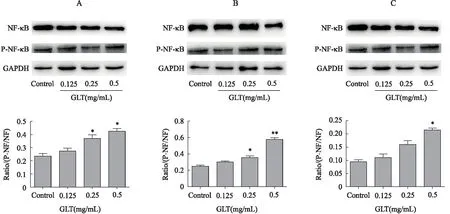
Figure 2 Effect of different concentration of GSO on activation of NF-κB signaling in HepG2(A),A549(B) and HCT116 (C)

Table 2 Effect of different concentration of GSO on activation of NF-κB signaling in HepG2,A549 and HCT116 cells (Ratio of p-NF-κB/NF-κB)
3.3 Casepase-3活性检测
采用Casepase-3活性检测试剂盒检测Casepase-3的酶活性。由图3可知3种肿瘤细胞内Casepase-3的活性均随灵芝孢子油给药浓度增加而逐渐升高,由表3可知,将3种肿瘤细胞Casepase-3的活性进行比对,A549细胞在不同给药浓度下Casepase-3的活性最高,HepG2细胞次之,HCT116细胞最低。

Figure 3 Effect of different concentration of GSO on activation of Caspase-3 activity in HepG2(A),A549(B) and HCT116 (C)

Table 3 Effect of different concentrations of GSO on activation of Caspase-3 activity in HepG2,A549 and HCT116 cells for 24 h
4 讨 论
MTT法测定结果发现,灵芝孢子油对A549细胞的抗肿瘤活性最强,HepG2细胞次之,对HCT116细胞抗肿瘤活性最弱并且均具有明显的剂量依赖性。将3种细胞在2 mg/mL灵芝孢子油下分别培养24,48,72 h,实验结果显示3种细胞的细胞活力随培养时间的延长呈现明显下降的趋势,由此可知,灵芝孢子油的抗肿瘤活性呈时间剂量依赖性。
NF-κB作为一中最常见的炎症因子,它的激活往往与细胞的炎性损伤有着密不可分的关系。已有相关研究表明,炎症反应或NF-κB信号通路在肿瘤中具有双面作用[11]。一方面在急性炎症反应中,具有高活性的免疫毒性细胞对抗肿瘤细胞的过程中,NF-κB通路会被高度激活[12],而另一方面NF-κB可以调节肿瘤细胞的增殖侵袭,并且具有一系列促癌功能[13]。在本实验中,灵芝孢子油可不同程度地造成3种肿瘤细胞内NF-κB的磷酸化,且磷酸化程度随剂量加大而升高,将3种细胞的Western blot结果进行综合比对可发现,A549细胞内的NF-κB在灵芝孢子油的作用下磷酸化程度相比较而言更高,HepG2细胞次之,HCT116细胞内NF-κB磷酸化程度相对最弱。因此可以初步得出结论,灵芝孢子油可激活肿瘤细胞内NF-κB的磷酸化,可能通过激活NF-κB的磷酸化使肿瘤细胞产生炎性损伤而坏死,在本实验所选取的3种肿瘤细胞中,灵芝孢子油对A549肿瘤细胞抑制程度最强。而NF-κB与细胞凋亡之间的关系目前仍处于研究阶段,但已有研究表明NF-κB可能通过影响HSP27的表达,ROS积累以及MAPK通路激活诱导细胞凋亡[14],具体机制还需进一步研究。
Caspase-3在细胞凋亡过程中极其重要,其激活对肿瘤细胞的凋亡具有决定性的作用。Caspase蛋白水解酶主要负责细胞凋亡的起始和执行,根据功能的不同,Caspase可分为起始Caspase和效应Caspase[15],Caspase-3属于效应Caspase,主要负责凋亡的执行[16-17];Xue的研究发现促进Caspase-3的表达可进而诱导肺癌细胞的凋亡[18-19];由本实验结果可知,灵芝孢子油可明显促进3种肿瘤细胞内Caspase-3酶的活化且酶活力随灵芝孢子油浓度增加而升高,将3种细胞的Caspase-3酶活性检测结果进行综合比对可发现,A549细胞内的Caspase-3酶活力上升最明显,HepG2细胞次之,HCT116细胞内Caspase-3酶活力上升相对较弱。
本研究发现灵芝孢子油具有较强抗肿瘤活性,其抗肿瘤活性呈时间剂量依赖性。其机制可能是通过激活NF-κB通路加重肿瘤细胞的炎性损伤,同时激活Caspase-3凋亡途径加速肿瘤细胞凋亡来实现的。经实验验证,灵芝孢子油对A549细胞生长抑制作用最强,HepG2细胞次之,对HCT116的抑制作用最弱,而出现敏感性差异的原因可能与不同细胞内与凋亡坏死相关的基因表达差异有关如:Bax,Bak,Bcl-2以及TNF-α等,具体原因以及抗肿瘤活性机制有待进一步研究。
