抗肿瘤血管生成治疗的纳米递送策略
2019-03-08杨杉,徐程,姚静
杨 杉,徐 程,姚 静
(中国药科大学药学院,南京 210009)
抗血管生成治疗(anti-angiogenic therapy)是临床多种实体瘤(如非小细胞肺癌、乳腺癌、结直肠癌等)的标准治疗方法之一[1],相比于一般分子靶向策略只能基于生物标志物而选择性地用于特定肿瘤分型,其适用于更广泛的病患群体。
基于不断揭示的抗血管生成机制及相关靶点,研究者们从单纯着眼于血管内皮细胞、周细胞、基底膜等血管自身组分,发展到对肿瘤细胞外基质(如胶原、透明质酸等)、肿瘤相关成纤维细胞、免疫细胞、干细胞等微环境组分的全局分析并加以调控,运用化学修饰、超分子自组装等策略构建纳米递送系统,提高递送效率并改善抗血管生成疗效,同时通过递送过程中的“纳米-生物体相互作用”(nano-bio interaction)[2]对抗血管生成机制进行深入探索。此外,还可通过与化疗、放疗以及免疫疗法等治疗手段联用进一步拓宽抗肿瘤血管生成治疗的应用。纳米递送系统能够发挥其特有的协同增效作用,除了长循环、肿瘤部位渗透性好等特性以提高递送效率,还能整合各种功能组分,发挥主动靶向肿瘤血管、改善肿瘤微环境乏氧、调节免疫等功能,产生“鸡尾酒效应”。本文着重介绍通过纳米体系的构建提高抗血管生成药物的递送效率并改善抗血管生成治疗疗效的策略。
1 抗肿瘤血管生成治疗
1.1 肿瘤血管生成
血管是生命体内氧气、营养和代谢废物的运输“管道”,其与肿瘤发生发展关系密切。抗血管生成理论提出:肿瘤血管生成是肿瘤迅速成长、侵袭和转移的关键[3]。血管生成的研究经历了许多重要事件(图1),该时间轴节选了血管生成研究中的历史性发现以及FDA批准的几个具有代表性的药物。
血管生成是一个受到精确调控的动态平衡过程,在生理条件下内源性血管生成刺激因子[如血管内皮生长因子(VEGF)、血管生成素-2]和抗血管生成因子(如内皮抑素、血管抑素)呈现动态平衡,而在病理条件下,肿瘤细胞能够上调一种或者几种血管生成刺激因子导致稳态失衡,诱生异常血管,加之肿瘤微环境中的各种物理压迫,最终表现为肿瘤部位的血流灌注异常[4]。着眼于病理条件下血管生成的发生发展过程,探讨参与这些过程的各类因子,理解其发挥各自功能时的具体效应及调控机制,为抗血管生成治疗提供了切入点。
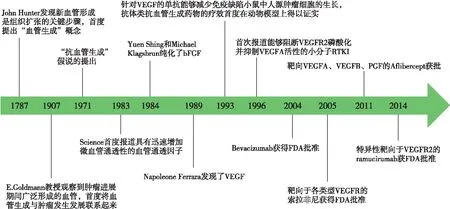
图1 血管生成研究相关历史性发现及代表性上市药物
1.2 抗肿瘤血管生成药物
肿瘤的类型、生长状态、位置不同,对血流灌注产生的损伤程度也各不相同,甚至在同一肿瘤的不同区域之间也不尽相同,针对这一复杂过程设计的抗血管生成药物种类繁多,包括生长因子抑制剂、细胞外基质降解酶抑制剂、内源性血管生成抑制剂等。抗血管生成作用的机制见表1。其中,促血管生成生长因子抑制剂研究得较为深入,VEGF及其受体是这一类抑制剂中研究最多的靶点[5]。作为血管内皮细胞的特异性有丝分裂原,VEGF参与了血管生成的各个阶段,尤其是在肿瘤低氧环境下,VEGF与内皮细胞膜上的受体结合,引起受体自磷酸化,进而激活有丝分裂原活化蛋白激酶(MAPK),诱导内皮细胞增生[6];在低氧环境下VEGF还能调节血浆酶原活化因子(PA)和血浆酶原活化因子抑制因子-1(PAI-1)的转录,通过提高PA活性促进肿瘤细胞外蛋白水解,进而促进血管新生[7]。此外,VEGF还能诱导肿瘤细胞中抗凋亡蛋白Bcl-2的表达[8]。
目前已有十多种药物获批用于抗血管生成治疗,大多直接靶向VEGF信号通路[9],例如针对VEGF的单克隆抗体、针对VEGF受体的小分子酪氨酸激酶抑制剂等。这些药物除了少数作用于单一靶点,大多能够同时作用于多个靶点,协同多种机制发挥抗血管生成作用,例如辉瑞公司开发的小分子抑制剂阿西替尼(axitinib)能够同时作用于VEGFR1、VEGFR2、VEGFR3、PDGFRβ和c-Kit[8]。
尽管肿瘤招募血管的普遍性使得抗血管生成治疗具有一定的“广谱性”,但单纯使用抗血管生成药物无法获得理想的治疗优势,由于肿瘤招募血管的机制复杂且随空间和时间变化,肿瘤能够利用非招募方式(如血管共择)、激活逃逸性信号通路(如Ang2/Tie2/VE-PTP)、内皮细胞的旁分泌等机制对抗血管生成治疗产生耐药并增强自身侵袭性,促进转移。此外,抗血管生成治疗存在固有毒性,包括高血压、血栓、蛋白尿、肠穿孔等不良反应[10],其中鳞状细胞肺癌患者发生咯血、患有实质性盆腔疾病且先前进行过肠道手术患者发生肠穿孔均具有致死性。性能优越的纳米递药系统不仅能尽可能克服现有治疗的局限性,还能提高抗血管生成药物的递送效率,为抗血管生成治疗的发展开辟新天地。

表1 抗血管生成在肿瘤治疗中的作用机制
2 抗血管生成纳米体系的构建策略
2.1 直接提高抗血管生成疗效的纳米递送系统
用于构建纳米递送系统的材料中,有一大类本身就具有特殊的生物活性,不同于仅作为递送载体的惰性材料,其具备各自特有的细胞毒性、抗血管生成活性等。将其运用于纳米递送体系的构建具有直接的抗血管生成活性,能够协同治疗组分产生“1+1>2”的抗血管生成效应。按照载体材料的物理属性可分为天然高分子聚合物类、蛋白多肽类以及无机材料类。
2.1.1 天然高分子聚合物纳米粒 与合成材料相比,天然高分子材料生物相容性好,其中肝素、透明质酸等多糖不仅可作为纳米递药体系的载体,亦被证实具有抗血管生成活性。低相对分子质量肝素(low molecular weight heparin,LMWH)作为肝素酶的竞争性抑制剂,能够阻断VEGF、FGF等肝素结合生长因子与内皮细胞和细胞外基质表面受体的结合,降低内皮细胞的增殖和迁移,它还能刺激血管内皮释放组织因子途径抑制剂(TFPI),抑制组织因子发挥促血管生成作用[13]。由其构建得到的天然高分子聚合物纳米粒能在充分发挥载体自身的抗血管生成活性的同时协同药物增效。此外,壳聚糖[14]和透明质酸[15]也常用于构建此类递送系统,由透明质酸修饰的壳聚糖纳米粒(HA-CH-NPs)可用于siRNA的靶向递送[16],研究表明掺入血管生成相关基因PLXDC1 siRNA的HA-CH-NPs可显著减少肿瘤新生血管(P<0.001)。
Li等[17]将LMWH与熊果酸(UA)接枝得到的两亲性LMWH-UA结合了二者固有的抗血管生成活性并能自组装成壳/核结构,进一步修饰靶向配体实现了抗血管生成药物的协同增效和靶向递送。实验表明其对人脐静脉内皮细胞具有抑制作用(P<0.01),且碱性成纤维细胞生长因子(b-FGF)诱导的血管生成受到显著抑制(P<0.001)。本研究进一步探讨了聚合物纳米粒的抗血管生成效率与其在肿瘤部位的释药行为之间的关系[18]。利用酸敏感的席夫碱连接LMWH和UA,得到能够更加有效地在溶酶体酸性环境中释药的聚合物纳米粒,检测发现含酸敏感键组的VEGF表达量显著低于不含酸敏感键组(P<0.01),抗血管生成活性增强。Tian等[19]利用LyP-1肽修饰的LMWH-槲皮素缀合物(PLQ)包载化疗药物藤黄酸(GA),使用Drabkin′s Reagent评估不同制剂组基质栓中血红蛋白(Hb)含量(该含量可作为新血管形成的评价指标),随着LyP-1肽、槲皮素和GA的陆续引入,基质栓中Hb含量下降,抗血管生成活性增强。与PLQ组相比,PLQ/GA组基质栓中的Hb含量降低了6.1倍(P<0.01),表明GA和PLQ的联合治疗能够显著增强对血管新生的抑制。该体系将多种治疗组分递送至肿瘤细胞和肿瘤周围淋巴管,还协同有逆转多药耐药功能,拓宽了抗血管生成治疗的应用。
2.1.2 多肽蛋白纳米粒 许多蛋白多肽类物质源于天然蛋白的功能结构域,作为本身就具有独特生物学功能的活性物质(如特异性结合受体、激活或抑制细胞信号转导等),可用于纳米递送系统的设计。体系构建过程中蛋白多肽的结构得到一定修饰,其空间结构也随体系的组装发生变化,加之与其他组分产生相互作用(如疏水作用、π-π作用、配位作用、静电作用等),使最终的体系得以发挥更好的活性,甚至产生新的功能,其中就包括抗血管生成活性。
ES2是内源性新生血管抑制剂内皮抑素(ES)的氨基端活性序列,可有效抑制内皮细胞的增殖和侵袭,其抗血管生成活性约为完整ES序列的3倍。AF肽是由合成肽文库筛选得到的能够特异性结合VEGF的六肽。将二者接合得到ES2-AF肽,再用透明质酸(HA)修饰得到HA-ES2-AF纳米颗粒状共聚物[20]。该递送系统通过ES2-AF接合实现了ES2和AF的联用,显示更强烈的内皮细胞抑制作用。有赖于HA对肿瘤高表达CD44蛋白的亲和力,与ES2-AF相比,HA-ES2-AF在肿瘤部位的分布显著增多,且这种生物相容性较好的天然活性聚合物有利于多肽更长效地发挥作用。将功能性3-二乙基氨基丙基异硫氰酸酯(DEAP)分子与抗肿瘤短肽C16Y缀合[21],得到的DEAP-C16Y肽能在生理条件下自组装成球形纳米结构并在肿瘤弱酸性条件下解离并释放单个肽分子,研究表明,这种DEAP-C16Y肽能够通过减少黏着斑激酶和PI3K-Akt途径杀伤肿瘤细胞、抑制血管内皮细胞迁移和小管形成。与游离C16Y相比,DEAP-C16Y纳米结构表现出优异的稳定性并显著降低乳腺癌原位模型中的微血管密度,值得一提的是,C16Y本身对HUVECs的存活率并没有影响,而DEAP-C16Y在抑制内皮细胞迁移、小管形成和肿瘤细胞侵袭方面均表现出显著优势,可见该递送体系的组装对于抗血管生成活性的发挥至关重要。
2.1.3 无机纳米粒 相比于多糖、蛋白等高分子材料,无机材料的相对分子质量低、稳定性较好且来源广泛。无论是用于抗血管生成活性组分的高效递送,还是发挥其本身的抗血管生成活性,都显示了其应用于抗血管生成治疗的潜力。表2列举了由无机材料构建得到的抗血管生成无机纳米粒,研究者们通过深入探究揭示了无机材料用于构建抗血管生成递药体系时各自发挥抗血管生成活性的具体机制。

表2 具有抗血管生成活性的无机纳米粒
由各类无机纳米粒的抗血管生成机制可以看出,纳米粒子不仅将治疗组分递送至目标部位与相应靶标分子发生作用,还能积极地参与并调节血管生成的分子过程,协同增强抗血管生成活性。以金纳米粒为例,其本身就能特异性结合并抑制VEGF165和b-FGF,调控肿瘤VEGF通路的异常激活[24],进一步将槲皮素(Qu)与金纳米粒复合得到的AuNPs-Qu-5整合了Qu对于EGFR/PI3K/Akt通路介导的上皮-间质转化的抑制作用[27],增强抗血管生成活性的同时也改善了Qu的溶解性。这些无机材料种类丰富且理化性质各异,大多具有高比表面积和丰富的表面官能团[28],易于功能化,为分子水平的抗血管生成治疗提供了新思路。
2.2 间接提高抗血管生成疗效的纳米递药系统
不同于直接在微观分子机制层面发挥作用的直接抗血管生成纳米递送系统,间接提高抗血管生成治疗的纳米递药系统从宏观治疗层面出发,充分考虑抗血管生成治疗在实际运用时所面临的生理、病理环境,借助纳米递送体系的设计解决一些问题。以提高治疗选择性为例,尽管EPR效应赋予了特定纳米尺度的递送体系被动靶向特性,但单纯依赖EPR效应不足以发挥理想的靶向作用,基于不同抗血管生成机制的活性组分需特异性作用于相应受体才能充分发挥疗效。通过纳米递送体系的修饰可以灵活整合靶向配体,提高抗血管生成治疗的选择性。
2.2.1 靶向血管 肿瘤细胞的异质性和变异性使其可通过一系列代偿通路对肿瘤治疗模式,尤其是单一治疗模式产生抗性。相比之下,血管内皮细胞基因组相对稳定,且血液循环中的纳米粒在到达肿瘤部位之前首先接触内皮细胞并被其内吞。因此,内皮细胞是一个有前景的肿瘤治疗靶点。1993年,研究人员比较了作用于不同靶标的两种免疫毒素的体内抗肿瘤作用[29]——一种针对肿瘤血管内皮细胞,另一种针对肿瘤细胞本身。两种免疫毒素的体外活性相当,但是体内实验显示100 μg肿瘤特异性免疫毒素对大的实体肿瘤几乎无效,而少至40 μg的抗肿瘤血管内皮免疫毒素就能导致肿瘤血管完全闭塞和肿瘤的显著消退,据此首度提出了肿瘤血管靶向的概念。后续实验进一步证明了该策略与直接肿瘤靶向的策略相辅相成——两种治疗手段的联用实现了优势互补,大大提高了抗肿瘤疗效。
这种靶向血管的治疗策略已被用于构建纳米递送系统。有研究者在金纳米粒表面修饰RGD靶向配体和近红外染料AF647,RGD的修饰使其能够特异性靶向肿瘤血管内皮细胞高表达的αvβ3受体,在成像分子AF647的指导下对肿瘤施加两束正交的准直辐射进行放疗,实现了良好的肿瘤辐射覆盖,超过80%的肿瘤区域接受到不少于10 Gy(1 Gy=1 J/kg)的辐射剂量,且正常组织基本不受影响(<5%)[30]。该体系巧妙运用了血管靶向策略并且整合了成像分子,联合图像引导的放射治疗能够特异性放大对肿瘤新生血管的杀伤,干扰肿瘤生长的同时降低对于正常细胞的损伤。将乙烯基叠氮化物(VA)包封于c(RGDfE)肽修饰的空心硫化铜(HCuS)纳米粒制造出一种新型“纳米炸弹”RGD@HCuS(VA),能够在高分辨率光声血管造影技术的辅助之下以准确、迅速的方式有效破坏肿瘤新生血管[31]。该体系特异性靶向血管并显著增强肿瘤新生血管的光声信号,在NIR照射后,局部温度的升高触发VA快速释放氮气(N2)气泡,这些N2气泡的爆破能够破坏新生血管同时诱导周围肿瘤细胞的坏死。单次注射RGD@HCuS(VA)配合激光照射就能使肿瘤完全消退,且30 d内无再生,而非靶向HCuS(VA)配合激光照射组的肿瘤虽然在最初的5 d内有所减小,但在之后的第39天内再生,说明了在该治疗手段中肿瘤血管靶向功能的重要性,该功能正是通过纳米递送系统的设计得以实现。
2.2.2 调节肿瘤氧供及微环境 肿瘤血管为肿瘤提供氧气、营养,针对已有肿瘤血管,抗血管生成的策略之一是“饥饿疗法”,通过切断营养和氧气的供应遏制肿瘤生长。有研究报道了一种可注射聚乙烯吡咯烷酮(PVP)修饰的硅化镁(Mg2Si)纳米粒(MS NPs),能够产生脱氧效应,理论上1 mol的Mg2Si可以消耗2 mol O2,氧消耗效率高。该体系还能形成阻碍肿瘤毛细血管复氧的副产物——原位产生的SiO2聚集体,其通过堵塞肿瘤毛细血管维持肿瘤内缺氧状态[32]。一方面利用脱氧组分消耗氧气,另一方面利用载体本身的聚集效应切断氧气来源,使肿瘤血管和肿瘤本身受到双重打击。需要特别关注的是,这种利用缺氧的治疗策略需进行严格的给药控制,因为长期的肿瘤乏氧容易激活某些信号通路(例如HIF-1α途径),筛选出更加恶性的、能够耐受乏氧环境的肿瘤细胞,诱发转移。针对该问题,研究者构建了多功能pH敏感脂质递药系统,其能够与HIF-1α siRNA静电复合,有效沉默HIF-1α,缓解由过度缺氧导致的转移侵袭性增强和细胞凋亡抵抗[33]。
除了氧供,通过调控肿瘤微环境改善抗血管生成治疗还可以着眼于间质细胞(例如肿瘤相关成纤维细胞TAF等)和细胞外基质成分(例如胶原、基质金属蛋白酶MMP等)。例如,TAF能够通过TGF-β介导的VEGF-A激活血管生成,还能抑制抗肿瘤T细胞干扰肿瘤免疫。Miao等[34]利用脂质纳米递送系统将编码TNF的质粒递送至TAF,3次给药就使70%的TAF凋亡并使常驻TAF恢复到静止状态,除遏制TAF导致的血管生成异常激活,这种TAF的消耗和重塑还有利于化疗药物的进一步递送,使得包载顺铂的纳米粒在单次注射后24 h内的浓度增加约2倍。MMP能降解细胞外基质并重构血管基底膜,释放血管生成调节因子,为肿瘤细胞和血管的生长提供空间,因此消耗肿瘤微环境中的MMP能间接抑制血管生成。除发挥抗血管生成活性,体系中的MMP敏感组分(例如MMP敏感肽GPLGIAG、MMP-2底物明胶)能够进一步产生肿瘤微环境响应,通过自身尺寸变化、电荷翻转等增强肿瘤对纳米粒的摄取。Ruan等[35]设计的尺寸可缩型明胶-金纳米粒先以较大尺寸(188.2 nm)滞留于肿瘤部位,待MMP-2消化明胶后释放较小尺寸(55.9 nm)的金纳米粒,有利于肿瘤深部递送。
2.2.3 增强肿瘤免疫 免疫疗法已成为继手术、化疗和放疗之后的第4种肿瘤治疗手段,并展现出良好的应用前景。免疫调节作用的发挥离不开良好的血管环境支持,异常血管生成与肿瘤免疫抑制之间的关系如图2所示。由于肿瘤微环境中高间质液压(IFP)的压迫,新生血管薄且细长,不利于血管内容物的渗透。适当的抗血管生成治疗可显著降低IFP,增强淋巴细胞和/或纳米粒向肿瘤的浸润,而激活的免疫细胞能够释放IFN Ⅰ和Ⅱ减少肿瘤血管,反馈性发挥抗血管生成作用,体现了抗血管生成治疗和免疫治疗的相互促进。
将低剂量的酪氨酸激酶抑制剂舒尼替尼以聚合物胶束形式(SUNb-PM)靶向递送至肿瘤,能使原本对于晚期肿瘤束手无策的肿瘤疫苗发挥积极作用[36]。使用舒尼替尼之后免疫应答向细胞免疫途径极化,细胞因子表型从Th2型转变为Th1型,同时重塑肿瘤相关成纤维细胞、胶原蛋白和肿瘤血管,进而增强淋巴细胞和/或纳米颗粒向肿瘤的浸润,产生正反馈效应,这种效应在纳米粒组中更加明显(纳米粒组剂量仅为口服组剂量的1/3)。且该纳米递送系统本身就能增强CD8+T细胞浸润,其效果与疫苗相当,而口服舒尼替尼无此增强效应。纳米粒还能提供启动MHC Ⅰ限制性CD8+CTL所需的调节信号,联用疫苗之后,抗原特异性CTL的杀伤效率得到提高。此外还有特异性靶向各类免疫细胞(如肿瘤相关巨噬细胞、调节性T细胞)、免疫调节分子(如白介素)的策略。Y形肽修饰的纳米管递送体系特异性靶向M2极化TAM,通过抑制其分泌促血管生成因子VEGF、PDGF和免疫调节因子IL-17间接发挥抗肿瘤血管生成作用[37]。这些递送系统不仅发掘了纳米递送体系作为免疫佐剂的策略,还着眼于免疫微环境和血管微环境的协调,将抗血管生成治疗推向了更加适度、多元的方向。

图2 异常血管生成与肿瘤免疫抑制之间的关系
2.2.4 表观遗传层面修饰 随着分子生物学理论和基因编辑技术的发展,对于肿瘤发生、发展以及药物作用机制的研究已经深入到分子层面,基因治疗的策略已经应用于临床。各类siRNA、miRNA能够通过靶向TAFs和内皮细胞等基质细胞成分调节肿瘤血管生成,从而影响肿瘤细胞的增殖,侵袭和转移。纳米递送系统的构建对实现分子水平的精准调控贡献了不可忽视的力量。
TWIST1是一种具有“螺旋-环-螺旋”结构的转录因子,可通过募集TAM诱导血管生成,且该诱导作用不依赖于VEGF途径。针对这一靶点,用聚乙烯亚胺(PEI)涂覆的介孔二氧化硅纳米颗粒(MSN)递送siRNA特异性沉默TWIST1靶基因,实现了表观遗传层面的调控[38]。负责巨噬细胞募集的重要因子是C-C基序趋化因子配体2(CCL2),其能够直接导致巨噬细胞流入肿瘤,产生免疫抑制和血管生成,TWIST1能够增强CCL2的表达,因此抑制TWIST1能够间接减少血管生成,降低肿瘤负荷。此外,减少TWIST1还能降低促血管生成因子IL-8的表达,进一步抑制血管生成。在该纳米递送系统中,带负电荷的siRNA分子与阳离子PEI涂覆的MSN静电复合,其中PEI不仅实现了siRNA的有效荷载,还能通过质子海绵效应促进siRNA的内体逃逸。异种移植模型体内实验显示,每周静注给药能够有效下调CCL2并显著降低肿瘤负荷(P<0.05),其间TWIST1激活IL-8和CCL2驱动血管生成的过程被有效阻断,该药效的发挥离不开TWIST1 siRNA的高效递送。这种利用PEI有效荷载siRNA的策略还被应用于血管生成相关靶点的研究,研究者利用肿瘤响应型纳米粒递送NgBR siRNA[39],其肿瘤血管正常化和转移抑制作用证明NgBR是异常肿瘤血管和侵袭性肿瘤的潜在治疗靶点,为抗血管生成治疗提供了新的思路。
3 总结与展望
伴随着抗血管生成理论的深入发展,一些新的治疗思路正通过纳米递送体系的设计得以实现,如节拍化疗(metronomic chemotherapy)[40]、血管正常化(vascular normalization)[41]策略等。除了治疗理论的发展,纳米递送体系的研究也不断创新,源于生物灵感(bio-inspired)的递送设计、细胞膜载体等策略已经显示出优于常规递送系统的优势。将天然存在的生物学功能融入递药系统的设计,根据血管生成相关内皮细胞、成纤维细胞、周质细胞各自的特点及其所处环境构建体系,有望提高抗血管生成的疗效。
从临床实践上看,抗血管生成治疗仍然存在不可避免的局限性,使用不当会影响肿瘤血管的渗透效应,导致药物递送效率下降;还会驱动缺氧诱导因子-1α(HIF-1α)在肿瘤部位的积聚,加剧肿瘤侵袭性,诱发耐药[42];此外还存在固有毒性,使用不当将会破坏血管生成调控因子的平衡,干扰正常的生理过程。因此,用药剂量、组合方式等方案必须慎重制定并严格控制。鉴于这样的要求和挑战,能够持续高效发挥抗血管生成治疗作用的递药系统成为研究的热点,纳米技术无疑为其赋予了强大的生命力。相信随着生物学机制研究和纳米技术的不断进步,抗血管生成治疗将会展现出更广阔的前景。
