H9N2亚型禽流感病毒HA检测片段阳性质粒的构建
2019-03-07刘宇卓刘青涛赵冬敏章丽娇黄欣梅韩凯凯
杨 婧,刘宇卓,刘青涛,赵冬敏,章丽娇,黄欣梅,韩凯凯,李 银
(江苏省农业科学院 兽医研究所/农业部 兽用生物制品工程技术重点实验室,江苏 南京 210014)
禽流感(Avian Influenza, AI)是由正黏病毒科(Orthomyxoviridae)A型流感病毒属A型流感病毒中任一亚型引起的家禽、野鸟和部分哺乳动物发病的一种传染病[1-2]。高致病性禽流感会引起家禽高发病率及高死亡率,而低致病性禽流感则会导致家禽出现呼吸道症状、生长发育受阻及产蛋下降等,严重危害养禽业的健康发展[3]。根据A型流感病毒表面糖蛋白血凝素蛋白(Hemagglutinin, HA)和神经氨基酸酶(Neuraminidase, NA)的抗原性不同,可将A型流感病毒分为不同的亚型,目前已发现有18种HA亚型和11种NA亚型,其中H17N10和H18N11仅在蝙蝠中分离鉴定[4-5]。根据致病性不同,又可将禽流感分为高致病性禽流感、低致病性禽流感和无致病性禽流感[6]。由H5和H7亚型毒株所引起的禽流感一般称为高致病性禽流感(HPAI),其发病率和病死率都很高,危害极大[7-8],被OIE列为必须报告的动物传染病,我国将其列为一类传染病。而禽类中暴发的低致病性禽流感的亚型主要为H5N2、H9N2亚型。
H9N2亚型禽流感病毒呈世界性分布,按地区可分为北美和欧亚两个种系[9];我国分离的毒株多为欧亚种系,而A/Chicken/Heilongjiang/35/00则为北美种系[10]。我国于1994年首次从鸡体内分离出H9N2亚型禽流感病毒[11]。近些年我国每年均可分离到大量的H9亚型禽流感病毒,在临床上被感染的鸡常见蛋鸡产蛋量下降、肉鸡生长发育迟缓甚至死亡的现象;当其与其它病原共感染时会导致高死亡率,给我国养禽业造成了巨大的经济损失。同时H9亚型AIV可以感染人、猪等哺乳动物,因此对其进行研究在公共卫生上具有重要意义[12]。
实验室在进行H9N2亚型禽流感病毒检测时,一般先用血凝/血凝抑制试验进行初筛,再用PCR方法进行确诊。在进行PCR试验时,需要已知的H9N2病毒作为阳性参考,而有活性的H9N2病毒存在感染人类及散播病毒的危险,灭活的H9N2病毒又有保存条件的限制,普通的实验室不具备长期保存的资质,因此,需要构建一个可以用于检测H9N2亚型禽流感病毒HA片段的阳性质粒,要求该质粒在-20 ℃即可保存,使用方便,不会污染环境,不存在散播病毒的危险。我们按照农业部的NYT 772─2013标准,构建了487 bp长的HA检测片段阳性质粒,并对该质粒的特异性、敏感性和重复性进行了分析,以期获得可用于检测H9N2亚型禽流感病毒HA片段的阳性质粒。
1 试验材料
H9N2亚型禽流感病毒A/Chicken/Jiangsu/WX5/2017由江苏省农业科学院兽医研究所家禽与生物兽药研究室家禽重大疫病防控项目组分离鉴定并保存。
PMD18-T、PMD20-T、反转录酶(M-MLV)、RNase Out、10 mmol/L dNTP、5×Buffer、10× PCR Buffer、2.5 mmol/L dNTP、25 mmol/L MgCl2、聚合酶(E×Taq)均购自宝生物工程(大连)有限公司;E.coliDH5α感受态细胞购自宝生物工程(大连)有限公司和南京诺维赞生物科技有限公司;0.22 μm微孔滤膜过滤器购自Millipore lreland Ltd.;生理盐水(pH 6.8~7.0)、LB固体培养基、LB液体培养基由本实验室自制;1%鸡红细胞溶液由本实验室自制,现用现配;琼脂糖(BIOWEST AGAROSE G-10)购自Gene Company LTD公司; DL2000 DNA Marker购自DSBIO生物公司;氨苄青霉素、核酸染料购自上海蒲迪生物公司; RNA/DNA提取试剂盒、胶回收试剂盒、质粒提取试剂盒均购自康宁生命科学有限公司;行标特异引物由南京金斯瑞生物科技有限公司提供,阳性质粒的测序也由该公司完成。
本试验所用的仪器设备还有:超高速低温离心机(Eppendorf)、水浴锅(一恒科技)、Gradient PCR(Takala)、核酸凝胶电泳系统(南大普阳)、核酸凝胶成像系统(JS-680B)、37 ℃恒温培养箱(上海光都)、37 ℃摇床(华美生化)、高压锅(徐州圣业SY-450)。
2 试验方法
2.1 H9N2病毒RNA的提取
将A/Chicken/Jiangsu/WX5/2017样品在无菌条件下取出200 μL,置于高压灭菌后的1.5 mL离心管中,加入200 μL的V-L试剂后,用涡旋振荡仪混匀,静置5 min;加入75 μL V-N试剂,用涡旋振荡仪混匀,以12000 g的转速离心5 min;取上清加在新的2 mL离心管中,再加入300 μL异丙醇(含无水乙醇),上下倒置混匀,转移至新的含有吸附柱的2 mL离心管中,以6000 g离心1 min;弃滤液,加入500 μL Buffer W1(含无水乙醇),以12000 g离心1 min;弃滤液,加入800 μL Buffer W2(含无水乙醇),以12000 g离心1 min;弃滤液,以12000 g离心1 min;将吸附柱置于新的1.5 mL离心管中,加入15 μL的TE试剂,静置1 min,然后以12000 g离心1 min。此即为提取的H9N2亚型禽流感病毒RNA。
2.2 病毒RNA的反转录RT和PCR扩增
反转录体系为: RNA 12 μL、10 mmol/L dNTP 2 μL、5×Buffer 4 μL、Unit 12 1 μL、M-MLV 1 μL、RNase Out 0.5 μL。反转录程序为:65 ℃ 5 min→42 ℃ 60 min→98 ℃ 5 min。
PCR扩增体系为: cDNA 2.75 μL、2.5 mmol/L dNTP 2 μL、10×Buffer 2.5 μL、ddH2O 14 μL、25 mmol/L MgCl21.5 μL、E×Taq 0.25 μL、上游引物P1(5′-CTCCACACAGAGCAYAATGG-3′) 1 μL、下游引物P2 (5′-GYACACTTGTTGTTGTRTC-3′) 1 μL。PCR扩增程序为:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 40 s,72 ℃ 40 s,共35个循环;72 ℃ 10 min。
2.3 电泳和核酸胶纯化
配制1%琼脂糖凝胶,进行电泳。调节电泳仪为稳压模式,在80 V下电泳30 min。将阳性条带切下后,用胶回收试剂盒纯化阳性条带。
在紫外灯下切下含有目的DNA的琼脂糖凝胶,称重后作为1个凝胶体积,加入3个凝胶体积的Buffer DE-A,混合均匀后于75 ℃加热,每2~3 min混合1次,直至凝胶块被完全熔化;加入0.5个Buffer DE-A体积的Buffer DE-B,混合均匀;将此混合液转移到DNA制备管(置于2 mL离心管)中,以12000 g离心1 min,弃滤液;将制备管置回2 mL离心管中,加入500 μL Buffer W1(含无水乙醇),以12000 g离心30 s,弃滤液;将制备管置回2 mL离心管中,加入700 μL Buffer W2(含无水乙醇),以12000 g离心30 s,弃滤液;再加入700 μL Buffer W2(含无水乙醇),以12000 g离心1 min,弃滤液;将制备管置回2 mL离心管中,以12000 g离心1 min;将制备管置于洁净的1.5 mL离心管中,在制备膜中央加25 μL ddH2O,在室温下静置1 min,以12000 g离心1 min洗脱DNA。
2.4 HA检测片段阳性质粒的构建和筛选
将胶回收的目的基因按照连接体系(10 μL): DNA 4 μL、pMD18-T Vector 1 μL、SolutionⅠ5 μL,在4 ℃下过夜连接,构建HA检测片段克隆载体。
从-70 ℃处取出E.coliDH5α感受态细胞,于手心迅速融化,然后置于冰上融化15 min,将10 μL连接产物加入感受态细胞中,并轻柔吹打混合均匀,立即冰浴30 min;然后迅速放入42 ℃水浴锅中,热激90 s,再立即冰浴5 min;结束后,每管内加入900 μL SOC培养基,置于37 ℃恒温摇床,以120 g低速培养1 h,然后以4800 g离心5 min,吸取上清900 μL,在剩余培养基中将菌块吹散均匀,并加入20 μL IPTG和40 μL X-Gal,混合均匀后,将菌液吸取滴加到含氨苄青霉素的LB固体培养基中,用灼烧过的无菌玻璃棒将菌液涂布均匀;进行标记,置于37 ℃恒温培养箱中过夜培养12~16 h。
将37 ℃恒温培养过夜的LB固体培养基取出,用白枪头挑取透明单菌落,每块板子挑取7~10个单菌落,置于2 mL含0.1%氨苄青霉素的液体培养基中,在37 ℃恒温摇床上以180 g培养10~12 h。对培养后的菌液进行PCR鉴定;电泳结束后在凝胶成像系统中观察是否有阳性条带,如有,则取500 μL菌液送金斯瑞(南京)生物科技有限公司进行测序,测序完成后用DNAStar进行序列分析。经软件比对后,将序列正确的菌液按1%扩大培养,在37 ℃恒温摇床上以180 g培养12~16 h后进行质粒提取。
质粒提取方法如下:取1~4 mL在LB培养基中培养过夜的菌液,以12000 g离心1 min,弃上清;加入250 μL Buffer S1(已加RNase A),充分悬浮细菌沉淀,确保菌液中无小菌块;加入250 μL Buffer S2,上下轻柔翻转4~6次以混合均匀,使菌体充分裂解形成透亮均一的溶液,此步骤不超过5 min;加入350 μL Buffer S3,上下轻柔翻转4~6次以混合均匀、充分,再以12000 g离心10 min;吸取上清,转移到DNA制备管中,以12000 g离心1 min,弃滤液;加500 μL Buffer W1,以12000 g离心1 min,弃滤液;加700 μL Buffer W2(含无水乙醇),以12000 g离心1 min,弃滤液;再次用700 μL Buffer W2(含无水乙醇)洗涤1次,以12000 g离心1 min,弃滤液;将制备管置回到2 mL EP管中,以12000 g离心1 min;将制备管置于洁净的1.5 mL EP管中,在制备管膜中央加60~80 μL Eluent或去离子水,在室温下静置1 min,然后以12000 g离心1 min,充分洗脱质粒;将质粒DNA保存于-20 ℃。
2.5 HA检测片段阳性质粒的特异性鉴定
以H5禽流感病毒(H5)、H7禽流感病毒(H7)、H9禽流感病毒(H9)、传染性法氏囊病毒(IBDV)、新城疫病毒(NDV)、鸡传染性支气管炎病毒(IBV)特异性引物同时对HA检测片段质粒进行PCR扩增,检验其特异性,对扩增后的PCR产物采用琼脂糖凝胶电泳进行鉴定。
2.6 HA检测片段阳性质粒的敏感性鉴定
用双蒸水对HA检测片段质粒进行10倍系列稀释,得到10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9、10-10倍稀释液,分别用H9行标特异引物进行PCR扩增,检验其敏感性;对扩增后的PCR产物采用琼脂糖凝胶电泳进行鉴定。
2.7 HA检测片段阳性质粒的重复性鉴定
用双蒸水将HA检测片段质粒作100倍系列稀释,用H9行标特异引物进行PCR扩增,做6个重复,检验其重复性;对扩增后的PCR产物采用琼脂糖凝胶电泳进行鉴定。
3 结果与分析
3.1 H9N2病毒的RT-PCR
由电泳图1可知, A/Chicken/Jiangsu/WX5/2017在行标特异引物扩增下可得到487 bp长度的HA片段。

1:阴性对照;2: ddH2O;3: A/Chicken/Jiangsu/WX5/2017;4: A/Chicken/Jiangsu/WX5/2017;M:2000 bp Marker。
3.2 HA检测片段阳性质粒的测序鉴定
对含HA检测片段的阳性菌液用行标特异引物进行PCR扩增后,在1%琼脂糖凝胶上进行电泳,将阳性条带的菌液进行测序,得到其序列(见图2);经在线BLAST分析,其仍为H9N2禽流感病毒,且与原病毒的同源性达100%(图3)。

图2 HA检测片段阳性菌液的测序结果
3.3 HA检测片段阳性质粒的特异性鉴定
以H5、H7、H9、IBDV、NDV、IBV特异性引物同时对HA检测片段阳性质粒进行PCR扩增,以检验其特异性,对扩增后的PCR产物采用琼脂糖凝胶电泳进行鉴定,结果如图4所示,仅用H9特异性引物扩增时出现阳性条带,而用其余引物扩增时均未出现阳性条带。

图3 HA检测片段阳性菌液与原病毒HA片段的同源性比较
3.4 HA检测片段阳性质粒的敏感性鉴定
用双蒸水将HA检测片段阳性质粒作10倍系列稀释,用H9行标特异引物进行PCR扩增,检验其敏感性;对扩增后的PCR产物采用琼脂糖凝胶电泳进行鉴定,结果如图5所示,对10-1、10-2、10-3、10-4倍稀释液进行扩增时,均出现了阳性条带。
3.5 HA检测片段阳性质粒的重复性鉴定
用双蒸水将HA检测片段阳性质粒作100倍系列稀释,用H9行标特异引物进行PCR扩增,做6个重复,检验其重复性;对扩增后的PCR产物采用琼脂糖凝胶电泳进行鉴定,结果如图6所示,6个重复均出现了阳性条带。

1: H5特异性引物扩增;2: H7特异性引物扩增;3: H9特异性引物扩增;4: IBDV特异性引物扩增;5: NDV特异性引物扩增;6: IBV特异性引物扩增;7:2000 bp Marker。
图4HA检测片段阳性质粒特异性鉴定结果
4 讨论
在本研究中,参考农业部NYT 772─2013标准设计的H9特异引物可以扩增出487 bp大小的条带,该SOP适用于规范H9亚型禽流感RT-PCR检测方法的操作,是检测H9亚型禽流感的金标准;根据此标准构建相应的检测H9N2亚型禽流感病毒HA片段的阳性质粒,通过对阳性菌液测序、NCBI在线BLAST分析、与原病毒HA片段进行同源性比较等鉴定,确认该阳性质粒构建成功。同时,对该阳性质粒的特异性、敏感性和重复性进行分析后,可以证明该HA片段的阳性质粒特异性较高,敏感性能达到10-4倍稀释,重复性较稳定,是可用于检测H9N2亚型禽流感病毒HA片段的阳性质粒。
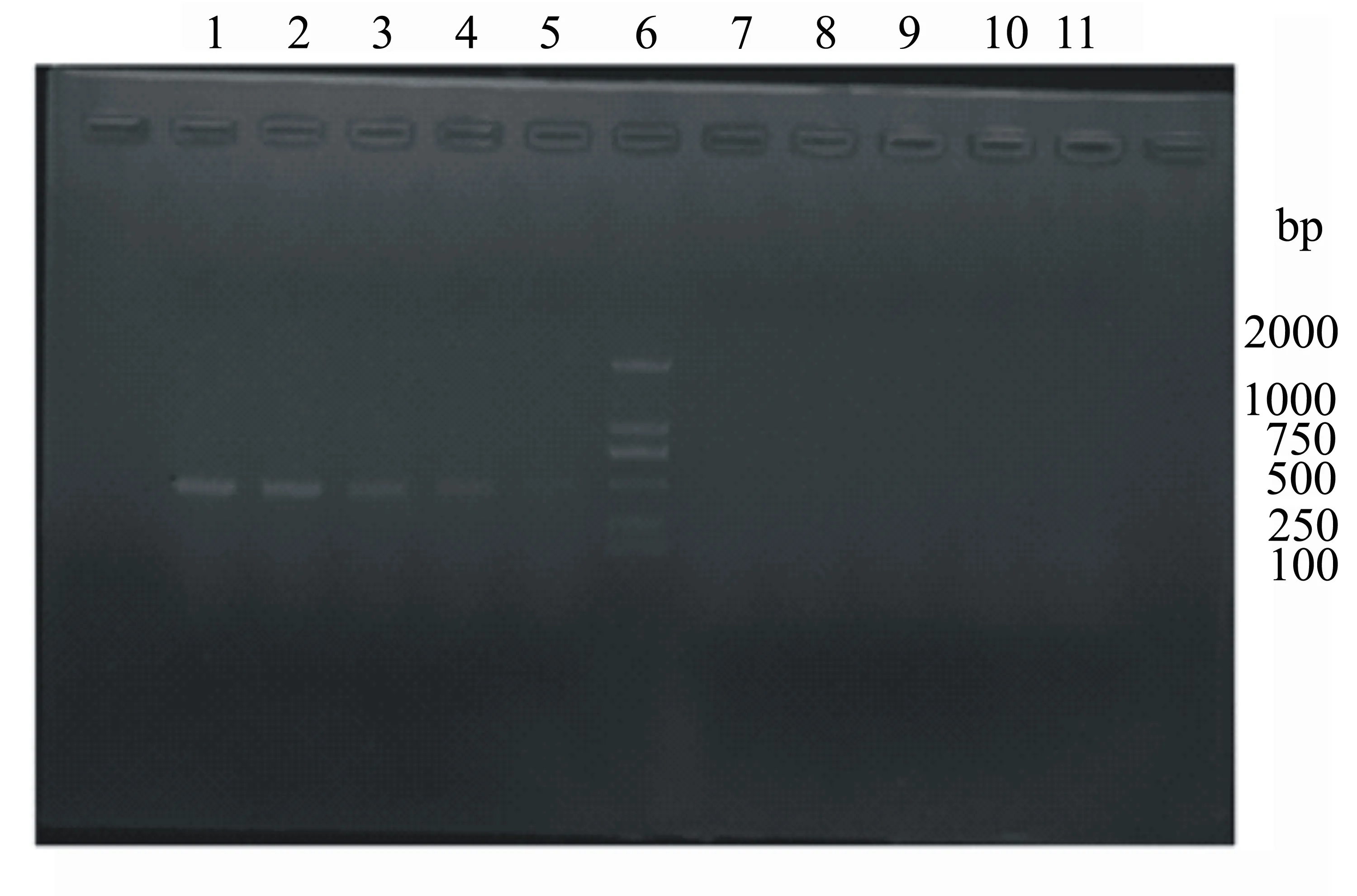
1:10-1倍稀释;2:10-2倍稀释;3:10-3倍稀释;4:10-4倍稀释;5:10-5倍稀释;6:2000 bp Marker;7:10-6倍稀释;8:10-7倍稀释;9:10-8倍稀释;10:10-9倍稀释;11:10-10倍稀释。
图5HA检测片段阳性质粒敏感性鉴定结果

1:重复1;2:重复2;3:重复3;4:重复4;5:重复5;6:重复6;7:2000 bp Marker。
禽流感的早期诊断对于控制疫情具有重要的意义。一般通过病禽的流行病学、临床症状、病理变化可做出禽流感的初步判断;但若需做出准确诊断,则需要检测禽流感病毒的抗原、基因或者分离鉴定病毒。目前对于禽流感的诊断主要通过检测禽流感抗原,其检测方法有[13]:血凝/血凝抑制试验(HA/HI)、抗原捕捉ELISA、荧光抗体和免疫酶组化法等。检测禽流感基因的方法主要有: RT-PCR法和标记核酸探针原位杂交法,以RT-PCR法较为敏感和特异,为WHO所推荐的方法之一。本试验成功构建了用于检测H9N2亚型禽流感病毒HA片段的阳性质粒,在-20 ℃下即可保存,使用方便,并且不会污染环境,不存在散播病毒的危险。
