盐胁迫下商洛丹参对外源钙的生理响应
2019-03-07华智锐李小玲
华智锐,李小玲
(商洛学院 生物医药与食品工程学院,陕西 商洛 726000)
土壤盐渍化是指土壤中含盐量高达0.3%以上,使作物生长缓慢或不能生长。在干旱地区,区域盐渍化问题日益严重,对区域农业发展构成了严重的威胁[1]。土壤盐渍化严重影响植物生长,降低药用植物的产量,因此研究药用植物的耐盐性是非常重要的。开发利用盐渍化土壤,推广种植耐盐高效的经济作物,将极大地改善当地的生态环境,提高经济效益。在植物耐盐害方面,学者们已做了大量的研究,研究结果表明:低浓度NaCl胁迫有利于植物种子萌发,植物幼苗还可以通过适度的盐胁迫诱导抗逆性以减轻盐胁迫引起的伤害;但是随着NaCl胁迫浓度的增加,植物幼苗耐盐能力明显下降[2-3]。
钙被称为“植物代谢和发育的主要调节者”,主要存在于叶片或老的器官和组织中,它是一个相对流动的元素。钙可作为生物膜中磷脂酰胆碱和蛋白质羧基之间的桥梁,从而维持质膜的完整性,降低细胞膜在盐胁迫下的渗透性,增加逆境中脯氨酸的含量。细胞质基质中的钙与可溶性钙调素(calmodulin, CaM)结合形成活性Ca2+·CaM复合物,作为代谢调控的“第二信使”[4]。钙可以缓解盐胁迫,在盐碱地的治理中具有很大的应用潜力,有助于盐碱地的开发利用[5]。
丹参(SalviamiltiorrhizaBunge)又称赤参、紫丹参、红根等,是唇形科多年生草本植物,在向阳的山坡、草丛、沟边、路旁或林边等地均能发现它,在全国广泛分布。该植物味苦,性微寒,入心,具有活血祛瘀、调经止痛、清热安神的作用。丹参作为丹参滴丸、丹参片和口服液等药物的主要成分,能在一定程度上缓解患病人群的病痛[6]。现代药理研究表明,丹参具有多种药理作用,如增加冠状动脉血流、降低心肌兴奋性和传导性、对心肌缺血性损伤产生保护作用[7]。近几年来,由于丹参的药理作用非常突出,丹参栽培已成为人们关注的焦点,但由于土地盐渍化问题越来越突出,严重影响丹参的产量提高与质量形成。如何使现有作物正常生长在盐渍化环境下并能获得一定的产量,这是科研工作者们亟须解决的问题。
国内外有关外源钙在盐胁迫条件下对植物生理特性影响的研究报道较多,例如刘丽等[8]研究发现外源钙能显著提高盐胁迫下菠菜的形态发生和可溶性蛋白质含量,从而降低盐胁迫对菠菜生长的伤害。脯氨酸是一种易在盐胁迫下积累的氨基酸,脯氨酸的积累有利于植物耐盐性的提高。但Chen等[9]的研究认为外源钙对盐胁迫下脯氨酸积累无明显影响。周双云等[10]研究了不同浓度CaCl2对盐胁迫下巴西蕉幼苗生理特性的影响,发现经CaCl2处理后巴西蕉幼苗和根系中的脯氨酸含量随着盐胁迫时间的延长而增加。此外,许多研究[11-14]表明,在盐胁迫逆境中外源钙能有效缓解农作物所受到的盐害。迄今有关施加外源钙对盐胁迫下药用植物丹参的影响研究尚未见报道。本试验通过喷施不同浓度的外源CaCl2来处理盐胁迫下的丹参盆栽植株,测定了其相关生理指标,探讨了能缓解丹参盐胁迫的最佳Ca2+浓度,以期提高丹参的抗胁迫能力,为解决丹参在盐胁迫条件下生长受抑、产量降低问题提供理论依据,也为丹参的抗性育种研究奠定理论基础。
1 材料与方法
1.1 试验材料与仪器
1.1.1 试验材料 供试丹参品种为“紫花丹参”,于2018年4月购于商洛市洛南县药材种植基地。配制盐溶液所用NaCl、CaCl2均为分析纯。
1.1.2 试验仪器 电子天平(FB323)、紫外可见分光光度计(UV755B)、冷冻离心机(KH30R-Ⅱ)、电热恒温水浴锅(XMTD-8000)、电热鼓风干燥箱(101型)。
1.2 试验方法
1.2.1 材料预培养 本试验采用盆栽处理,将所购买的一年生丹参幼苗移栽至直径50 cm左右的花盆中进行预培养,在户外自然光照、温度条件下培养1个月左右,期间定时浇水和松土以保持土壤湿润。1个月后选取生长一致的幼苗用于试验。
1.2.2 试验设计 试验共设2个对照和5个处理。对照: CK1,蒸馏水对照; CK2,100 mmol/L NaCl。处理: T1,10 mmol/L CaCl2+100 mmol/L NaCl; T2,20 mmol/L CaCl2+100 mmol/L NaCl; T3,30 mmol/L CaCl2+100 mmol/L NaCl; T4,40 mmol/L CaCl2+100 mmol/L NaCl; T5,50 mmol/L CaCl2+100 mmol/L NaCl。
将长势一致的丹参幼苗移栽至花盆(直径15 cm)中,每盆栽植3株,每个处理3个花盆,共计21盆,63株。在100 mmol/L NaCl胁迫条件下,采用叶面喷施方法,喷施不同浓度的CaCl2处理盆栽丹参幼苗植株,每株喷施5 mL,每2 d喷施1次, 6 d后采集叶片进行相关生理指标的测定。
1.2.3 测定指标及方法
1.2.3.1 丙二醛(MDA)含量的测定 MDA含量的测定参照张志良等[15]的方法采用硫代巴比妥酸(TBA)法。称取不同处理的丹参幼苗叶片1 g,将其剪碎,加入少量石英砂、2 mL 10%三氯乙酸(TCA)和8 mL TCA,充分研磨,将匀浆液于4 ℃以4000 r/min离心10 min;取上清液2 mL,加入2 mL 0.6% TBA液,于沸水浴上煮沸15 min,迅速冷却,离心;再取上清液分别于532 nm、450 nm波长下测定光密度,根据公式计算MDA含量。
1.2.3.2 CAT、POD活性的测定 CAT活性的测定参照李合生[16]的方法采用紫外吸收法。称取不同处理的丹参幼苗叶片0.5 g,加入2~3 mL在4 ℃下预冷、pH值为7.0的磷酸缓冲液和少量石英砂,研磨成匀浆后,在4 ℃下以4000 r/min离心15 min;取上清液0.2 mL,加入蒸馏水1.0 mL、0.2 mol/L磷酸缓冲液(pH 7.0)1.5 mL,逐管加入0.3 mL 0.1 mol/L的H2O2,在240 nm下测定吸光度,每隔1 min读数1次,共测定4 min,根据公式计算CAT的活性,以每分钟内A240减少0.1的酶量为1个酶活单位(U),计量单位为U/(g·min)。
POD活性的测定参照李合生[16]的方法采用愈创木酚法。称取不同处理的丹参幼苗叶片1 g,加适量磷酸缓冲液,研磨至匀浆后于4 ℃下以4000 r/min离心15 min;将上清液转移至100 mL容量瓶中,取3 mL愈创木酚反应液,加入1 mL酶液,立即计时,在470 nm下测定OD值,每隔30 s读数1次,共读6次,根据公式计算POD的活性,以每分钟OD值变化0.01为1个酶活性单位(U),计量单位为U/(g·min)。
1.2.3.3 可溶性糖、蛋白含量的测定 可溶性糖含量的测定参照李合生[16]的方法采用苯酚-硫酸法。称取不同处理的丹参幼苗叶片0.3 g,剪碎混匀,加入5~10 mL蒸馏水,在沸水中提取30 min,提取2次;将提取液过滤入25 mL容量瓶中,定容至刻度;吸0.5 mL样品液于试管中,加入1 mL 9%苯酚溶液,以5~20 s加入5 mL浓硫酸,摇匀,在485 nm波长下比色测定吸光度,以蔗糖为标准物作标准曲线并计算糖的含量,标准曲线为:Y=0.007X+0.142,R2=0.9991。
可溶性蛋白含量的测定参照李合生[16]的方法采用考马斯亮蓝法。称取不同处理的丹参幼苗叶片0.3 g,放入研钵中,添加少量石英砂和蒸馏水,研磨成匀浆后,转入10 mL容量瓶,定容至10 mL;取2~3 mL匀浆液于10 mL离心管中,于4 ℃下以5000 r/min离心10 min;吸取1 mL蛋白质提取液,加入考马斯亮蓝G-250试剂5 mL,充分混合,2 min后在595 nm下比色测定吸光度,以牛血清蛋白为标准物作标准曲线并计算出样品中蛋白质含量,标准曲线为:Y=0.0023X+0.0751,R2=0.992。
1.2.3.4 叶绿素含量的测定 参照赵世杰等[17]的方法采用丙酮-碳酸钙法。称取不同处理的丹参幼苗叶片0.5 g,放入研钵中,加纯丙酮5 mL、少许碳酸钙和石英砂,研磨成匀浆,再加80%丙酮5 mL,将匀浆转入离心管,离心后弃沉淀;将上清液用80%丙酮定容至20 mL,取提取液1 mL,加80%丙酮4 mL稀释后移入比色杯中,以80%丙酮为对照,分别测定663 nm、645 nm处的OD值,根据公式计算叶绿素的含量。
1.2.3.5 脯氨酸含量的测定 Pro含量的测定参照朱广联等[18]的方法采用茚三酮比色法。称取不同处理的丹参幼苗叶片0.5 g,分别置于大管中,然后向各管分别加入5 mL 3%的磺基水杨酸溶液,在沸水浴中提取10 min(提取过程中要经常摇动),冷却后过滤于干净的试管中,滤液即为脯氨酸的提取液;吸取2 mL提取液于另一干净的带玻塞试管中,加入2 mL冰醋酸及2 mL酸性茚三酮试剂,在沸水浴中加热30 min,溶液即呈红色;冷却后加入4 mL甲苯,摇荡30 s,静置片刻,取上层液至10 mL离心管中,于4 ℃以3000 r/min离心5 min;用吸管轻轻吸取上层脯氨酸红色甲苯溶液于比色杯中,以甲苯为空白对照,在分光光度计上520 nm波长处比色,根据标准曲线计算出样品中脯氨酸含量,标准曲线为:Y=0.116X+0.003,R2=0.995。
1.3 数据统计分析
对所有处理的叶片样品重复测定3次,结果为3次测定值的平均值。采用Excel 2010进行数据处理和绘图,采用SPSS 22.0软件对数据进行统计分析。采用单因素方差分析(one-way ANOVA)进行差异显著性检验。
2 结果与分析
2.1 外源钙对盐胁迫下丹参幼苗叶片丙二醛含量的影响
在逆境中,膜脂过氧化发生在植物细胞的细胞膜中,MDA是膜脂过氧化的产物,因此MDA含量经常被用来指示植物对不利条件的反应强度。如图1所示,在单盐处理下(CK2),丹参幼苗的MDA含量显著提高,表明丹参幼苗的细胞受到了氧化胁迫毒害,细胞结构的完整性和功能稳定性遭到破坏。在盐胁迫处理下,随着CaCl2浓度的增加,丹参叶片中的MDA含量整体呈先降后升的趋势,在T3时达到最低水平,但与对照CK1相比上升36.5%,有显著性差异(P<0.05);与对照CK2相比下降36.4%。表明盐胁迫会抑制丹参植株的生长,而施加外源钙能有效缓解盐胁迫的毒害,并且以施加30 mmol/L外源钙处理的效果最佳。
2.2 外源钙对盐胁迫下丹参幼苗叶片CAT、POD活性的影响
如图2所示,随着外源钙浓度的增大,CAT(过氧化氢酶)的活性先升高后降低,趋势明显。各处理之间CAT活性差异显著,在单盐处理下(CK2时),与对照组CK1相比,CAT活性增加了42%。CAT活性在T3时达到峰值,与两个对照组相比分别增加了134%和65%。

数据值为平均值±标准误(n=3)。不同小写字母表示不同处理间差异显著(P<0.05)。下同。
图1外源钙对盐胁迫下丹参幼苗叶片丙二醛含量的影响
POD活性的变化趋势(如图3)与CAT的相似,但CK2的POD活性与T1相比差异不显著(P>0.05),T2~T5的POD活性与CK2相比均显著增加,且在T3时达到最大值,与CK1、CK2对照组相比,分别增加了187%、130%。当外源钙浓度增加到一定程度(T4~T5时)POD活性有所下降,但仍高于CK2。
由以上结果可知,用不同浓度的外源钙处理丹参幼苗能明显提高幼苗叶片中CAT、POD的活性。
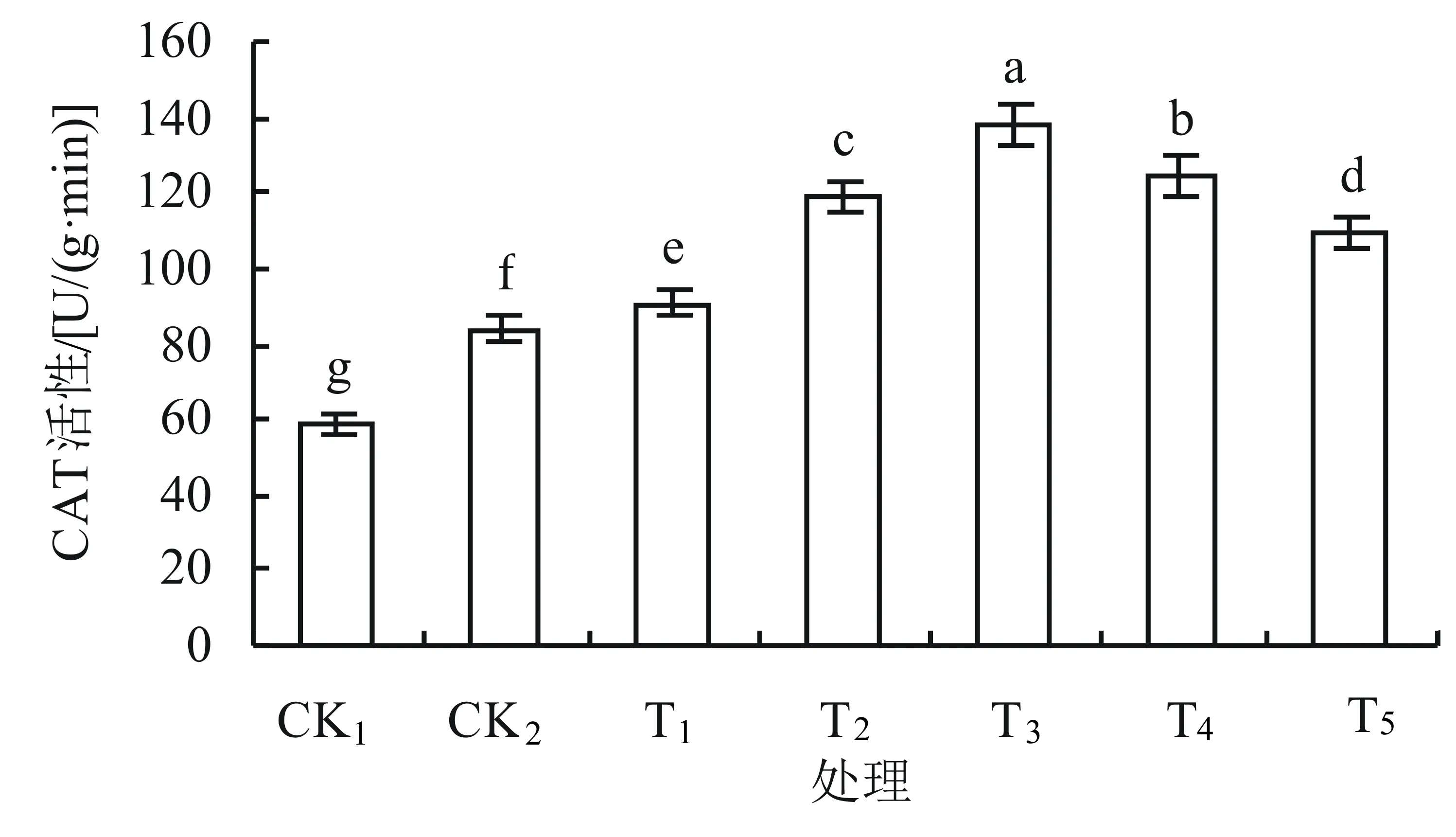
图2 外源钙对盐胁迫下丹参幼苗叶片CAT活性的影响
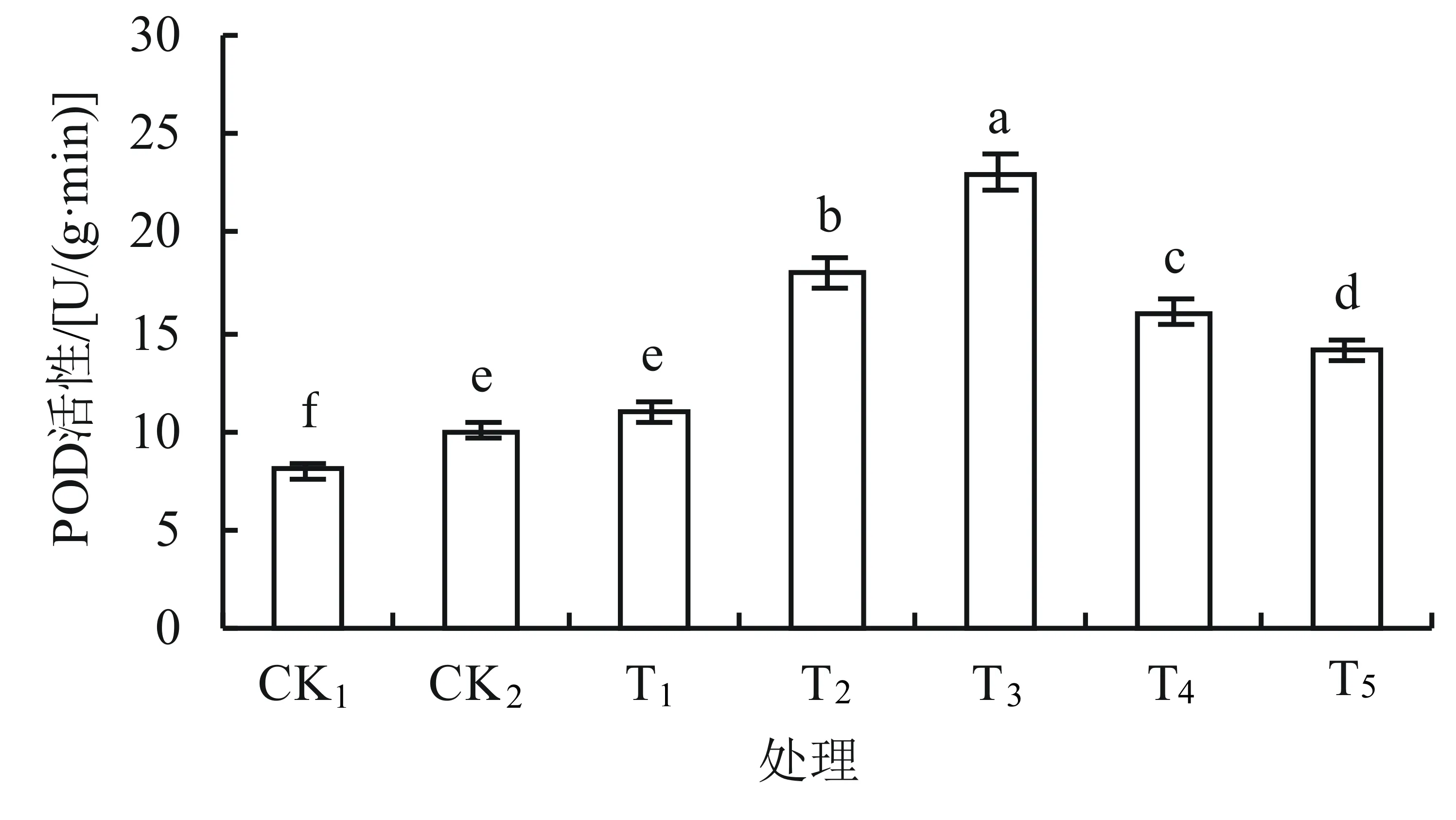
图3 外源钙对盐胁迫下丹参幼苗叶片POD活性的影响
2.3 外源钙对盐胁迫下丹参幼苗叶片可溶性糖、蛋白含量的影响
由图4可知:CK2与CK1相比,可溶性糖含量显著增加;随着CaCl2浓度的增加,丹参幼苗叶片可溶性糖含量呈先升后降的趋势,且在T3时可溶性糖含量最大,比CK1、 CK2两组对照分别增加了163%、98%;当CaCl2浓度增加到一定程度(处理T4~T5下)时,可溶性糖含量有所下降,但仍然显著高于CK1、 CK2的。因此,在盐胁迫下,植物可通过增加可溶性糖含量来维持细胞通透性平衡和细胞膜的稳定性。施用外源钙后,丹参盐害明显得到了缓解。
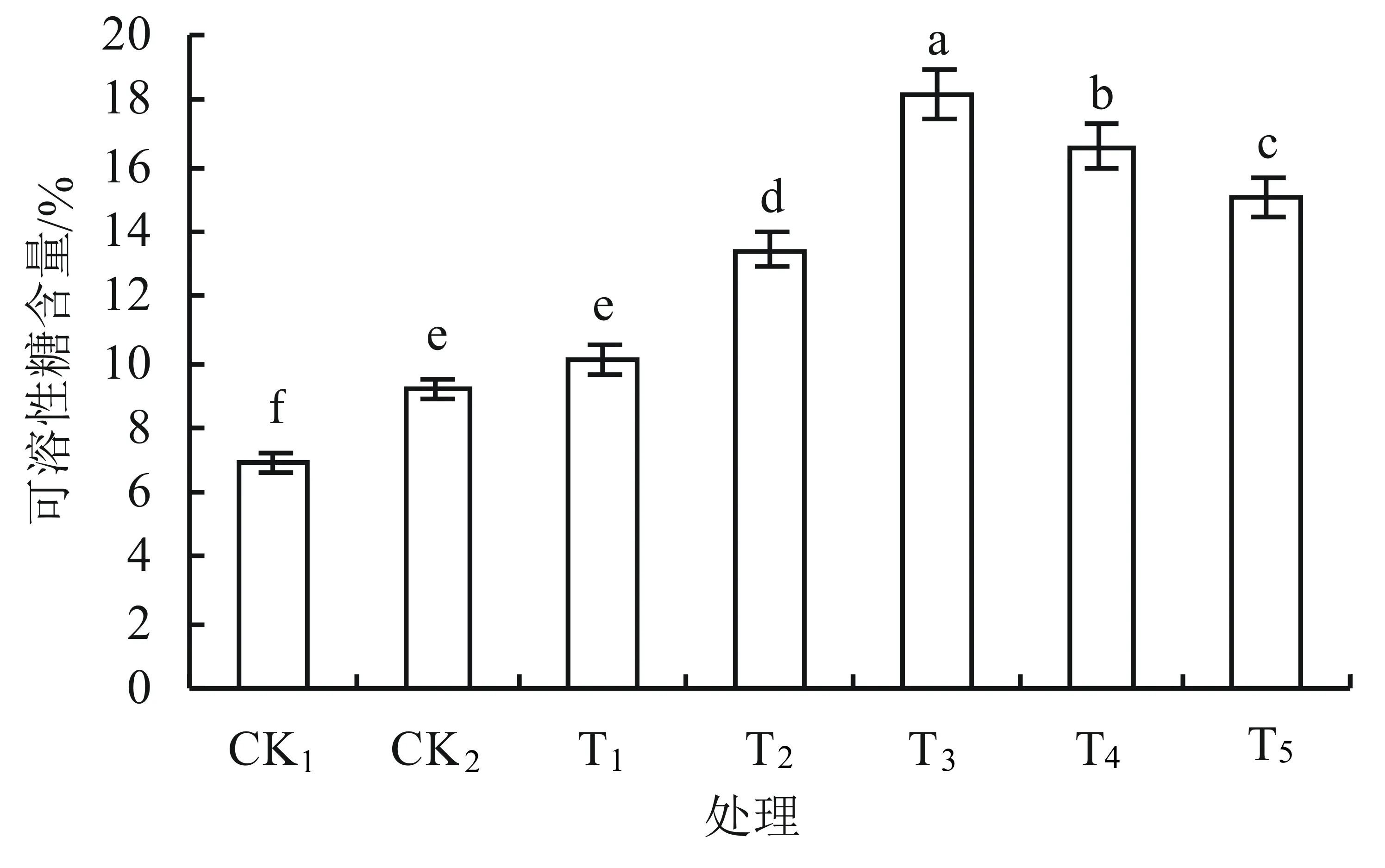
图4 外源钙对盐胁迫下丹参幼苗叶片可溶性糖含量的影响
如图5所示,同样作为渗透调节物质,丹参幼苗叶片中的可溶性蛋白含量的变化趋势与可溶性糖含量总体相似,但与可溶性糖含量不同的是,在较低的CaCl2浓度处理T1下,丹参的可溶性蛋白含量显著高于两个对照组的(P<0.05),且CK2与CK1相比,可溶性蛋白含量增加了87%;在T3时可溶性蛋白含量最高,比CK1、CK2两组对照分别增加了240%、82%。说明在盐胁迫下一定浓度的外源钙处理能显著提高可溶性蛋白的积累量,从而抵抗逆境胁迫。

图5 外源钙对盐胁迫下丹参幼苗叶片可溶性蛋白含量的影响
2.4 外源钙对盐胁迫下丹参幼苗叶片叶绿素含量的影响
植物叶片叶绿素含量不仅与植物的光合作用密切相关,而且是衡量植物耐盐性的主要生理指标之一。由图6可知:CK2与CK1相比较,丹参幼苗叶片的叶绿素含量显著降低,下降了65%;经不同浓度的CaCl2处理后,叶绿素含量呈现先升后降的趋势,CK2与T1相比无显著差异,但与其他处理相比差异显著,T2、T3、T4、T5处理分别较CK2增加了144%、164%、159%、128%;在T3时叶绿素含量增加到最大,但仍低于CK1。本试验结果表明,盐胁迫能明显降解叶绿素,外源钙能有效缓解盐胁迫对丹参幼苗叶绿素含量的影响,施用30 mmol/L CaCl2减轻了盐害,处理效果最佳。
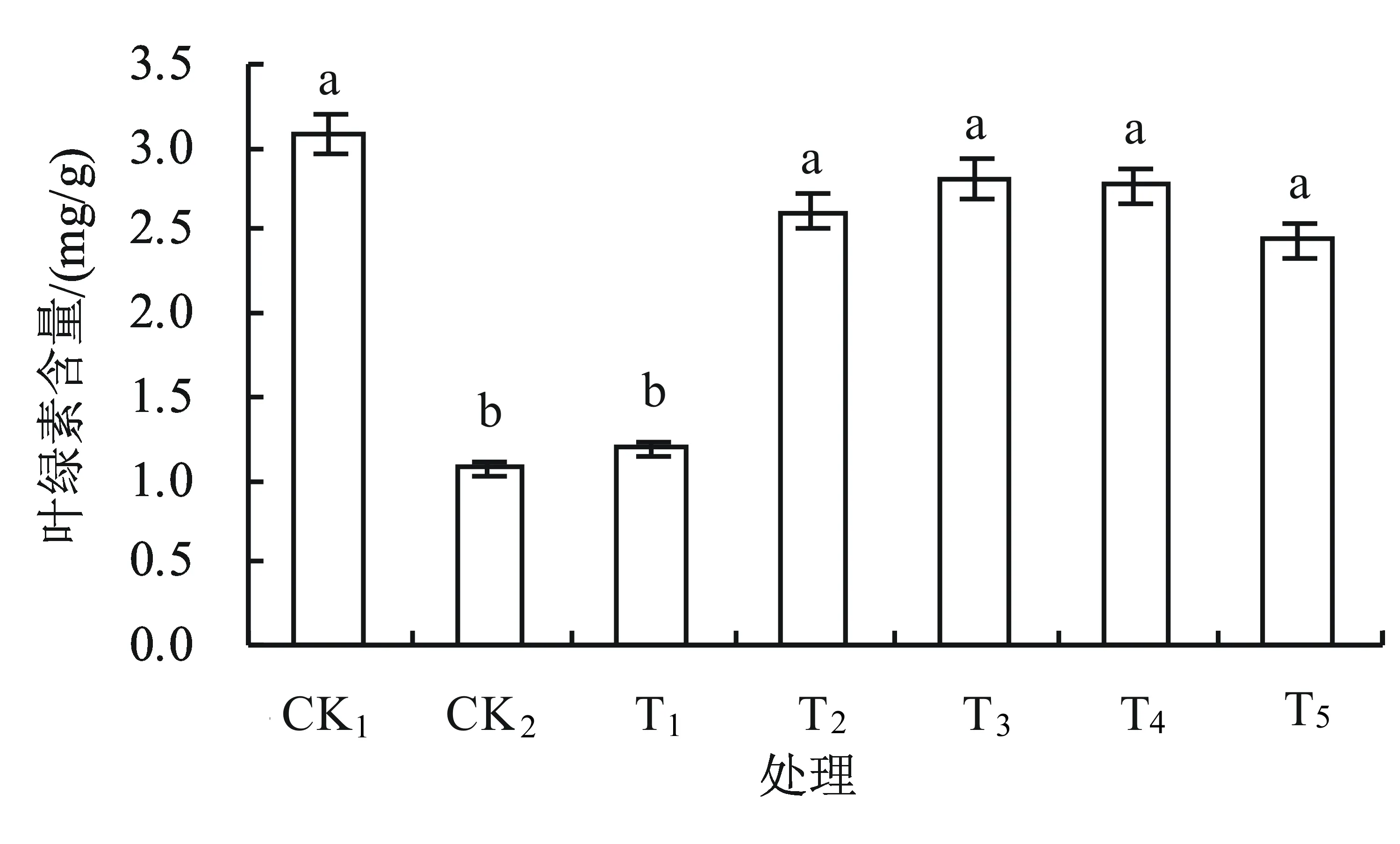
图6 外源钙对盐胁迫下丹参幼苗叶片叶绿素含量的影响
2.5 外源钙对盐胁迫下丹参幼苗叶片脯氨酸含量的影响
脯氨酸(Pro)在植物抗盐胁迫过程中扮演着重要的角色,在盐渍环境中,脯氨酸参与渗透调节,维持细胞膜稳定性,避免细胞蛋白质等有机物降解,以提高植物适应盐渍环境的能力。如图7所示,与T1相比,在盐胁迫处理下,丹参幼苗叶片脯氨酸含量显著增加,施加外源钙以后脯氨酸含量呈先升后降的趋势,在T3时达到最大,与CK1、CK2相比分别增加了168%、75%。
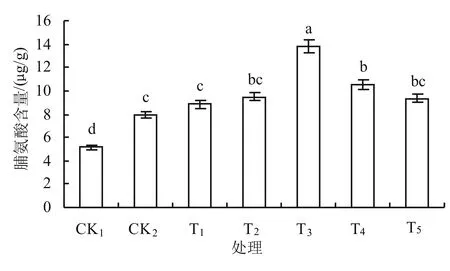
图7 外源钙对盐胁迫下丹参幼苗叶片脯氨酸含量的影响
3 讨论与结论
3.1 讨论
细胞膜在维持植物细胞的微环境和正常代谢中起着重要的作用。在盐胁迫条件下,活性氧在植物细胞中积累,加剧膜脂过氧化,破坏细胞膜系统。膜脂过氧化可产生大量的MDA,能参与细胞各种反应,MDA含量高低能够反映植株受损程度的大小。从本试验中可以得出,在盐胁迫下植物叶片中MDA的含量显著增加,说明盐分对丹参幼苗的生长产生了抑制作用,这与杨立飞等[19]的研究结果一致。在本试验中,施加外源钙以后,MDA含量与盐处理相比,其含量显著降低,外源钙可以减缓盐胁迫下细胞膜膜脂过氧化,减缓过氧化产物MDA的合成过程,即降低细胞中MDA的含量,维持细胞膜稳态。这与朱利君等[20]在研究外源氯化钙对大蒜幼苗盐胁迫伤害的缓解作用中所得出的结论一致。本研究结果表明,叶面喷施30 mmol/L CaCl2能明显缓解盐胁迫的伤害。
植物中的超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等抗氧化酶是植物体内有效的活性氧清除系统,抗氧化酶协调一致的共同作用,能有效去除植物受胁迫时产生的活性氧和过氧化产物。CAT和POD均能去除植物中产生的过量H2O2,具有稳定、保护膜结构的功能。李百伟等[21]认为,外源钙处理能提高CAT和POD的活性,有效清除盐胁迫产生的活性氧,减轻甘薯幼苗的膜损害。本试验结果表明,30 mmol/L CaCl2(T3处理)能显著提高盐胁迫下丹参幼苗CAT和POD活性,并保持较高水平。
盐渍土中Na+、Cl-等离子含量较多,使得土壤与植物根细胞之间形成渗透差,从而引起渗透胁迫,造成植物生长受抑制、作物产量下降[22]。为了降低盐害造成的渗透胁迫,植物细胞会积累渗透性溶质,特别是可溶性蛋白、可溶性糖、Pro,通常认为它们在缓解植物盐害方面具有关键作用,这些渗透调节物质通过参与细胞渗透调节,维持细胞水势,避免细胞脱水,实现细胞组织间溶液的运输、积累和分离,对各种酶的保护也具有一定的作用[22-23]。本研究发现,丹参幼苗叶片中可溶性糖、可溶性蛋白和脯氨酸含量呈先上升后下降的趋势,在T3时达到最大值,但在T4~T5时均呈现下降的趋势。刘新星等[24]的研究表明,施加外源钙会显著增加盐胁迫下豌豆幼苗渗透调节物质的含量,而CaCl2浓度与渗透调节物质的含量并不是正相关关系。盐胁迫会损害植物的细胞膜,降低植物正常生长所需的钙元素,因此,施加适量的外源钙有利于作物抵抗盐伤害,但过量的Ca2+会导致植物受到离子胁迫。
通常,当植物受到盐胁迫或其它胁迫时,叶绿体中的光系统Ⅱ(PSⅡ)将被破坏。王淑智等[25]研究表明,NaCl降低了光能俘获和电子转移的量子产率,并影响小球藻中PSⅡ的活性,从而影响植物的光合特性。在本试验中,在单盐处理下,丹参幼苗叶片中的叶绿素含量显著降低,而施加外源钙以后能有效提高盐胁迫下丹参幼苗叶片中的叶绿素含量,从而增强植物的光合作用,表明外源钙有助于维持叶绿体结构的稳定。
3.2 结论
盐胁迫能抑制丹参幼苗的生长,在外源Ca2+浓度为30 mmol/L(T3处理)时,丹参幼苗叶片中可溶性糖、可溶性蛋白、Pro含量升高,MDA含量降低,叶绿素含量增加,POD、CAT等抗氧化酶活性增强,表明施加一定浓度的CaCl2能有效缓解盐胁迫对丹参幼苗生长发育的抑制作用,增强丹参的耐盐性。
