高海拔地区维持性血液透析患者血管钙化的影响因素分析*
2019-03-06王宁宁杨丽香赵文静胡文博韩瑜德韩建芳李丽华褚夫宝
王宁宁, 杨丽香, 赵文静, 胡文博, 韩瑜德, 韩建芳, 李丽华, 褚夫宝
青海省人民医院 1血液净化中心, 4肾内科(青海西宁 810007); 2青海省中医院医保科(青海西宁 810000); 3青海大学研究生院(青海西宁 810016)
青海地区位于青藏高原东部,平均海拔>3 000 m,空气氧分压显著低于平原地区,低氧是高海拔人群面临的主要健康威胁。青海省人民医院透析中心的患者占青海地区维持性血液透析患者的1/3,具有地区代表性,低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)是缺氧状态下特异性发挥转录活性的核转录因子,在钙磷代谢、软组织钙化过程中调节氧化应激和骨代谢过程[1]。血管钙化是维持性血液透析患者心血管发病和死亡的独立危险因素,目前低海拔地区血液透析患者血管钙化的研究已经较多[2-3],但高原地区血液透析患者血管钙化的影响因素及高海拔低氧致HIF-1α水平升高在血管钙化中的可能作用,国内鲜见报道。本研究评估了高海拔地区维持性血液透析患者的一般资料,并通过与健康人群进行比较,探讨青海高海拔地区维持性血液透析患者血管钙化的特点,通过测定血液透析患者血清HIF-1α表达水平,并与成纤维细胞生长因子-23(fibroblast growth factor-23,FGF-23)和Klotho蛋白进行相关性分析,从而明确高海拔地区维持性血液透析患者血管钙化作用的影响因素及其潜在机制。
1 资料与方法
1.1 一般资料 于2016年6月至2017年6月选取青海省人民医院血液净化中心收治的高海拔地区维持性血液透析患者120例为高海拔透析组,排除标准:(1)合并恶性骨肿瘤、其他恶性肿瘤骨转移及原发性甲状旁腺功能亢进等疾病;(2)长期口服糖皮质激素;(3)消化道出血致急性失血性贫血;(4)合并外伤、创伤手术及急性胰腺炎、严重腹泻致脱水等各种急症及其他可影响血钙(Ca)、血磷(P)水平的疾病。其中男68例,女52例;年龄20~76岁,平均(48±11)岁;原发病:慢性肾小球肾炎63例,糖尿病肾病38例,高血压肾损害5例,梗阻性肾病4例,多囊肾3例,狼疮性肾炎2例,痛风性肾病2例,不明原因3例;维持透析3个月以上,血液透析2~3次/周,4 h/次。选取同期在青海省人民医院体检中心体检、排除慢性疾病,且年龄、性别构成与血液透析组相近的92例健康体检者为对照组,其中男52例,女40例;年龄20~75岁,平均(46±10)岁。两组性别、年龄比较,差异均无统计学意义(2=0.48,t=0.37,P>0.05)。研究对象均签署知情同意书,本研究经青海省人民医院伦理委员会批准。
1.2 生化指标测定 清晨空腹采血10 mL,以3 000 r/min离心10 min,留取血清,采用日立全自动生化分析仪测定血清白蛋白(ALB)、总胆固醇(TC)、三酰甘油(TG)、全段甲状旁腺激素(intact parathyroid hormone,iPTH)、血钙(Ca)、血磷(P),并计算钙磷乘积,钙磷乘积(mg2/dL2)=[Ca浓度(mmol/L)×4]×[P浓度(mmol/L)×3.1]。
1.3 血清HIF-1α、FGF-23和Klotho蛋白水平测定 血清HIF-1α、FGF-23和Klotho蛋白均采用酶联免疫吸附(ELISA)双抗体夹心法测定,试剂盒购自美国R&D公司。血清标本采集、试剂配置、操作步骤均按照说明书进行。每项检测均设3个复孔。
1.4 血管钙化检测及评分 采用X线机对高海拔透析组患者进行侧位腹部平片、髋关节正位片、双手正位片检查,评价腹主动脉、髂动脉、股动脉、桡动脉、手指动脉钙化情况。X线片血管钙化评分参照文献[4],计数每个部位的钙化情况,“有”计为1分,“无”计为0分,最终数值为0~10。1~3分为轻度钙化,4~6分为中度钙化,≥7分为重度钙化,中度钙化及以上为发生钙化。

2 结果
2.1 两组生化指标及血清指标比较 两组TC、TG、HIF-1α水平比较,差异均无统计学意义(P>0.05)。高海拔透析组ALB、Ca、Klotho蛋白水平均低于对照组,iPTH、P、钙磷乘积、FGF-23水平均高于对照组,差异均有统计学意义(P<0.05)。见表1。
2.2 高海拔透析组HIF-1α浓度与钙磷代谢指标、FGF-23和Klotho蛋白水平的相关性 高海拔维持性血液透析患者HIF-1α浓度与Ca、P和iPTH均无相关性(r=-0.050、-0.092、-0.027,P>0.05)。高海拔维持性血液透析患者HIF-1α水平与FGF-23水平呈正相关(r=0.907,P<0.001),与Klotho蛋白水平呈负相关(r=-0.161,P=0.025)。

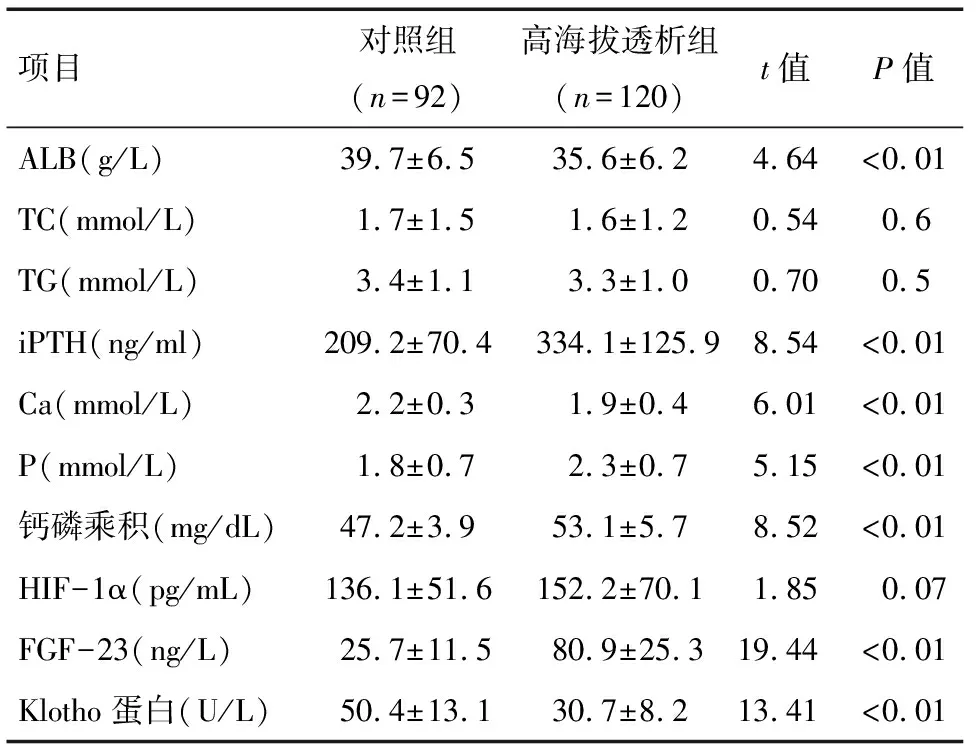
项目对照组(n=92)高海拔透析组(n=120)t值P值ALB(g/L)39.7±6.535.6±6.24.64<0.01TC(mmol/L)1.7±1.51.6±1.20.540.6TG(mmol/L)3.4±1.13.3±1.00.700.5iPTH(ng/ml)209.2±70.4334.1±125.98.54<0.01Ca(mmol/L)2.2±0.31.9±0.46.01<0.01P(mmol/L)1.8±0.72.3±0.75.15<0.01钙磷乘积(mg/dL)47.2±3.953.1±5.78.52<0.01HIF-1α(pg/mL)136.1±51.6152.2±70.11.850.07FGF-23(ng/L)25.7±11.580.9±25.319.44<0.01Klotho蛋白(U/L)50.4±13.130.7±8.213.41<0.01
2.3 高海拔透析组有无血管钙化患者的单因素分析 高海拔透析组有血管钙化患者与无血管钙化患者相比,男性患者比例、iPTH、Ca、P、钙磷乘积、HIF-1α、FGF-23水平均明显升高,Klotho蛋白明显降低,差异均有统计学意义(P<0.05)。两组ALB、TC、TG水平比较,差异均无统计学意义(P>0.05),见表2。


项目有血管钙化(n=75)无血管钙化(n=45)t/2值P值性别(例)4.380.04 男4820 女2725年龄(岁)54.3±9.145.2±8.55.43<0.01ALB(g/L)40.8±7.238.6±5.71.750.08TC(mmol/L)1.5±1.41.7±1.20.800.43TG(mmol/L)3.5±1.23.3±0.90.970.34iPTH(ng/mL)521.6±159.1212.3±68.012.36<0.01Ca(mmol/L)2.2±0.41.8±0.35.80<0.01P(mmol/L)2.5±0.82.1±0.82.650.01钙磷乘积(mg/dL)58.3±7.551.2±6.75.22<0.01HIF-1α(pg/mL)178.0±79.7139.1±62.82.800.01FGF-23(ng/L)100.2±35.072.7±24.34.64<0.01Klotho蛋白(U/L)22.3±7.134.9±8.28.88<0.01
2.4 高海拔地区维持性血液透析患者发生血管钙化的影响因素的多因素logistic回归分析 年龄、iPTH、钙磷乘积、HIF-1α、FGF-23、Klotho蛋白水平是高海拔地区维持性血液透析患者发生血管钙化的影响因素(P<0.05),见表3。

表3 高 海拔地区维持性血液透析患者发生血管钙化的影响因素的多因素logistic回归分析
3 讨论
全世界有1.4亿人口生活在高海拔地区,我国也有不少人群生活在高海拔地区,新近有研究表明青藏高原高海拔地区慢性肾脏病的发病率较全国平均水平更高[5]。目前关于高海拔地区维持性血液透析患者生理病理状态的研究较少,特别是高海拔地区血液透析患者血管钙化的研究几近缺乏[6]。目前国内学者发表的相关文献仅有1篇青藏高原高海拔地区钙化性尿毒症性小动脉病的个案报道[7],尚无较大规模的临床观察及研究。
长期生活在高海拔地区人群持续暴露在低氧的条件下,其HIF-1α水平会增加[8]。高海拔地区人群其肾脏血流及肾小球滤过率较低海拔地区降低,且高海拔环境可能会增快慢性肾脏病患者进展至终末期肾病的速度[6,9]。对于高海拔地区维持性血液透析患者,海拔差异也可导致其与低海拔患者各项生理指标的不同,可能与HIF-1α表达水平差异密切相关。研究发现,高海拔地区透析患者血红蛋白水平较平原地区高,所需要的外源性促红细胞生成素及静脉铁剂量更少,其机制可能与其内源性促红细胞生成素增多和(或)HIF-1α通过调节转铁蛋白的活性而增加机体对促红细胞生成素的反应有关[10];高海拔缺氧还可导致血液透析患者容量超负荷的风险增加[9]。
高海拔地区血液透析患者的这些不同可能与高海拔地区低氧环境导致HIF-1α表达活化改变有关[11]。HIF-1α在缺氧的肾小管上皮细胞及肾小球上皮细胞中表达,参与调节红细胞生成、血管生成、细胞凋亡和组织代谢等多种生物学过程;应用肾脏组织特异性HIF-1α基因敲除小鼠表明,肾脏HIF-1α表达缺失可抑制单侧输尿管梗阻动物模型致肾小管间质损伤、间质胶原沉积及上皮细胞转分化[12]。HIF-1α还通过对血管内皮生长因子、血红素加氧酶-1、诱导型一氧化氮合酶和环氧合酶-2的调控,从而间接影响维持性血液透析患者心血管事件的发生和严重程度[8]。进一步研究表明,HIF-1α在促进FGF-23的表达中也发挥了重要作用[13-14],而FGF-23在慢性肾脏病及维持性血液透析患者血管钙化的调节中发挥重要作用,但其在维持性血液透析患者FGF-23表达与血管钙化的关系尚不明确。
有研究表明血管钙化并非是简单的钙磷被动沉积于血管壁的过程,血管钙化的病理生理过程与骨代谢中的软骨形成过程极为相似,氧化应激、炎性细胞因子、生长因子等均参与了血管钙化的发生[15]。因此,本研究分别检测了血管钙化发生的防御性蛋白Klotho蛋白和促进性因子FGF-23水平,并进一步证实了高海拔低氧环境下血液透析患者FGF-23的表达更高,Klotho蛋白的分泌则相对减少。FGF-23是近些年发现的由骨细胞分泌的具有调节血磷代谢的刺激因素,其生理功能为抑制肾小管对磷的重吸收,减少肠道磷的吸收,从而降低血磷[16]。研究表明,高水平的血清FGF-23是血液透析患者血管钙化的独立危险因素,也是发生左心室肥厚的独立危险因素[16]。本研究结果显示,FGF-23与高海拔地区维持性血液透析患者血管钙化显著相关,其水平升高是高海拔地区血液透析患者血管钙化的重要的危险因素之一,与低海拔地区透析患者的研究结果一致。Klotho蛋白是一种具有多种生物学效应的抗衰老因子,在肾远曲小管协助FGF-23对机体进行调控,是FGF-23发挥作用所必需的信号分子;Klotho蛋白也可独立于FGF-23调节磷酸盐代谢,还可以抑制iPTH、活性维生素D的合成,直接作用于肾小管上皮细胞促进磷排泄,从而间接抑制血管钙化[17]。本研究结果显示,Klotho蛋白是高海拔地区维持性血液透析患者发生血管钙化的重要防御性保护因素。
本研究结果显示,高海拔地区维持性血液透析患者HIF-1α水平与血清Klotho蛋白呈负相关;与血清FGF-23呈正相关。由此可见,缺氧加重了血管的钙化作用,HIF-1α表达升高是高海拔地区维持性血液透析患者发生血管钙化的重要独立危险因素,可能与高海拔地区HIF-1α高表达促进了FGF-23分泌有关。
本研究不足和局限性在于高海拔地区研究对象均来自青海省人民医院血液净化中心,未进行多中心联合取样,可能导致结果不能完全代表整个青海高原地区;且HIF-1α调控FGF-23分泌的具体分子信号通路尚不十分明确。因此,后续研究需克服以上不足,使研究结果更全面、更有说服力。
综上所述,本研究探讨了高海拔地区维持性血液透析患者的一般生化指标及钙磷代谢相关因素,结果表明,高海拔血液透析患者ALB、Ca、Klotho蛋白水平显著低于对照组;iPTH、P、钙磷乘积、FGF-23水平显著高于对照组;年龄、iPTH、钙磷乘积、HIF-1α及FGF-23指标升高是高海拔地区维持性血液透析患者发生血管钙化的危险因素,Klotho蛋白水平升高是保护因素;HIF-1α可能通过调节FGF-23表达影响高海拔地区维持性血液透析患者血管钙化的发生,明确了低氧环境下HIF-1α对高海拔地区维持性血液透析患者发生血管钙化的作用,对于高海拔地区维持性血液透析患者血管钙化的防治具有重大的临床意义。
